08届高三化学12月份月考试题
考试时间:90分钟 试卷分值:100分
命题人:刘懿梅
注意:本试卷包含Ⅰ、Ⅱ两卷。第Ⅰ卷为选择题,所有答案必须用2B铅笔涂在答题卡中相应的位置。第Ⅱ卷为非选择题,所有答案必须填在答题卷的相应位置。答案写在试卷上均无效,不予记分。
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24
Al:27 Si:28 S:32 Cl:35.5 K:39 Ca:40 Fe:56 Cu:64
第Ⅰ卷(选择题 共60分)
一、选择题(本题包括20小题,每小题3分,共60分,每小题只有一个正确答案)
1.下列关于物质的量的叙述中,错误的是
A.0.012 kg 12C 中含有约6.02×1023个碳原子
B.1 mol SO2在标准状况下的体积约为22.4 L
C.1 mol水中含有2 mol 氢和1 mol 氧
D.1 mol Ne含有约6.02×1024个电子
2.NA表示阿伏加德罗常数,下列叙述中正确的是
A.通常状态下,NH4+和NH2-各1 mol含有的电子数均为10NA
B.标准状况下当氧气与氦气的原子数均为NA时,它们具有相同的体积
C.在100 mL 1 mol·L-1乙酸溶液中含乙酸的分子数为0.1 NA
D.1 mol 硫化氢在氧气中完全燃烧时,转移的电子数为2NA
3.下列各组中两种气体的分子数一定相等的是
A.温度相同、体积相同的O2和N2 B.质量相等、密度不等的N2和C2H4
C.密度相同、体积不同的CO和C2H4 D.压强相同,体积相同的O2和H2
4.配制一定物质的量浓度的KOH溶液时,造成最终浓度偏低的原因可能是
A.容量瓶事先未烘干 B.空盘时天平指针向标尺右边偏转
C.定容时观察液面仰视 D.溶解后立即转移到容量瓶进行定容
5.由CO、H2和O2组成的混和气体60 mL,在一定条件下恰好完全反应,测得生成物在101kPa 120℃下对氢气的相对密度为18.75,则原混和气体中H2所占的体积分数为
A. 1/6 B. 2/3 C. 1/4 D. 1/3
6.所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,根据下列四种金属的熔沸点判断,其中不能形成合金的是:
|
| Na | Cu | Al | Fe |
| 熔点(℃) | 97.5 | 1083 | 660 | 1535 |
| 沸点(℃) | 883 | 2595 | 2200 | 3000 |
A.Cu和Al B.Fe和Cu C.Fe和Na D.Al和Na
7.冶炼金属一般有下列四种方法:①焦炭法;②水煤气(或氢气或一氧化碳)法;③活泼金属置换法;④电解法.四种方法在工业上均有应用.古代有(Ⅰ)火烧孔雀石炼铜;(Ⅱ)湿法炼铜;现代有(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石中炼镁,对它们的冶炼方法的分析不正确的是
A.(Ⅰ)用① B.(Ⅱ)用② C.(Ⅲ)用③ D.(Ⅳ)用④
8.下列物质的溶液,能和小苏打反应,且既无气体也无沉淀产生的是
A.苏打 B.氯化氢 C.熟石灰 D.烧碱
9.可能存在的第119号未知元素,有人称为“类钫”,根据周期表结构及元素性质变化趋势,有关“类钫”的预测,说法不正确的是
A.“类钫”在化合物中是+1价 B.“类钫”具有放射性
C.“类钫”单质的密度大于l g·cm-3 D.“类钫”单质有较高的熔点
10.下列关于铜电极的叙述,正确的是
A.铜锌原电池中铜为负极,发生氧化反应
B.用电解法精炼粗铜时,粗铜作阴极
C.在镀件上电镀铜时,可用精铜作阳极
D.电解稀H2SO4制H2、O2时,可用铜作阳极
11.下列说法中正确的是:①焰色反应时呈现钠的黄光的物质一定是钠盐或有钠盐组分的混合物 ②做焰色实验的铂丝在每次实验后应用硫酸或盐酸洗干净 ③硫在氧气中燃烧发出明亮的蓝紫色光,硫焰色反应的颜色为蓝紫色 ④观察钾的火焰颜色时,通常应透过蓝色的钴玻璃去观察 ⑤测定金属或金属离子的存在,最好的方法是用焰色反应。
A.①④⑤ B.②④ C.④ D.③④
12.等物质的量的主族金属A、B、C分别与足量的稀盐酸反应,所得氢气的体积依次为VA、VB、VC,已知VB=2VC,且VA=VB+VC,则在C的生成物中,该金属元素的化合价为
A.+1 B.+2 C.+3 D.+4
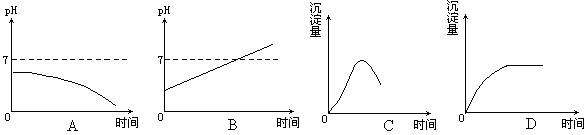 13.用石墨电极电解AlCl3溶液时,下列曲线合理的是
13.用石墨电极电解AlCl3溶液时,下列曲线合理的是
14.某溶液中加入铝粉能产生氢气,则该溶液中肯定不能大量共存的离子组是
A.AlO2-、NO3-、CO32- 、Na+ B. Na+、Al3+、H+、Cl-
C.NO3-、NH4+、K+、Cl- D.NO3-、K+、AlO2-、OH-
15.在一种酸性溶液中可能存在NO3-、I-、Cl-、Fe3+中一种或几种离子,向该溶液中加入溴水,溴单质被还原,由此可推断溶液中
A.可能会有Fe3+ B.一定会有NO3-
C.一定含有I-,不能确定是否含Cl- D.一定含有I-、NO3-和Cl-
16.下列离子方程式中正确的是
A.FeCl3溶液跟过量的Zn反应:2Fe3++3Zn=2Fe+3Zn2+
B.Fe跟稀HNO3反应:2Fe+6H+=2Fe3++3H2↑
C.Fe2(SO4)3溶液跟Ba(OH)2溶液反应:Fe3++3OH-=Fe(OH)3↓
D.Cu跟Fe2(SO4)3溶液反应:Cu+Fe3+=Cu2++Fe2+
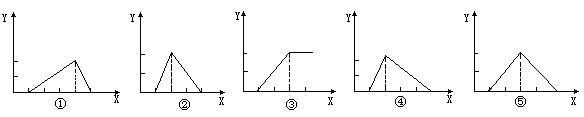
17.Zn(OH)2是两性氢氧化物,和强酸反应时生成Zn2+,跟强碱反应时生成ZnO22-。现有三份等物质的量浓度、等体积的MgCl2、ZnCl2、AlCl3溶液(配制时均加入少量盐酸),现将一定浓度的NaOH溶液,分别滴入三种溶液中到过量,各溶液中滴入的NaOH溶液的体积x(mL)与生成沉淀的物质的量y(mol)的关系如下图所示,则与MgCl2、ZnCl2、AlCl3三种溶液一一对应的正确图像是
A.③②④ B.③⑤④ C.③⑤① D.③②①
18.等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变成原体积的8/9(同温同压),这时混合气体中N2、O2、CO2物质的量之比为
A.3∶4∶1 B.3∶3∶2 C.6∶7∶3 D.6∶9∶0
19.向90mL0.1mol/L的AlCl3溶液中,投入a g金属钠,欲使最终无沉淀生成,则a的最小值为
A.0.621 B.1.242 C.0.414 D.0.828
20.取Fe和Fe2O3的混合物15 g,加入150 mL 2 mol/L的稀硫酸,固体混合物完全溶解,放出气体1.68L(标准状况下),向所得溶液中滴入硫氰化钾溶液,未见颜色变化。若要使该溶液中的铁元素完全转化为沉淀,需加入3 mol/L的NaOH溶液的体积为
A.150 mL B.200 mL C.225 mL D.250 mL
第Ⅱ卷(非选择题 共40分)
二、填空题(本题包括21~26小题,每空2分,共32分)
21.(1)48 g RO42- 中,核外电子总数比质子总数多 6.02×1023 个,则R元素的摩尔质量为 。
(2)有一真空瓶的质量为M1 g ,该瓶充入空气后总质量为M2 g;在相同状况下,若改充某气体A后,总质量为M3 g,则A的相对分子质量为 。
22.(1)由Al3+制Al(OH)3最好的方法是加入 ,写出反应的离子方程式 。
(2)由AlO2-制Al(OH)3最好的方法是通入 ,写出反应的离子方程式 。
23.现有Al3+、Ba2+、Mg2+、Ag+四种离子的混合溶液,若要使这四种离子依次成为沉淀从溶液中分离出来(可供选择的粒子为H+、OH-、NH4+、Cl-、NO3-、SO42-、CO32-及CO2),则应加入的粒子的最佳选择及顺序依次为 。
24.把27 g Al粉和一定量的Fe3O4粉混合均匀,配成铝热剂,分成两等份。
(1)前一份在高温下恰好完全反应,且能放出207.54kJ热量,写出此反应的热化学方程式 。
(2)将前一份所得的生成物与足量的盐酸充分反应;后一份直接加入足量的氢氧化钠溶液使之充分反应。前后两种情况下生成气体的物质的量之比为 。
25.工业上制纯碱是根据NaHCO3溶解度比NaCl、Na2CO3、NH4Cl、NH4HCO3都小的性质,在适宜温度下运用:CO2+NH3+H2O+NaCl→NaHCO3+NH4Cl等反应原理制取的。欲在实验室通过上述过程和其它的必要反应制取纯碱,可用下列图示中的①②③④几个步骤,其中A、B分别代表CO2和NH3之一。
![]()
(1)操作③所得到的晶体是下列的____;
A.NH4Cl B.NaHCO3 C.Na2CO3 D.NH4HCO3
(2)对于上述过程,下列叙述正确的是 。
A.气体A是CO2,气体B是NH3
B.气体A是NH3,气体B是CO2
C.步骤④是加热
D.①②两步操作的顺序与两种气体溶解度有重要的关系,不能颠倒
26.已知固体甲、E、I、F均为常见的单质,其中E在常温下为无色气体。W是由两种短周期元素组成,且两元素的原子个数比为4∶3。乙通常是一种红棕色粉末。G为白色胶状沉淀。W、G、H、I四种物质中都含有同一种的短周期金属元素。A在常温下为气态,与氧气完全反应时的体积比是1∶2。各物质有如下图所示的转化关系(部分反应的产物未全部表示)。试回答下列问题:
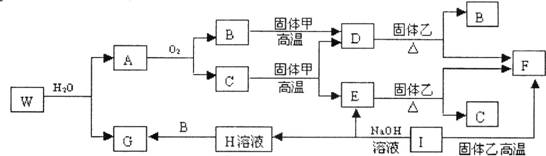
(1)W的化学式为 ,B的电子式为 ;
(2)在上述转化关系图中,C→E、D→F、E→F、I→F、I→E、A→B等反应中有多个反应属于置换反应,根据要求写出化学方程式。
非金属元素之间的置换反应 ;
金属元素之间的置换反应 ;
(3)在I→E反应中,每生成1mol E,转移电子数为 。
 三、计算题(本题8分)
三、计算题(本题8分)
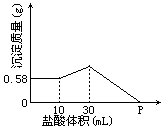
27.把由NaOH,AlCl3,MgCl2三种固体组成的混合物溶于足量水中后有0.58 g白色沉淀。在所得浊液中逐滴加入0.5 mol/L盐酸,加入盐酸的体积与生成沉淀的质量关系如右图所示:
计算:①混合物中NaOH质量是多少克?
②P点所表示的盐酸的体积是多少毫升?