08届高三化学12月统一考试试题
化学
本试卷可能用到相对原子质量:
H-1,C-12,O-16,Na-23,Al-27,S-32。
第Ⅰ卷(共66分)
一、选择题:(本题共10分,每小题只有一个选项符合题意。)
1.所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,根据下列四种金属的熔沸点:
|
| Na | Cu | Al | Fe |
| 熔点 | 97.5.C | 1083℃ | 660℃ | 1535℃ |
| 沸点 | 883℃ | 2595℃ | 2200℃ | 3000℃ |
其中不能形成合金的是
A.Cu和Na B.Fe与Cu C.Cu与Al D.Al与Na
2.下列关于工业生产说法不正确的是
A.工业上采用电解熔融氯化铝的方法制取金属铝
B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率
C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室
D.在侯氏制碱工业中,向饱和氯化钠溶液中先通氨气,后通二氧化碳
3.已知硅在自然界中有3种同位素,![]() ,
,![]() ,
,![]() .硅的近似相对原子质量为28.1,下列关于
.硅的近似相对原子质量为28.1,下列关于![]() 原子的含量的说法,正确的是
原子的含量的说法,正确的是
A.大于90% B.小于90% C.等于90% D.无法判断
4.某非金属单质A和氧气发生化合反应生成B。B为气体,其体积是反应掉氧气体积的两倍(同温同压)。以下对B分子组成的推测一定正确的
A.有1个氧原子 B.有2个氧原子 C. 有1个A原子 D. 有2个A原子
5.下列反应,其产物的颜色按红、红褐、淡黄、蓝色顺序排列的是
①金属钠在纯氧中燃烧 ② FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间
③FeCl3溶液中滴入KSCN溶液 ④ 无水硫酸铜放入医用酒精中
A.②③①④ B.③②①④ C.③①②④ D.①②③④
二、选择题:(本题共36分,每小题只有一个选项符合题意。)
6.下列离子方程式正确的是
A.硫酸铝溶液中加过量氨水:Al3+ + 4OH- → AlO2- + 2H2O
B.用氨水吸收少量的SO2:NH3·H2O+SO2→NH4++HSO3-
C.石灰乳中充入足量SO2: OH- + SO2→HSO3-
D.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至沉淀刚好完全:
Ba2+ + 2OH- + NH4+ +H+ + SO42- →BaSO4↓+ NH3·H2O + H2O
7.右图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是
 A.大理石和稀硫酸制取二氧化碳 B.锌粒和稀硫酸制氢气
A.大理石和稀硫酸制取二氧化碳 B.锌粒和稀硫酸制氢气
C.浓盐酸和二氧化锰制取氯气 D.电石和水制取乙炔
8.把9.0 g乙二酸与某二元醇混和,在一定条件下完全酯化,生成W g环酯和3.6 g水,则该二元醇的相对分子质量可以表示为
A.![]() B.
B.![]()
C.![]() D.
D.![]()
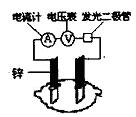
9.有甲、乙两位同学,他们一起做了水果电池的实验,测得数据如下:
| 实验次数 | 电极材料 | 水果品种 | 电极间 距/cm |
/mV | |
| 1 | 锌 | 铜 | 菠萝 | 3 | 900 |
| 2 | 锌 | 铜 | 苹果 | 3 | 650 |
| 3 | 锌 | 铜 | 柑 | 3 | 850 |
| 4 | 锌 | 铜 | 西红柿 | 3 | 750 |
| 5 | 锌 | 铝 | 菠萝 | 3 | 650 |
| 6 | 锌 | 铝 | 苹果 | 3 | 450 |
甲同学提出的问题,乙同学解释不正确的是
| 甲同学 | 乙同学 | |
| A | 实验6中的负极电极反应如何写? | 铝为负极:Al-3e-=Al3+ |
| B | 实验1,5电流方向为什么相反? | 1中锌为负极,电流由铜经导线到锌,5中铝为负极,铝失去电子,电流由锌经导线流向铝 |
| C | 水果电池的电压与哪些因素有关? | 只跟水果的类型有关 |
| D | 实验中发光二极管不太亮,如何使它更明亮起来? | 可用铜锌作电极,用菠萝作介质,并将多个此电池串联起来 |
10.下列实验操作中错误的是
A.分液时下层液体从分液漏斗下口放出后,换个盛器,继续从下口放出上层液体。
B.为了加速固体的溶解,常采取搅拌、加热等方法。
C.使用pH试纸检验气体的酸碱性时,先把pH试纸用蒸馏水湿润后,再检验
D.滴定管装液前,应该检查是否漏水。
11.下列各组项目包含的数据关系中,前者比后者大的是
A.氨水与氯水中的粒子种数
B.同温下100 mL 0.1 mol•L—1 CH3COOH与10 mL 1 mol•L—1 CH3COOH溶液的pH
C.金属镁与金属铝的熔点
D.在物质的量浓度和体积都相等的NaAc和NaCl溶液中总离子数目
12.将铝条插入盛有CuCl2浓溶液的烧杯,反应过程中最不可能出现的现象是
A.产生无色气体 B.产生蓝色絮状沉淀
C.紫红色固体析出 D.黄绿色气泡逸出
13、莽草酸是一种合成治疗禽流感药品的原料,鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物说法正确的是
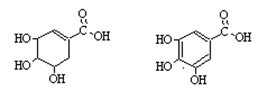

莽草酸 鞣酸
A.莽草酸溶于水遇三氯化铁溶液显紫色
B.各1摩尔的莽草酸和鞣酸都可和4molNaOH溶液反应
C.鞣酸分子与莽草酸分子比较,多了二个碳碳双键
D.莽草酸与鞣酸都能与溴水作用,但反应类型不同
14、由某烯烃和烷烃组成的混和气体对氢气的相对密度为12,则此混和气体中烯烃的体积分数X与烯烃分子中碳原子数n的关系是:
A、X=4(1+2n)/7n B、n=4(1-2x)/7x
C、X=4/(7n-8) D、无法比较
15.下列三种有机物是某些药物中的有效成分。
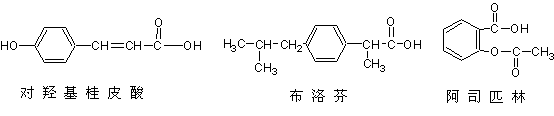
下列说法正确的是
A.三种有机物都能发生水解反应
B.三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种
C.将等物质的量的三种物质加入氢氧化钠溶液中,对羟基桂皮酸消耗氢氧化钠最多
D.使用FeCl3溶液和稀酸可以鉴别这三种有机物
16.下列叙述正确的是
A.由两种元素构成的共价化合物所含的化学键都是极性键
B.两种元素原子间形成的共价键都是极性键
C.只要是离子化合物,其熔点肯定比共价化合物高
D.一种元素组成的物质一定是纯净物
17.在一条件下,可逆反应2A(气)+B(气)![]() nC(固)+D(气)达平衡。若维持温度不变,增大强压,测得混合气体的平均相对分子质量不变,则下列判断正确的是( )
nC(固)+D(气)达平衡。若维持温度不变,增大强压,测得混合气体的平均相对分子质量不变,则下列判断正确的是( )
(A)其它条件不变,增大压强,平衡不发生移动
(B)其它条件不变,增大压强,混合气体的总质量不变
(C)该反应式中n值一定为2
(D)原混合气中A与B的物质的量之比为2:1,且![]() (其中M表示物质的摩尔质量)
(其中M表示物质的摩尔质量)
三、选择题(本题共20分,有一个或二个正确选项)
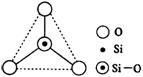 18.如右图所示,某硅氧离子的空间结构示意图(虚线不表示共价键)。通过观察分析,下列叙述正确的是
18.如右图所示,某硅氧离子的空间结构示意图(虚线不表示共价键)。通过观察分析,下列叙述正确的是
A.键角为120° B.化学组成为SiO32-
C.键角为109°28′ D.化学组成为SiO44-
19.某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-
中的若干种组成。取该溶液进行如下实验:(1)取适量溶液,加入过量盐酸,
有气体生成,并得到无色溶液;(2)在(1)所得溶液中加入过量NH4HCO3溶
液,有气体生成,同时析出白色沉淀甲;(3)在(2)所得溶液中加入过量Ba(OH)2
溶液,也有气体生成,同时析出白色沉淀乙。则下列离子在原溶液中一定存在
的是
A.Na+ B.Al3+
C.CO32- D.SO42-
20.取0.2mol·L-1HX溶液与0.2mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH = 8,则下列说法(或关系式)正确的是
A.混合溶液中由水电离出的c(OH¯)<0.2mol·L-1HX溶液中由水电离出的c(H+)
B.c(Na+) = c(X¯) + c(HX) = 0.2mol·L-1
C.c(Na+)-c(X¯) = 9.9×10-7mol·L-1
D.c(OH¯)-c(HX) = c(H+) = 1×10-8mol·L-1
21.一些烷烃的燃烧热(KJ/mol)如下表:
| 化合物 | 燃烧热 | 化合物 | 燃烧热 |
| 甲烷 | 891.0 | 正丁烷 | 2878.0 |
| 乙烷 | 1560.8 | 异丁烷 | 2869.6 |
| 丙烷 | 2221.5 | 2-甲基丁烷 | 3531.3 |
下列表达正确的是
A.热稳定性:正丁烷>异丁烷
B.乙烷燃烧的热化学方程式为:
2C2H6(g)+7O2(g)→4CO2(g)+6H2O(g)+1560.8KJ
C.正戊烷的燃烧热大约在3540 KJ/mol左右
D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
22.环己醇、丙酮(CH3COCH3)和戊醛(CH3CH2CH2CH2CHO)的混合物2.000g完全燃烧后,所得气体通过P2O5吸收瓶,吸收瓶增重1.998g,则混合物的平均分子量为
A.74.75 B.86.00 C.71.75 D.81.33
第II卷(共66分)
四、(本题共24分)
23.在氯酸钾的分解反应里,二氧化锰的催化问题到目前还没有肯定的解释。鉴于制得的氧气中有氯气的气味,生成的氯化钾又略显紫红色,认为反应过程如下:
Ⅰ:2KClO3+2MnO2→2A+B↑+C↑ Ⅱ:2A→D+MnO2+C↑
Ⅲ:B+D→2KCl+MnO2+O2↑
根据催化剂定义,反应前后化学性质和质量不变。回答下列问题:
(1) B气体化学式为___________,A固体化学式为________________。
(2) I式反应被氧化的元素为___________________。
(3) 反应Ⅲ的化学方程式为 。
(4) 按照上述反应过程,若生成1.5molO2,总共有 mol电子发生转移。
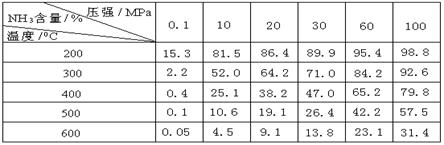 24.工业合成氨时将N2和H2按体积比为1 :3通入合成塔中,在不同条件下达到平衡时,混合物中NH3的含量(体积分数)如下表:
24.工业合成氨时将N2和H2按体积比为1 :3通入合成塔中,在不同条件下达到平衡时,混合物中NH3的含量(体积分数)如下表:
(1)根据表中数据并应用化学平衡移动原理,分析为提高平衡混合物中NH3的含量,可采取的措施是 (多选或选错均不给分)
A.增大压强 B.减小压强 C.提高温度 D.降低温度
 (2)根据表中数据,画出在30MPa下,
(2)根据表中数据,画出在30MPa下,
NH3的百分含量随温度的变化曲线图。
在实际生产中,控制温度在500℃左右,其原因是
。
(3)在500℃、30 MPa条件下反应达到平衡时H2的转化率为 ;若在某条件下平衡混合物中NH3的百分含量为a%,原混合气体与平衡混合气体的总物质的量之比__________(用含a的代数式表示)。
25.下表是元素周期表的一部分,表中所列字母分别代表一种元素。
| a | |||||||||||||||||
| b | c | d | e | ||||||||||||||
| f | g | ||||||||||||||||
| h | i | ||||||||||||||||
回答下列问题:
(1)以上指定元素形成的单质中,熔点最低的是________(填化学式);
(2)由a、c、d三种元素形成的化合物中,能促进水电离的是________(填其中一种物质的化学式),能抑制水电离的是_________(填其中一种物质的化学式)。
(3)e元素位于周期表中第____周期____族。b、c、d、e、h元素的氢化物中,热稳定性最大的是_____(填氢化物的化学式)。
(4)f、g元素的单质共5.0 g在100 mL水中完全反应,生成的溶液中只含有一种溶质分步写出发生反应的化学方程式:
① ____ ___ ②
所得溶液的物质的最大浓度为 mol/L。(液体的体积变化忽略不汁)
五、(本题共24 分)
26.Ag/а—Al2O3是石油化学工业中的一种重要的催化剂,其中Ag起催化作用,а—Al2O3是载体且不溶于硝酸,该催化剂的回收实验如下图所示。其中的转化反应为:
6AgCl + Fe2O3 → 3Ag2O + 2FeCl3 阅读实验流程,完成下列填空:
(1) Ag/а—Al2O3加酸溶解应该选用装置_______________(选填a、b、c)。
(2)
在实验操作(VII)从AgNO3溶液获得AgNO3晶体需要进行的实验操作依次为:_________________(多选扣分)
(a)蒸馏 (b)蒸发 (c)灼烧
(d)过滤 (e)冷却结晶
(3)
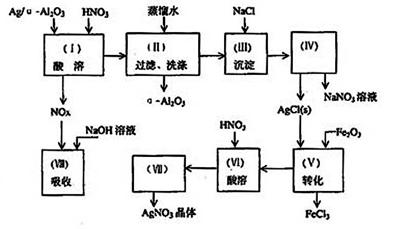 |
 在实验操作(II),如果用自来水代替蒸馏水进行洗涤,将会发生化学反应的离子方程式____________________________________________________________。
在实验操作(II),如果用自来水代替蒸馏水进行洗涤,将会发生化学反应的离子方程式____________________________________________________________。
(4) 在实验操作(IV)所需玻璃仪器为___________________________。(填写三种)。
(5)
已知:NO
+ NO2 +2NaOH → 2NaNO2 + H2O;
2NO2 +
2NaOH → NaNO3 + NaNO2 + H2O
NO和NO2的混合气体的组成可表示为NOx,该混合气体通入NaOH溶液被完全吸收时,x的值为___________。
(a)x≤1.5
(b)x=1.2
(c)x≥1.5
(6) 已知Ag/а—Al2O3中Ag的质量分数,若计算Ag的回收率,还必须知道的实验数据为____________和_______________。
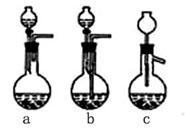
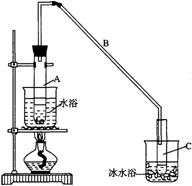 27.某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
27.某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
已知: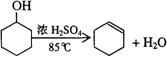
| 密度 | 熔点 | 沸点 | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是__________,导管B除了导气外还具有的作用是__________。
②试管C置于冰水浴中的目的是___________________________________________。
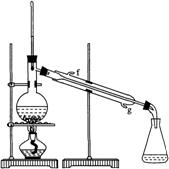 (2)制备精品
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________(填入编号)洗涤。
A KMnO4溶液 B 稀H2SO4 C Na2CO3溶液
②再将环己烯按右图装置蒸馏,冷却水从________口进入。蒸馏时要加入生石灰,目的是__________________。
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是( )
A 蒸馏时从70℃开始收集产品 B 环己醇实际用量多了
C 制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_________。
A 用酸性高锰酸钾溶液 B 用金属钠 C 测定沸点
六、(本题共20分)
28.(1)烷烃分子中的基团可能有四种:一CH3、一CH2、一CH、一C一,其数目分别用a、b、c、d表示,对烷烃(除甲烷外)中存在的关系作讨论:
①下列说法正确的是:
A. a的数目与b的数目没有因果联系。 B. c增加1,a就会增加3
C. d增加1,a就会增加2 D. b增加1, a就会增加2
②若某烷烃分子中, b=c=d=1,则满足此条件的该分子的结构可能有 种,写出其中一种的名称 _________________________________ 。
![]() (2) 某烃的组成为C15H24,分子结构非常对称。有关实验证实该烃中仅存在三种基团:乙烯基(-CH=CH2)、亚甲基(—CH2—)、次甲基(—CH—),并且乙烯基和次甲基之间必须通过亚甲基相连,相同基团之间不相连。
(2) 某烃的组成为C15H24,分子结构非常对称。有关实验证实该烃中仅存在三种基团:乙烯基(-CH=CH2)、亚甲基(—CH2—)、次甲基(—CH—),并且乙烯基和次甲基之间必须通过亚甲基相连,相同基团之间不相连。
试填写:
① 该烃分子中无环,则含乙烯基__________个,
该烃的结构简式为__________ 。
②若该烃分子中有一个环,则其结构简式为___________。
![]() 29、 生产工程塑料PBT( )的重要原料G(1,4-丁二醇),可以通过下图三种不同的合成路线制备。又知B的所有原子处于同一平面。
29、 生产工程塑料PBT( )的重要原料G(1,4-丁二醇),可以通过下图三种不同的合成路线制备。又知B的所有原子处于同一平面。
请你结合下列所给有关信息,回答问题。
Ⅰ.CH2=CH-CH=CH2与Br2的CCl4溶液发生1∶1加成可得到BrCH2-CH=CH-CH2Br和BrCH2-CHBr-CH=CH2二种产物。
![]()
![]() Ⅱ.2R-Cl+2Na
R-R+2NaCl
Ⅱ.2R-Cl+2Na
R-R+2NaCl
Ⅲ.
![]() Ⅳ.
Ⅳ.
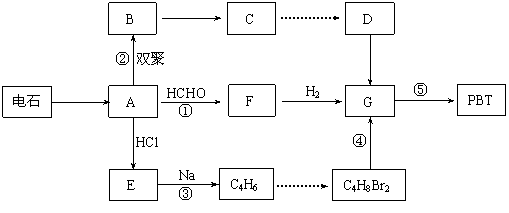
⑴写出E和F的结构简式: 、 。
⑵写出反应⑤的化学反应方程式: 。
⑶请你设计出由B→C…→D的反应流程图(有机物用结构简式表示,必须注明反应条件)。
![]() 提示:①合成过程中无机试剂任选 ②反应流程图表示方法示例如下:
提示:①合成过程中无机试剂任选 ②反应流程图表示方法示例如下:
![]()
![]() B C
…… G
B C
…… G
七、(本题共16分)
30.取3.40g只含羟基,不含其他官能团的液态饱和多元醇,置于5.00L氧气中,经点燃,醇完全燃烧。反应后气体体积减少0.56L,将气体经CaO吸收,体积又减少2.80L(所有体积均在标准状况下测定)。
(1) 3.40g醇中,C 、H、 O物质的量分别为:
C mol,H _____mol,O mol;该醇中C、H、O的原子数之比为 。
(2)由以上比值能否确定该醇的分子式,其原因是 。
(3) 如果将该多元醇的任意一个羟基换成卤素原子,所得到的卤代物都只有一种,试写出
该饱和多元醇的结构简式: 。
31.Na2S2O3·5H2O(俗称海波)是照相业常用的一种定影剂。工业上制得的Na2S2O3·5H2O晶体中可能含有少量的Na2SO3和Na2SO4杂质。为了测定某海波样品的成分,称取三份质量不同的该样品,分别加入相同浓度的硫酸溶液30mL,充分反应后滤出硫,微热滤液使生成的SO2全部逸出。(Na2S2O3+H2SO4→Na2SO4+SO2↑+S↓+H2O)
(1)测得有关实验数据如下(标准状况):
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 7.54 | 15.08 | 35.00 |
| 二氧化硫的体积/L | 0.672 | 1.344 | 2.688 |
| 硫的质量/g | 0.8 | 1.6 | 3.2 |
(摩尔质量:Na2S2O3·5H2O 248g/mol ;Na2SO3 126g/mol;Na2SO4 142 g/mol)
计算所用硫酸溶液的物质的量浓度。
(2)分析以上实验数据,该样品中(填写选项字母) 。
A 仅含有Na2S2O3·5H2O
B 含有和Na2S2O3·5H2O和Na2SO3,无Na2SO4
C 含有Na2S2O3·5H2O、Na2SO3和Na2SO4
(3)若将30.16g该样品和一定量的上述硫酸溶液混合微热。试讨论:当加入硫酸的体积(aL)在不同取值范围时,生成的SO2体积(bL)的值(可用含a的关系式表示)。
化学试题答题纸
第I卷(共66分)
一、选择题
| 1 | 2 | 3 | 4 | 5 |
二、选择题
| 6 | 7 | 8 | 9 | 10 | 11 |
| 12 | 13 | 14 | 15 | 16 | 17 |
三、选择题
| 18 | 19 | 20 | 21 | 22 |
第II卷(共84分)
四、(本题共24分)
23.(1)___________,_______________。
(2)___________________。
(3) 。
 (4) mol。
(4) mol。
24.
(1) 。
(2)
。
(3) ; _____________。
25.
(1)________;
(2)________, _________。
(3)_____,_____。_____。
(4)
① ____ ___ ②
mol/L。
五、(本题共24 分)
26.
(7) _______________。
(8) _________________。
__________________________________________________________。
(9)
___________________________。
(10)
___________。
(11) ____________和_______________。
27.(1)制备粗品
①______________________, ________________________。
②___________________________________________。
(2)制备精品
①_________层, _________。
②________________________________________________。
③_________,( )
(3)_________。
六、(本题共20分)
28.(1) ①:
② _________________________________ 。
(2) __________,__________ 。
②___________。
29、 ⑴ 、 。
⑵ 。
⑶
七、(本题共16分)
30.
(1) C mol,H _____mol,O mol; 。
(2) 。
(4) 。
31.
样品的成分________________________________
各成分的物质的量之比______________________________________________________。
化学试题答题纸
一、选择题
| 1 A | 2 A | 3 A | 4 A | 5 B |
二、选择题
| 6 D | 7 B | 8 A | 9 C | 10 A | 11 B |
| 12 D | 13 D | 14 C | 15 D | 16 B | 17 D |
三、选择题
| 18 C、D | 19 A、C | 20 C、D | 21 C | 22 A |
四、
23、(1) Cl2 KMnO4 (2) Mn O (3) K2MnO4+Cl2→2KCl+MnO2+O2↑ (4) 9。
24、(1) A、D (2) 图略 (3) 41.8% 100+a/100。
25、(1) H2 (2) NH4NO3 (3) 二、VIIA HF
(4) 2Na+2H2O→2NaOH+H2↑ 2NaOH+2Al+2H2O→2NaAlO2+3H2↑
五、
26、(1)a (2)b、e、d (3) Ag++Cl-→AgCl↓(4)漏斗、烧杯、玻棒
(5) c (6)催化剂的质量,AgNO3的质量
27、(1)①防暴沸 冷凝 ②防止环己烯挥发(2)①上层 C ②g 使水转化为氢氧化钙,提高蒸馏产品环已烯的纯度。 ③83oC b (3) B、C
六、
28、(1)① A、C ②2,2,2,3-三甲基-戊烷
(2) ① 4 略 ② 略
29、⑴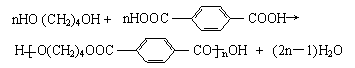 CH2=CHCl
HOCH2C≡CCH2OH
CH2=CHCl
HOCH2C≡CCH2OH
⑵
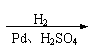 | |||
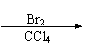 | |||
⑶ CH≡CCH=CH2 CH2=CHCH=CH2
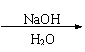
![]()
CH2BrCH=CHCH2Br Br(CH2)4Br HO(CH2)4OH
七、
30、(1) 0.125 0.3 0.1 ,5:12:4 (2)是,因为最简式碳与氢比值已经达到饱和。
(3)( HOCH2)3C-CH2-Cl。
31、 (1)4mol/L (2)C
(3)当0<a<0.03L时,b=89.6aL 当a>0.03L时,b=2.688L
 电压
电压