08届高三化学上册第一次月考试卷
化学试卷
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Ca 40 Fe 56 Cu 64
第Ⅰ卷(选择题,共56分)
一、单项选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意。)
1.设NA代表阿伏加德罗常数,下列说法正确的是
A.5.6 g铁与足量盐酸反应转移的电子数为0.3NA
B.100 mL 2.0 mol/L的盐酸与醋酸溶液中氢离子均为0.2NA
C.标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2 NA
D.常温常压下,20 g重水(D2O)中含有的电子数为10NA
2.关于胶体和溶液的叙述中正确的是
A.胶体带电荷,而溶液呈电中性
B.胶体加入某些盐可产生沉淀,而溶液不能
C.胶体是一种介稳性的分散系,而溶液是一种非常稳定的分散系
D.胶体能够发生丁达尔现象,溶液也能发生丁达尔现象
3.下列叙述正确的是
A.在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原
B.有单质参加的反应一定是氧化还原反应
C.有单质参加的化合反应一定是氧化还原反应
D.失电子难的原子,容易获得的电子
4.在配制一定物质的量浓度的盐酸溶液时,下列错误操作可使所配制溶液浓度偏高的是
A.用量筒量取浓盐酸时俯视读数 B.溶解搅拌时有液体飞溅
C.定容时俯视容量瓶瓶颈刻度线 D.摇匀后见液面下降,再加水至刻度线
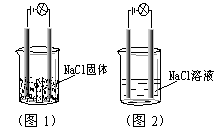 5.一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是
5.一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是
A.NaCl是非电解质
B.NaCl溶液是电解质
C.NaCl在水溶液中电离出了可以自由移动的离子
D.NaCl溶液中水电离出大量的离子
6.下列条件下,两瓶气体所含原子数一定相等的是
A.同质量、不同密度的N2和CO B.同温度、同体积的H2和N2
C.同体积、不同密度的C2H4和C3H6 D.同压强、同体积的N2O和CO2
7.下列离子方程式中正确的是
A.硫酸镁溶液和氢氧化钡溶液反应 SO42-+Ba2+ ==BaSO4↓
B.铜片加入稀硝酸中:Cu +2NO3- + 4H+== Cu2+ + 2NO2↑ + 2H2O
C.FeBr2溶液中加入过量的氯水 2Fe2++2Br-+2Cl2 ==Br2+4Cl-+2Fe3+
D.等体积等物质的量浓度的NaHCO3和Ba(OH)2两溶液混合:
HCO3- + Ba2+ + OH-== BaCO3↓ + H2O
8.氢化钙可以作为生氢剂(其中CaH2中氢元素为-1价),反应方程式如下:CaH2+2H2O=Ca(OH)2+2H2↑,其中水的作用是
A.既不是氧化剂也不是还原剂 B.是氧化剂
C.是还原剂 D.既是氧化剂又是还原剂
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
11.下列有关溶液性质的叙述,正确的是
A.室温时饱和的二氧化碳水溶液,冷却到0℃时会放出一些二氧化碳气体
B.强电解质在水中溶解度一定大于弱电解质
C.相同温度下,把水面上的空气换成相同压力的纯氧,100g水中溶入氧气的质量增加
D.将40℃的饱和硫酸铜溶液升温至50℃,或者温度仍保持在40℃并加入少量无水硫酸铜,在这两种情况下溶液中溶质的质量分数均保持不变。
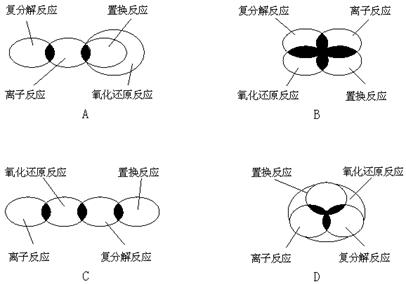
9.离子反应、复分解反应、置换反应和氧化还原反应之间可用集合关系表示,其正确的是
10.有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的c(Na+)/mol·L-1为
A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a
12.已知 I—、Fe2+、SO 2、Cl—和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为 Cl—< Fe 2+< H2O 2 < I—< SO 2,则下列反应不能发生的是( )
A.2Fe3++SO2+2H2O=2Fe2++SO42—+4H+ B.I2+SO2+2H2O=H2SO4+2HI
C.H2O2+H2SO4=SO2+O2+2H2O D.2Fe2++I2=2Fe3++2I—
![]() 13.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是:
13.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是:
A.KClO3在反应中得到电子 B.ClO2是氧化产物
C.H2C2O4在反应中被氧化 D.1mol KClO3参加反应有2 mol电子转移
14.在海水中提取溴的反应原理是5NaBr+NaBrO+3H2SO4=3Br2 +3Na2SO4+ 3H2O下列反应的原理与上述反应最相似的是 :
A. 2NaBr+Cl2=2NaCl+Br2
B.2FeCl3+H2S=2FeCl2+S+2HCl
C. 2H2S+SO2=3S+2H2O
D.AlCl3+3NaAlO3+6H2O=4Al(OH)3+3NaCl
15. 下列各组离子能在指定溶液中,大量共存的是 :
①无色溶液中:K+,Cu2+,Na+,MnO4—,SO42—
②使pH=11的溶液中:CO32—,Na+,AlO2—,NO3—
③加入Al能放出H2的溶液中:Cl—,HCO3—,NO3—,NH4+
④加入Mg能放出H2的溶液中: NH4+,Cl—,K+,SO42—
⑤使石蕊变红的溶液中:Fe3+,MnO4—,NO3—,Na+,SO42—
⑥酸性溶液中:Fe2+,Al3+,NO3—,I—,Cl—
A ①②⑤ B ①③⑥ C ②④⑤ D ①②④
16.R2O8n-离子在一定条件下可以把Mn2+离子氧化为MnO4-,若反应后R2O8n-离子变为RO42-离子,又知反应中氧化剂与还原剂的物质的量之比为5:2,则n的值是:
A.1 B.2 C.3 D.4
 08届高三化学上册第一次月考试卷
08届高三化学上册第一次月考试卷
第Ⅱ卷(非选择题,共64分)
请同学们把1~16答案填入下表:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
|
|
|
|
|
|
|
|
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
|
|
|
|
|
|
|
|
三、(本题包括2小题,共16分)
17.(4分)根据交叉分类法,请用斜线将下面框图的盐与盐的分类连接起来:
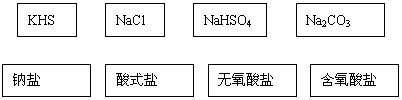 |
18.(12分)KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯。其变化可表述为:
aKClO3 +bHCl(浓)——cKCl +dClO2 +eCl2↑ + fH2O
⑴、浓盐酸在反应中显示出来的性质为 、 ;还原产物为(填名称) 。
⑵、根据Cl元素守恒得a、b、c、…的关系式为 。
⑶、产生2mol ClO2 ,则转移的电子的物质的量为____________ mol 。
⑷、写出该反应的离子方程式____________ _______。
四、(本题包括1小题,共10分)
19.(10分)用![]() 的硫酸配制
的硫酸配制![]() 硫酸,若实验仪器有:
硫酸,若实验仪器有:
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.20mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
(1)实验时应选用仪器的先后顺序是(填入编号)_________________________。
(2)在容量瓶的使用方法中,下列操作不正确的是(填写编号)___________________。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线2cm~3cm处,用滴管滴加蒸馏水到标线
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近容量瓶刻度标线1cm~2cm处,用滴管滴加蒸馏水到刻度线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次
(3)怎样检查容量瓶是否漏水 。
五、(本题包括2小题,共19分)
20.(11分)中学化学中几种常见物质的转化关系如下:(提示:A与硫反应生成低价态)
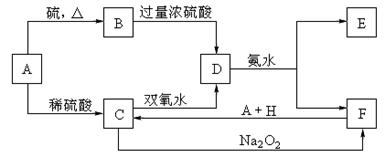
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体E粒子直径大小的范围: 。
(2)A、B、H的化学式:A ,B ,H 。
(3)①H2O2分子的电子式:
②写出C的酸性溶液与双氧水反应的离子方程式: 。
(4)写出鉴定E中阳离子的实验方法和现象:
。
21.(8分)有一无色透明溶液,欲确定是否含有下列离子:Na+、Mg2+、Al3+、Fe2+、Ba2+、NO![]() 、SO
、SO![]() 、Cl-、I-、HCO
、Cl-、I-、HCO![]() ,取该溶液实验如下:
,取该溶液实验如下:
| 实验步骤 | 实验现象 |
| ①取少量该溶液,加几滴甲基橙 | 溶液变红色 |
| ②取少量该溶液,浓缩,加Cu片和浓H2SO4,加热 | 有无色气体产生,后在空气中又变成红棕色 |
| ③取少量该溶液,加BaCl2溶液 | 有白色沉淀生成 |
| ④取③中上层清液,加AgNO3溶液 | 有白色沉淀生成,且不溶于HNO3 |
| ⑤取少量该溶液,加NaOH溶液 | 有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
(1)溶液中肯定存在的离子是________________________。
(2)溶液中肯定不存在的离子是________________________。
(3)为进一步确定其他离子,应该补充的实验是________ _ ________
。
六、(本题包括1小题,共8分)
22.(8分)阅读下面两条科普信息,回答问题:
ⅰ)一个体重50Kg的健康人含铁2g,这2g铁在人体中不是以单质金属的形式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于人体吸收。
ⅱ)在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,利用酶为催化剂把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿;该反应的另一种反应物是CO2,反应后CO2转变成有机物(用甲醛:CH2O表示)。
这两则科普信息分别介绍了人体内和海水中的亚铁离子与铁离子(或者铁的高价化合物)相互转化的事实、方法和途径。回答下列问题:
(1)服用维生素C,可以使食物中的Fe3+还原成Fe2+,这说明维生素C具有 性。
(2)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的离子方程式为: 。
(3)第ⅱ)条信息中的CO2做 剂,写出第ⅱ)条信息中的离子方程式 。
七、(本题包括1小题,共11分)
23.(11分)工业甲醇的质量分数可以用下列方法测定:
①在稀H2SO4中甲醇被Cr2O72—氧化成CO2和H2O,反应式为:
CH3OH+Cr2O72—+8H+=CO2↑+2Cr3++6H2O;
②过量的Cr2O72—可用Fe2+与之完全反应:
_____Cr2O72—+_____Fe2++_____H+ ——_____Cr3++______Fe3++______H2O
现有0.12 g工业甲醇,在H2SO4溶液中与25 mL 0.2 mol·L-1K2Cr2O7溶液反应,多余的K2Cr2O7再用1 mol·L—1FeSO4与其反应,结果用去FeSO4溶液9.6 mL。
⑴配平第②步中离子方程式。 ⑵计算工业甲醇的质量分数。
08届高三化学上册第一次月考试卷
参考答案
第Ⅱ卷(非选择题,共64分)
请同学们把1~16答案填入下表:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | D | C | C | C | C | A | D | B |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | CD | A | D | CD | AC | C | C | B |
17.略。(4分)
18.(1) 还原性、酸性;二氧化氯 (2) a + b =c+ d + 2e (3) 2 mol (4)略(每空2分)
19.(1)G、E、C、H、F或E、G、C、H、F (3分) (2)B、C、D(3分)
(3)将瓶塞打开,加入少量水,塞好瓶塞,倒转,不漏水,然后正放,把瓶塞旋转1800,再倒转不漏水,则说明该容量瓶瓶塞严密(4分)
20.(1)1nm~100nm(2分)
(2)Fe FeS
H2SO4(稀)(3分)
(3)①H![]() H(2分)
H(2分)
②2Fe2++H2O2+2H+=2Fe3++2H2O(2分)
(4)取少量E于试管中,用胶头滴管入NaOH溶液,加热试管,可观察到试管口处湿润的红色石蕊试纸变蓝。(或其他合理答案)(2分)
21.(8分)(1)Mg2+、Al3+、NO![]() 、SO
、SO![]() (2分)
(2分)
(2)Fe2+、Ba2+、I-、HCO![]() (2分)
(2分)
(3)焰色反应,取少量原溶液,加入Ba(NO3)2溶液后,取上层清液加入AgNO3溶液和稀HNO3(4分)
22.(8分)(方程式2分,其余每空2分)
(1)还原性
(2)Fe+2H+=Fe2++H2↑
(3)氧化;CO2+4Fe2++5H2O=CH2O+3Fe2O3+8H+
23.(11分)⑴1、6、14、2、6、7 (2分)
⑵由反应②可知,反应①剩余的n(Cr2O72—)=![]() n(Fe2+)=0.0016 mol (3分)
n(Fe2+)=0.0016 mol (3分)
反应①消耗的n(Cr2O72—)=0.0050 mol-0.0016 mol=0.0034 mol
则n(CH3OH)=0.0034 mol (3分)
w(CH3OH)=![]() ×100%=90.7% (3分)
×100%=90.7% (3分)