08级高三九月理科综合化学能力测试
化学试题
命题人:林一坤
供参考的相对原子质量:H-1 C-12 O-16 Na-23 Mg-24 S-32
6.科学研究发现,用10B合成的10B20有较好的抗癌作用,下列说法中正确的是
A.10B和10B20互为同位素
B.10B20和10B互为同素异形体
C.10B和10B20互为同分异构体
D.10B的中子数与核外电子数相等
7.氯磺酸(ClSO3H)是一元强酸,它能与甲酸发生反应:HCOOH+ClSO3H→CO+HCl+H2SO4,下列说法正确的是
A.反应后溶液的酸性增强 B.ClSO3H被还原
C.HCOOH是还原剂 D.ClSO3H是离子化合物
8.下列对化学反应的表示正确的是
A.含氢氧化钠20.0g的稀溶液与足量稀盐酸反应放出28.7kJ的热量,则该热化学方程式为:
NaOH(aq)+HCl(aq) ===NaCl(aq)+H2O(l);△H=-28.7kJ·mol-1
B.向碳酸氢钾溶液中滴入过量澄清石灰水
2HCO3-+Ca2++2OH-====CO32-+2H2O+CaCO3↓
C.次氯酸钠溶液中通入过量的二氧化硫
ClO-+SO2+H2O====HSO3-+HClO
D.将6molCl2通入含有5molFeI2的溶液中:
6Cl2+2Fe2++10I-= 12Cl-+5I2+2Fe3+
9.若aAm+与bBn-的核外电子排布相同,则下列关系不正确的是
A.b=a-n-m B.离子半径Am+<Bn-
C.原子半径A<B D.A的原子序数比B大(m+n)
10.在一定条件下还原性顺序为:Cl—<Br—<Fe2+<I—<SO2,由此判断下列反应必然能发生的是
①2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
②I2+SO2+2H2O =4I-+SO42-+4H+;
③2Fe2++I2=2Fe3++2 I-;
④2Br-+4H++ SO42-=SO2+Br2+2H2O
A.①② B.②③ C.③④ D.①④
11.反应(1)、(2)分别是从海藻灰和智利硝石中提取碘的主要反应:
2Na1+MnO2+3H2SO4
2NaHSO4+MnSO4+2H2O+I2…(1)
2Na1O3+5NaHSO3
2NaSO4+3NaHSO4+H2O+I2…(2)
下列说法正确的是( )
A.两个反应中NaHSO4均为氧化产物
B.I2在反应(1)是还原产物,在反应(2)中是氧化产物
C.氧化性:MnO2>SO42->IO3->I2
D.反应(1)、(2)中生成等量的I2时转移电子数比为1:5
12.CuS与一定浓度的HNO3反应,生成CuSO4、NO、NO2和H2O,当生成等物质的量的NO和NO2时,实际参加反应的CuS与HNO3的物质的量之比为
A.1:5 B.1:4 C.1:2 D.2:9
13.常温下某化合物的水溶液中,已知由水电离出来的以 c (H+)和 c(OH-)分别为:
a mol·L-1 和b mol · L-1 ,且 a·b =10-28 ,下列离子组在该溶液中一定能大量共存的是
A.Al3+、 NH4+、 SO42-、 Cl- B.N+、 K 十、SO42- 一、SO32
C.K 十、 Fe2+、 Cl-、 MnO4- D.Ba2+、 Na+、 Cl- 、 NO3-
26.(12分)
某一反应体系中存在以下五种物质:Na3AsO3、H2O、I2、Na3AsO4、HI。
(1)用这五种物质组成一个合理的未配平的方程式:
____________________________________________________。
(2)若水是产物,请配平该反应的方程式,并标出电子转移方向与数目:
_____________________________________________________。
(3)pH为5—9时,体系中的氧化反应为HI→I2;当pH < 4时,反应方向改变,此时体系中的氧化反应为:_______ → ________。
(4)该反应表明溶液的酸碱性影响物质的___________________(填物质的性质)。
(1)Na3AsO3+H2O+I2→Na3AsO4+HI或Na3AsO4+HI→Na3AsO3+H2O+I2(任写出一个即可)
(2)
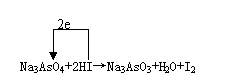

(3)Na3AsO3→Na3AsO4;
(4)氧化还原性
27.(16分)
由于氯气对饮用水消毒,会使水中的有机物发生氯代,生成有机含氯化合物,于人体有害,世界环保联盟即将全面禁止这种消毒方法,建议采用广谱性具有强氧化性的高效消毒剂二氧化氯(ClO2)。ClO2极易爆炸,生产和使用时尽量用惰性气体稀释。避免光照、震动或加热。
(1)欧洲一些国家用NaClO3氧化浓盐酸来制取ClO2,同时有Cl2生成,且Cl2 是ClO2的一半。表示这一反应的化学方程式是:
。
(2)我国广泛采用将干燥空气稀释的氯气,通入填有固体亚氯酸钠(NaClO2)的柱内制得ClO2。表示这一反应的化学方程式是:
,
与欧洲的方法相比,我国这一方法的优点是 。
(3)在酸性溶液中,用草酸钠(Na2C2O4)还原NaClO3也可制得ClO2。
表示这一反应的离子方程式是:
,
此法的优点是______________________________________________________。
(1)2NaClO3+4HCl=Cl2↑+2ClO2↑+2NaCl+2H2O
(2)2NaClO2+Cl2=2ClO2↑+2NaCl,生成的ClO2中不含杂质Cl2
(3)2ClO3-+C2O42-+4H+=2ClO2↑+2CO2↑+2H2O,析出的ClO2被CO2稀释
28.(16分)
(1)工业上可用浓氨水检查氯气管道是否漏气。若有Cl2漏出,与浓氨水接触会有白烟生成,同时产生一种无毒、无可燃性、不污染大气的气体。有关的化学方程式是:
,
该反应中氧化剂和还原剂的物质的量之比为______________。
(2)铁酸钠(Na2FeO4)是水处理过程中一种新型的净水型,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+。配平制取铁酸钠的化学方程式:
Fe(NO3)2+ NaOH+ Cl2—— Na2FeO4+ NaNO3+ NaCl+ H2O
反应中________被氧化,电子转移的总数为_________。
(1)3Cl2 +8NH3 = N2 +6NH4Cl;3:2
(2)1;8;2;1;2;4;4;铁元素;4e-
29.(16分)
(1)1840年盖斯提出了盖斯定律:“化学反应不管是一步完成还是分几步完成,这个过程的热效应是相同的。”火箭发射时可用肼(N2H4)为燃料,用二氧化氮作氧化剂,这两者反应生成氮气和水蒸气。
已知:
N2(g)+2O2(g)=2NO2(g);△H=-67.7kJ·mol-1 ①
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ·mol-1 ②
①请计算1 mol气体肼和NO2完全反应时放出的热量为 ,(4分)
②写出肼和NO2完全反应的热化学方程式:
(4分)
(2)折开1mol H-H键,1molN-H键,1molN≡N键,分别需要能量436 kJ,391 kJ,946 kJ,则1molN2生成NH3的反应热是 ,(4分)
1mol H2生成NH3的反应热是 。(4分)
(1)①567.85 kJ
②2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7kJ·mol-1
(2)-92kJ·mol- ,-92/3kJ·mol-