高三年级化学上学期第一次月考试卷
化学试卷
命题人 化学组
相对原子质量:C:12,Si:28,K:39;O:16;Na:23;Cl:35.5;P:31;Al:27;N:14
一、选择题:(每小题3分,共48分,每小题只有一个正确选项)
1.有一种橙色胶体溶液,在电泳实验中其胶粒向阴极移动。对这种胶体溶液进行下列处理,发生凝聚效果最好的是( )
A.加Na2SO4溶液 B.加酒精溶液
C.加硅酸胶体 D.加氢氧化铁溶胶。
2.下列各组物质的晶体中,化学键类型相同、晶体类型、物质发生状态变化所克服的粒子间的相互作用也相同的是( )
A.SO3和SiO2 B.CO2和H2O C.NaCl和HCl D.CCl4和KCl
3.在水泥、冶金工厂常用高压电对气溶胶作用,以除去大量烟尘,减小对空气污染,这种作用应用的原理是( )
A.丁达尔现象 B.电泳 C.渗析 D.凝聚
4.下列有关晶体的说法中,正确的是( )
A.分子晶体中一定存在共价键 B.离子晶体中不一定存在离子键
C.原子晶体的熔、沸点均较高 D.金属晶体的硬度均较大
5.关于胶体和溶液的区别,下列叙述中正确的是( )
A.溶液呈电中性,胶体带有电荷
B.溶液中溶质微粒一定不带电,胶体中分散质微粒带电荷
C.溶液中溶质微粒作有规律的运动,胶体粒子运动无规律
D.溶液中通过一束光,无特殊现象,而胶体中有“光亮的通路”
6.下列物质中,化学式能准确表示该物质分子组成的是( )
A.氯化铵(NH4Cl) B.二氧化硅(SiO2) C.白磷(P4) D.硫酸镁(MgSO4)
7. 关于氢键,下列说法正确的是( )
A.分子间形成的氢键使物质的熔点和沸点升高
B.冰中存在氢键,水中不存在氢键
C.每一个水分子内含有两个氢键
D.H2O是一种非常稳定的化合物,这是由于氢键所致
8.三氯化氮(NCl3)在常温下是一种淡黄色液体,其分子呈三角锥形,以下关于NCl3的叙述正确的是( )
A.NCl3晶体为原子晶体 B.分子中N—Cl键是非极性共价键
C.NCl3是一种含极性键的极性分子 D.N—Cl键能大,故NCl3沸点高。
9.下列物质性质的变化规律与分子间作用力有关的是( )
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.金刚石的硬度大于硅,其熔、沸点也高于硅
C.NaF、NaCl、NaBr、NaI的熔点依次降低
D.F2、Cl2、Br2、I2的熔、沸点逐渐升高
10.最近,科学家在实验室成功地在高压下将CO2 转化为类似SiO2 的原子晶体结构,下列关于CO2 晶体的叙述中不正确的是( )
A.晶体中C、O原子个数比为1:2;
B.该晶体的熔点、沸点高,硬度大;
C.晶体中C一O一C键角为180°;
D.晶体中C、O原子,最外层都满足8电子结构。
11、由钾和氧组成的某种离子晶体中含钾的质量分数为78/126,其阴离子只有过氧离子(O22-)和超氧离子(O2-)两种。在此晶体中,过氧离子和超氧离子的物质的量之比为( )
A.2:1 B.1:1 C.1:2 D.1:3。
12.下列说法正确的是(NA为阿伏加德罗常数) ( )
A.124 g P4含有P—P键的个数为4NA
B.12 g石墨中含有C—C键的个数为3NA
C.12 g金刚石中含有C—C键的个数为2NA
D.60gSi02中含Si—O键的个数为2NA
13.测定硫酸铜晶体中含结晶水的实验,造成结果偏高的原因是( )
A.坩埚用水洗涤后没有把水烘干直接实验;
B.坩埚内壁附有受热不分解的杂质;
C.把加热得到的白色粉末放在空气中冷却;
D.晶体中含有少量的NaCl。
14.某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KClO3的混合液,经测定ClO-和ClO3-个数比为1:2,则Cl2与KOH溶液反应时,被还原的氯与被氧化的氯的物质的量之比为( )
A.21:5 B.4:1 C.3:l D.11:3
15.下列各组离子能大量共存,当溶液中c(H+)=10-1 mol·L-1时,有气体产生;而当溶液中c(H+)=l0-13 mol·L-1时,又能生成沉淀。该组离子可能是( )
A.Na+、Cu2+、NO![]() 、CO
、CO![]() B.Ba2+、K+、Cl-、CO
B.Ba2+、K+、Cl-、CO![]()
C.Fe2+、Na+、SO![]() 、NO
、NO![]() D.Mg2+、NH
D.Mg2+、NH![]() 、SO
、SO![]() 、Cl-
、Cl-
16.下列离子方程式书写正确的是( )
A.碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液
Ca2+ + 2HCO3- + 2OH- = CaCO3↓ + 2H2O + CO32-
B.氯化铝溶液中加入过量氨水 Al3+ + 3NH3·H2O = Al(OH)3↓ + 3NH4+
C.氯化亚铁溶液中通入氯气 Fe2+ + Cl2 = Fe3+ + 2Cl-
D.浓盐酸跟二氧化锰混合共热 ![]()
二、填空题(本题包括3小题,共28分)
17.(18分)将铝粉逐渐投入饱和氯化铁的黄色溶液中,首先看到溶液变成红褐色,并产生气泡;后来有少量的红褐色的沉淀,并有少量的能被磁铁吸引的黑色沉淀物质生成,请回答下列问题:
(1)开始时形成的红褐色分散系是_________,红褐色的沉淀是________,气泡的成分是_____________________,黑色物质是_____________________。
(2)除去红褐色溶液中少量沉淀的实验方法是____________________。
(3)写出涉及的离子反应方程式:______________________________,
____________________,______________________,______________________。
18.(6分)一种澄清透明的溶液中,可能含有下列离子:K+、Fe3+、Ba2+、Al3+、NH4+、Cl-、NO3—、HCO3—、SO42—现做以下实验:
(1)将溶液滴在蓝色石蕊试纸上,试纸呈红色;
(2)取少量溶液,加入用稀HNO3酸化的BaCl2溶液,产生白色沉淀;
(3)将(2)中的沉淀过滤,向滤液中加入AgNO3溶液,产生白色沉淀;
(4)另取溶液,逐滴加入NaOH溶液至过量微热,只看到有红褐色沉淀生成,且沉淀质量不减少。
由此可以推断:
溶液中肯定存在的离子有____________;
溶液中肯定不存在的离子有_______________;
溶液中不能确定是否存在的离子有_______________。
19.
(4分) 设NaCl摩尔质量为M g/mol,晶体密度为![]() g/cm3,阿伏加德罗常数为NA,则食盐晶体中两个距离最近的氯离子间的距离为____________cm。
g/cm3,阿伏加德罗常数为NA,则食盐晶体中两个距离最近的氯离子间的距离为____________cm。
三、实验题(本题包括1小题,共10分)
20. (10分)根据硫酸铜晶体结晶水含量的测定实验;填写下列空白
此实验操作顺序如下:①称量坩埚、晶体;②加热、冷却;③称量;④再加热、冷却;⑤称量;⑥计算;⑦分析实验误差。
(1)用托盘天平称量的时候,若指针偏向左边,则表示(填写正确选项代码) 。
A.左盘重,样品轻
B.左盘轻,砝码重
C.右盘重,砝砝轻
D.右盘轻,样品重
(2)在进行加热时,应该用 来夹持坩埚;为了防止硫酸铜晶体失去结晶水时不完全,或发生CuSO4强热分解,造成实验产生误差,所以在加热操作中要① ______ , ② ____ 。
(3)加热后的坩埚应放在 中冷却。如果放在空气中自然冷却,则会使实验结果的误差偏 。
(4)在进行④、⑤两步实验时,有时还要重复进行,这是由于 。
(5)在硫酸铜晶体结晶水含量的测定实验中,若坩埚的质量为m,坩埚与硫酸铜晶体的质量为m1,加热后称量坩埚与无水硫酸铜的质量为m2,则晶体中结晶水的质量分数ω=____________________(写计算式)。如果实验中加热温度过高,固体颜色变黑,则测定结果会____________(填“不变”、“偏高”、“偏低”)。
四、综合计算题(本题包括1小题,共14分)
21.
(14分)含氮废水进入水体而对环境造成的污染越来越严重。某校环保小组的同学认为可以用金属铝将水中的![]() 还原为N2,从而消除污染。
还原为N2,从而消除污染。
(1)配平以下有关的离子反应方程式:
□![]() +□Al+□H2O
+□Al+□H2O![]() □N2↑+□Al(OH)3+□OH-
□N2↑+□Al(OH)3+□OH-
(2)以上反应中,失电子的物质是_____________,氧化剂的还原产物是_____________,每生成1 mol这种还原产物,将有_____________摩尔电子发生转移。
(3)现需除去1 m3含氮0.3 mol的废水中的![]() (设氮元素都以
(设氮元素都以![]() 的形式存在),则至少需要消耗金属铝_____________克。
的形式存在),则至少需要消耗金属铝_____________克。
(4)你对以上治理污染的方案有何评价?
![]() 高三年级第一次月考
高三年级第一次月考
 化学试卷答题卷
化学试卷答题卷
一、选择题:(每小题3分,共48分,每小题只有一个正确选项)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
二、填空题(本题包括3小题,共28分)
17、(18分)
(1)____________,___________,____________,_____________。
(2)_________________________________________。
(3)_______________________________,_______________________________, _______________________________,_______________________________。
18、(6分) 、 、 ________________。
19、(4分)__________________________
三、实验题(本题包括1小题,共10分)
20、(10分)
(1) 。
(2) ;① ______ , ② ____ 。
(3) 。偏 。
(4)____________________________________________ 。
(5)ω=____________________(写计算式)。____________(填“不变”、“偏高”、“偏低”)。
四、综合计算题(本题包括1小题,共14分)
21、(14分)
(1)配平以下有关的离子反应方程式:
□![]() +□Al+□H2O
+□Al+□H2O![]() □N2↑+□Al(OH)3+□OH-
□N2↑+□Al(OH)3+□OH-
(2)以上反应中,失电子的物质是_____________,氧化剂的还原产物是_____________,每生成1 mol这种还原产物,将有_____________摩尔电子发生转移。
(3)现需除去1 m3含氮0.3 mol的废水中的![]() (设氮元素都以
(设氮元素都以![]() 的形式存在),则至少需要消耗金属铝_____________克。
的形式存在),则至少需要消耗金属铝_____________克。
(4)你对以上治理污染的方案有何评价?
高三年级第一次月考化学试卷参考答案
一、选择题:(每小题3分,共48分,每小题只有一个正确选项)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | C | B | B | C | D | C | A | C |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | D | C | C | C | A | D | C | B |
二、填空题(本题包括3小题,共28分)
17. (18分每空2分) (1)Fe(OH)3胶体;Fe(OH)3沉淀;H2;Fe。
(2)可以用过滤的方法把胶体溶液中的沉淀物质分离出来
(3)Fe3++3H2O = Fe(OH)3(胶体)+3H+;2Al+6H+=2Al3++3H2↑;Al+3Fe3+=Al3++3Fe2+;
2Al(过量)+3Fe2+=2Al3++3Fe(黑色)
18. (6分每空2分)SO42—、Fe3+; Ba2+、Al3+、HCO3—、NH4+; K+、Cl—、NO3—。
19. (4分)![]()
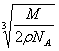
三、实验题(本题包括1小题,共10分)
20. (10分除计算式2分外每空1分)(1) D;(2)坩埚钳;①不断用玻璃棒搅拌;②用小火加热,防止温度过高;(3)干燥器 偏小;(4)保证结晶水完全失去,提高实验的准确度。(5)![]() ×100% 偏高
×100% 偏高
四、综合计算题(本题包括1小题,共14分)
21. (14分除最后一题4分外每空2分)
(1) ![]() +10Al+18H2O====3N2↑+10Al(OH)3+6 OH-
+10Al+18H2O====3N2↑+10Al(OH)3+6 OH-
(2)Al N2 10
(3)13.5
(4)该方案的治理成本较高;铝会造成水体新的污染等等。(合理答案酌情给分)