高三年级化学第一学期第三次月考试卷
高三年级化学试卷
时间:100分钟 分值:100分 命题人:朱启文
可能用到的原子量: H-1 C-12 N-14 O-16 Na-23 Mg-24 S-32 Cl-35.5 I-127
Ba-137 Cu-64 K-39 Al -27 Ca -40 Fe-56 Mn-55 Zn-65 Be-9 Si-28
第Ⅰ卷(选择题 共54分)
一 选择题(本题包括18小题,每题3分,共54分。每小题只有一个选项符合题意)
1.下列有关叙述正确的是:( )
A、铜可导电,所以铜是电解质 B、MgCl2在熔融状态下可导电,它是电解质
C、HCl、H2SO4液态时都不导电,都是非电解质 D、能导电的单质一定是金属
2.下列关于胶体说法正确的是( )
A、胶体都是液体
B、胶体是指直径在1nm--100nm之间的微粒
C、胶体具有和其它分散系不同的性质,原因在于其分散质微粒大小与其它分散系不同
D、向溶胶中加入任何一种溶液,都可使溶胶发生聚沉。
3.实验室保存下列药品的方法,正确的是( )
A.氢氟酸贮存在特制的塑料瓶里 B.盛放浓硫酸的广口瓶应当用磨口玻璃塞,不能用橡皮塞
C.白磷可以利用不溶于CS2,而保存在CS2里 D.在同一层药品橱里存放浓氨水和浓盐酸
4.下列说法正确的是( )
(A)硅材料广泛应用于光纤通讯 (B)工艺师利用盐酸刻蚀石英制作艺术品
(C)水晶项链和餐桌上的瓷盘都是硅酸盐制品 (D)粗硅制备单晶硅不涉及氧化还原反应
5.对下列各种溶液中所含离子的判断合理的是( )
A.向无色溶液中加氯水变橙色,溶液中可能含:SO42—,Br—,OH—,Ba2+
B.在c(H+)=10—14mol/L的溶液中可能含:Na+,AlO2—,CO32—,SO32—
C.在常温下加入铝粉有氢气放出,则溶液中可能含:K+,Na+,H+,NO3—
D.使紫色石蕊试液变红色的溶液中可能含:K+,Na+,Ca2+,HCO3—
6.根据以下实验事实,判断四种微粒在酸性条件下,氧化性由强到弱的顺序是:( )
①向FeC13溶液中滴加KI溶液,再加入CC14振荡,CCl4层呈紫红色
②向FeC12溶液中加入氯水,再加入KSCN溶液,呈红色
③向KMnO4溶液中加入浓盐酸,振荡后紫色褪去
A.I2>C12>Fe3+>MnO4- B.MnO4->C12>Fe3+>I2
C.Cl2>I2>Fe3+>MnO4- D.Fe3+>MnO4->Cl2>I2
7.已知铅蓄电池放电时发生如下反应:负极:Pb+SO42—=PbSO4+2e—, 正极:PbO2+4H++SO42—+2e—=PbSO4+2H2O。实验室用铅蓄电池作电源,用惰性电极电解CuSO4溶液,当阴极析出2.4g铜时,铅蓄电池内消耗H2SO4物质的量至少是
A.0.050mol B.0.075mol C.0.20mol D.0.40mol
8.铝、铍(Be)及其化合物具有相似的化学性质,如其氯化物分子内键型相同, 故其氯化物晶体的熔点都较低。已知反应:BeCl2 + Na2BeO2 + 2H2O == 2NaCl + 2Be(OH)2↓能完全进行,则下列推断正确的是 ( )
A.Na2BeO2溶液的 pH > 7,将其蒸干并灼烧后得到的残留物为BeO
B.BeCl2溶液的pH < 7,将其蒸干并灼烧后得到的残留物可能是BeO
C.Be(OH)2能溶于盐酸,不能溶于NaOH溶液
D.BeCl2水溶液的导电性强,故BeCl2是离子化合物
9.短周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z位于同一主族,W与X可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5倍。下列叙述中不正确的是( )
(A)WZ2分子中所有原子最外层都为8电子结构 (B)WX2、ZX2的化学键类型和晶体类型都相同
(C)WX2是以极性键结合成的非极性分子 (D)原子半径大小顺序为X<W<Y<Z
10.如图,B为常见金属或非金属单质,有下列转化关系:
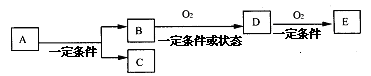
若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是 ( )
A.AlCl3 B.H2O2 C.KCl D.NaCl
11.由Na2O2、Na2CO3、NaHCO3、NaCl中某几种组成的混合物,向其中加入足量的盐酸有气体放出。将气体通过足量的NaOH溶液,气体体积减少。将上述混合物在空气中加热,有气体放出。下列判断正确的是 ( )
A.混合物中一定不含Na2CO3、NaCl B.混合物中一定有Na2O2、NaHCO3
C.无法确定混合物中是否含有NaHCO3 D.混合物中一定不含Na2O2、NaCl
12.已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4 = 2CuI↓+13I2+12K2SO4+12H2O
其中1 mol氧化剂在反应中得到的电子为( )
(A)10 mol (B)11 mol (C)12 mol (D)13 mol
13.已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量
②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量
③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量
下列叙述正确的是( )
(A)氢气和氯气反应生成氯化氢气体的热化学方程式H2(g)+Cl2(g) = 2HCl(g)
(B)氢气和氯气反应生成2 mol氯化氢气体,反应的DH = 183 kJ/mol
(C)氢气和氯气反应生成2 mol氯化氢气体,反应的DH =-183 kJ/mol
(D)氢气和氯气反应生成1 mol氯化氢气体,反应的DH =-183 kJ/mol
14.目前,关于二氧化碳是否为大气污染有不同的观点。认为“二氧化碳不是大气污染物”的理由是( )
错误!未找到引用源。二氧化碳是重要的化工原料;错误!未找到引用源。二氧化碳是植物光合作用的必需原料;错误!未找到引用源。二氧化碳是无色、无味、无毒的气体;错误!未找到引用源。除二氧化碳外,甲烷、一氧化二氮也是温室气体
(A)错误!未找到引用源。错误!未找到引用源。 (B)错误!未找到引用源。错误!未找到引用源。 (C)错误!未找到引用源。错误!未找到引用源。 (D)错误!未找到引用源。错误!未找到引用源。
15.三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:
C3N3(OH)3![]() 3HNCO; 8HNCO+6NO2
3HNCO; 8HNCO+6NO2![]() 7N2+8CO2+4H2O
7N2+8CO2+4H2O
下列说法正确的是( )
(A)C3N3(OH)3与HNCO为同一物质 (B)HNCO是一种很强的氧化剂
(C)1 mol NO2在反应中转移的电子为4 mol (D)反应中NO2是还原剂
16有Xn+、Ym+、Zn-,已知它们各自带有的电荷数值m>n,且X、Y、Z三种原子的M电子层中的电子数均为奇数。若按X→Y→Z的顺序,下列说法中正确的是( )
A、它们的最高价氧化物的相应水化物的碱性依次减弱,酸性依次增强
B、它们的原子半径依次增大;
C、它们的单质在常温、常压下的密度依次减小
D、它们的最高价氧化物的水化物都是强电解质
17.下列关于盐酸与醋酸两种稀溶液的说法正确的是( )
(A)相同浓度的两溶液中c(H+)相同
(B)100 mL 0.1 mol/L的两溶液能中和等物质的量的氢氧化钠
(C)pH=3的两溶液稀释100倍,pH都为5
(D)两溶液中分别加入少量对应的钠盐,c(H+)均明显减小
18.下列除去杂质的方法正确的是( )
错误!未找到引用源。除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离;
错误!未找到引用源。除去乙酸乙酯中少量的乙酸:用饱和碳酸氢钠溶液洗涤,分液、干燥、蒸馏;
错误!未找到引用源。除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶;
错误!未找到引用源。除去乙醇中少量的乙酸:加足量生石灰,蒸馏。
(A)错误!未找到引用源。错误!未找到引用源。 (B)错误!未找到引用源。错误!未找到引用源。 (C)错误!未找到引用源。错误!未找到引用源。 (D)错误!未找到引用源。错误!未找到引用源。
第II卷(非选择题 共46分)
19.(8分)实验室要配置100mL1mol./L的KOH溶液,试回答
(1)用不到的仪器是
A 烧杯 B 250mL容量瓶 C天平 D胶头滴管 E玻璃棒 F 100mL容量瓶 G漏斗
(2) 配置时要称取KOH的质量为
(3)从下面选出正确的操作并写出正确的顺序 (填序号)。
A洗涤 B干燥 C量取 D称量 E 定容 F转移溶液 G稀释 H溶解 I冷却 J摇匀
(4)实验中出现下列情况要如何处理?
A 加蒸馏水时不小心加过了刻度线 ;B 加蒸馏水到离刻度线1~2cm处应 。
20. (10分)A、B、C、D、E均为可溶于水的固体,组成它们的离子有
| 阳离子 | Na+ | Mg2+ | Al3+ | Ba2+ | |
| 阴离子 | OH- | Cl- | CO32 - | SO42 - | HSO4- |
分别取它们的水溶液进行实验,结果如下:
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减小,但不消失。
据此推断它们是A__________;B___________;C__________;D___________;E___________。
21.(14分)U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)V的单质分子的结构式为____;XW的电子式为____;Z元素在周期表中的位置是___。
(2)U元素形成的同素异形体的晶体类型可能是(填序号)________________。
①原子晶体 ②离子晶体 ③分子晶体 ④金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)_____;V、W的氢化物分子结合H+能力较强的是(写化学式)____,用一个离子方程式加以证明________。
(4)YW2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为__________________。
由此可知VW和YW2还原性较强的是(写化学式)____________。
22.(12分)短周期元素形成的纯净物A、B、C、D、E是转化关系如下图所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同)。
|
|
|
|
|
请回答下列问题:
(1)若C是离子化合物,D是一种强碱,写出C的一种化学式 。
(2)若E的水溶液呈现弱酸性,D是既能溶于强酸、又有溶于强碱的化合物。
①用电离方程式解释D既能溶于强酸,又能溶于强碱的原因。
。
②用等式表示E与NaOH溶液反应后生成正盐的溶液中所有离子浓度之间的关系
。
(3)若C是一种气体,D是一种强酸,则:
①C与水反应的化学方程式为 。
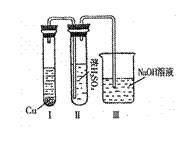 ②有人认为“浓H2SO4可以干燥气体C”。某同学
②有人认为“浓H2SO4可以干燥气体C”。某同学
为了验证该观点是否正确,用右图装置进行实验。
实验过程中,浓H2SO4中未发现有气体逸出,且变
为红棕色,则你得出的结论是 。
③已知常温下物质A与物质B生成1mol气体C的△H
为—57.07kJ ·mol-1, 1 mol气体C与H2O反应生成
D溶液和E气体的△H为—46kJ ·mol-1,写出物质A
与物质B及水生成D溶液的热化学方程式 。
答案卷
第Ⅰ卷(选择题 共54分)
1.B 2.C 3.A 4.A 5.B 6.B 7.B 8.B 9.D 10.D 11.B 12.B 13.C 14.B 15.C 16.A 17.B 18.B
第II卷(非选择题 共46分)
19.(8分) (1)BG(2分) (2) 5.6g(2分)(3) D、H、I、F、(J、)A、E、J(2分)
(4) 重新配置(1分) 改用胶头滴管滴加至刻度线(1分)
20.(10分)A:Na2CO3;B:Al2(SO4)3;C:MgCl2;D:Ba(OH)2;E:NaHSO4[或Mg(HSO4)2]。
21.(14分)(1)N≡N;![]() ;第四周期,第错误!未找到引用源。族。 (2)①③。
(3)CH4;NH3;NH3+H3O+= NH4+ +H2O。
;第四周期,第错误!未找到引用源。族。 (2)①③。
(3)CH4;NH3;NH3+H3O+= NH4+ +H2O。
(4)3SO2+3Ba2++2H2O+2NO3- = 3BaSO4↓+2NO↑+4H+。 SO2。
22.(12分)(1)Na2O2(NaH)(2分)
![]()
![]() (2)①H++A1O2-+H2O A1(OH)3 A13++3OH- (2分)
(2)①H++A1O2-+H2O A1(OH)3 A13++3OH- (2分)
②c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)(2分)
(3)①3NO2+H2O=2HNO3+NO(2分)
②NO2能溶于浓H2SO4,因而不能用浓H2SO4干燥NO2(2分)
③4NO(g)+3O2(g)+2H2O(1)=4HNO3(aq);△H=-618.42kJ·mol-1