高考化学复读学校第三次质量检测试题
化学试题 命题人:袁健 2007-10-26
可能用到的原子量:H-1 C-12 N-14 O-16 Na-23 Fe-56 S-32 Cu-64
Ag-108 Zn-65
一、选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意)
1.正确掌握好化学用语是学好化学的基础,下列有关表述正确的是
A.H、D、T互为同素异形体
B.氨气分子构型为正四面体形
C.NH4Cl的电子式为: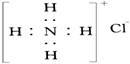
D.S2-的结构示意图为:
2. 下列反应中生成物总能量高于反应物总能量的是
A.碳酸钙分解 B.乙醇燃烧 C.铝粉与氧化铁粉末反应 D.氧化钙溶于水.
3.关于某无色溶液中所含离子的鉴别,下列判断正确的是 ( )
A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在
B.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定SO42-存在
C.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
D.加盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO32-
4.下列有关试验的说法正确的是( )
A.除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤。
B.为测定熔融氢氧化钠的导电性,可在瓷坩埚中融化氢氧化钠固体后测量。
C.制备氢氧化铁胶体,通常是将氢氧化铁固体溶于热水中。
D.氯化铵和消石灰用加热的办法分离。
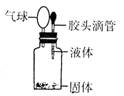 5.某同学用右图所示装置进行实验,出现小气球鼓起来的现象,
5.某同学用右图所示装置进行实验,出现小气球鼓起来的现象,
则使用的固体和液体试剂可能是( )
A、铜与浓硫酸 B、铁与浓硫酸
C、铝和氢氧化钠溶液 D、二氧化锰和浓盐酸
6.X、Y、Z、W为四种短周期主族元素。其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法正确的是
A.X与W可以形成W2X、W2X2两种化合物
B.Y元素最高价氧化物对应水化物的化学式为H2YO4
C.原子序数由小到大的顺序为W<X<Y<Z
D.Y、Z两元素的简单离子的半径Y>Z
7、 向存在大量Na+ ,Cl-的溶液中通入过量的氨气后,该溶液中还可能大量共存的是 A、K+. Br-.CO32- B、NH4+. Fe3+.SO42-
C、Al3+. H+.MnO4- D、Ag+. Cu2+.NO3-
8.实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是
A.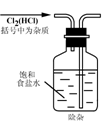 B.
B.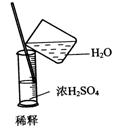
C.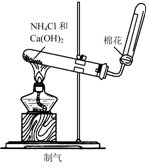 D.
D.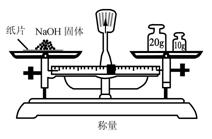
9.用已准确称量过的氯化钠固体配成1.00mol·L-1的NaCl溶液0.5L,下列仪器:①坩埚 ②分液漏斗 ③容量瓶 ④烧瓶 ⑤胶头滴管 ⑥烧杯 ⑦玻璃棒 ⑧托盘天平,其中要 用到的是
A.③④⑤⑦ B.①②⑤⑥⑧ C.③⑤⑥⑦ D.①③⑤⑥⑦
10.用NA表示阿伏加德罗常数,下列说法不正确的是( )
A.标准状态下的辛烷22.4L完全燃烧产生CO2分子数为8NA
B.18g水中所含电子数为10NA
C.46gNO2和46gN2O4中所含原子数均为3NA
D.1L 2mol·L-1的Mg(NO3)2溶液中含NO![]() 离子数为4NA
离子数为4NA
11. 下列叙述正确的是
A.同一主族的元素,原子半径越大,其单质的熔点一定越高。
B.同一周期的原子,半径越小越容易失去电子
C.同一主族元素的氢化物,相对分子质量越大,它的沸点一定越高。
D.稀有气体元素的原子序数越大,其单质的沸点一定越高。
12. 下列离子方程式书写正确的是( )
A.用小苏打治疗胃酸过多
HCO3- + H+ = CO2↑+ H2O
B.氯化铝溶液中加入过量氨水 Al3+ + 3NH3·H2O = AlO2-+ 3NH4+
C.氯化亚铁溶液中通入氯气 Fe2+ + Cl2 = Fe3+ + 2Cl-
D.实验室用浓盐酸与二氧化锰制氯气 ![]()
13. 某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KClO3的混合液,经测定ClO-和ClO3-个数比为1:2,则Cl2与KOH溶液反应时,被还原的氯与被氧化的氯的物质的量之比为( )
A.21:5 B.4:1 C.3:l D.11:3
14.下列各组物质的晶体中,化学键类型相同、晶体类型、物质发生状态变化所克服的粒子间的相互作用也相同的是( )
A.SO3和SiO2 B.CO2和H2O C.NaCl和HCl D.CCl4和KCl
15.测定硫酸铜晶体中含结晶水的实验,造成结果偏高的原因是( )
A.坩埚用水洗涤后没有把水烘干直接实验;
B.坩埚内壁附有受热不分解的杂质;
C.把加热得到的白色粉末放在空气中冷却;
D.晶体中含有少量的NaCl。
16.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关。下列各组物质:
①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液由于浓度不同而能发生不同氧化还原反应的是
A ①③ B ③④ C ①② D ①③④
高考复读学校第三次质量检测
答题卷
班级 姓名 得分
一、选择题(共16小题,每题3分,共48分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
二、非选择题(共8小题,共62分)
17.(9分)下表为元素周期表的一部分,请回答有关问题:
|
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 |
|
|
|
| ① |
| ② |
|
| 3 |
| ③ | ④ | ⑤ |
| ⑥ | ⑦ | ⑧ |
| 4 | ⑨ |
|
|
|
|
| ⑩ |
|
(1)⑤和⑧的元素符号是 和 ;
(2)表中最活泼的金属是 ,非金属最强的元素是 ;(填写元素符号)
(3)表中能形成两性氢氧化物的元素是 ,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的离子方程式:
. ;
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:
。
18.(12分)A~J是中学化学中常见的几种物质,它们之间的转化关系如下图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F化合生成,J可作禽流感、SARS等病毒的杀菌消毒剂。
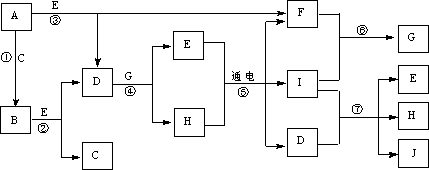
(1)分别写出B、D的电子式:___________________、______________________。
(2)写出反应⑦的离子方程式:_________________________________。
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式:
_____________________
19(6分)通常状况下,微粒A和B为分子,C和E为阳离子,D为阴离子,他们都含有10个电子;B溶于A后所得的物质可电离出C和D;A.B.E三种微粒反应后可得C和一种白色沉淀。请回答:
(1) 用化学符号表示下列4种微粒;A .B .C D.
(2) 写出A、B、E三种微粒反应的离子方程式:
20(6分)今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,确定一定存在的离子是 ;可能存在的离子是 ;
一定不存在的离子是 。
21.(9分)工业上以硫铁矿为原料制硫酸所产生的尾气含氮气、氧气外,还含有二氧化硫、微量的三氧化硫和酸雾。为保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气的二氧化硫转化为有用的副产品。请回答:
(1)将尾气通入氨水中,能发生多个反应,写出其可能发生的两个氧化还原反应的化学方程 :
、
(2)在尾中与氨水反应所得到的高浓度溶液中,按一定比例加入氨水或碳酸氢铵,此时溶液的温度会自行降低,并析出晶体。
①导致溶液温度降低的原因可能是
②析出的晶体可用于造纸工业,也可用于照相用显影业的生产。已知该晶体水合物的相对分子为134,则其化学式为 .
(3)能用于测定硫酸尾气中二氧化硫含量的是 (添字母)
A.NaOH溶液、酚酞溶液B.KmnO4溶液,稀硫酸 C.碘水、淀粉溶液 D.氨水、酚酞溶液。
22.(6分)(1)1mol丙酮酸(CH3CCOOH)在镍催化下加氢气转化为乳酸,乳酸的结构简式为
(2)与乳酸具有相同官能团的乳酸的同分异构体A在酸性条件下加热失水生成B,由A生成B的化学方程式为
(3)B的甲酯可以聚合,聚合物的结构简式为
23(8分).黄铁矿主要成分是FeS2。。某硫酸厂在进行黄铁矿成分测定时,取0.1000g样品在空气中充分灼烧,将生成的二氧化硫气体与足量硫酸铁溶液完全反应后,用浓度为0.0200mol/LK2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL。已知:
SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
(1)样品中FeS2的质量分数为 (假设杂质不参与反应)
(2)若灼烧6g FeS2产生的二氧化硫全部转化为三氧化硫气体时放出9.38KJ热量,产生的三氧化硫全部转化为硫酸放出13.03KJ热量,写出三氧化硫气体转化为硫酸
的热化学方程式
(3)煅烧10t上述黄铁矿,理论产生二氧化硫的体积(标准状况)为
(4)制得98%的硫酸质量为
24(6分)将32.64g铜与140ml一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为 L,NO2的体积为 L。
(2)待产生的气体全部释放后,向溶液加入![]() a mol·L-1的NaOH溶液,恰好使溶液中的
a mol·L-1的NaOH溶液,恰好使溶液中的![]() 全部转化成沉淀,则原硝酸溶液的浓度为
全部转化成沉淀,则原硝酸溶液的浓度为
答案
1D2A3C4A5C6A7A8C9C10A11D12A13D14B15A16A
17.(1)Si Ar (2)K F Ar Al(OH)3+3H+=Al3++3H2O
Al(OH)3+OH-=AIO2+2H2O
在溴化钠溶液中加入溴水,溶液变橙色。
23.90.00% .3.36X106L 15t
24.(1)5.82L 5.38L (av+500)/140 mol/L