08届高三化学10月份月考试题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分108分.考试时间:60分钟.可能用到的原子量: H:1 He:4 C:12 O:16 S:32 N:14 Cl:35.5 K:39 Na:23
Ca:40 Al:27
第Ⅰ卷(选择题,共48分)
一、选择题(每小题只有一个选项符合题意,每小题6分,共8题)
1.下列叙述错误的是
A.13C和14C属于同一种元素,它们互为同位素
B.1H和2H是不同的核素,它们的质子数相等
C.14C和14N的质量数相等,它们的中子数不等
D.6Li和7Li的电子数相等,中子数也相等
2.若NA表示阿佛加德罗常数,下列说法正确的是
A.1 mol Cl2作为氧化剂得到的电子数为NA
B.在0℃,101kPa时,22.4L氢气中含有NA个氢原子
C.14g氮气中含有7NA个电子
D.NA个一氧化碳分子和0.5 mol 甲烷的质量比为7 :4
3.25℃时,在pH=13的溶液中可以大量共存的离子组是
A.K+、Na+、HCO3—、NO3— B.Na+、K+、SO42—、Cl—
C.H+、Mg2+、SO42—、NO3— D.Ag+、K+、NO3—、Na+
4.下列反应的离子方程式正确的是
A.锌片插入硝酸银溶液中: Zn+Ag+=Zn2++Ag
B.碳酸氢钙溶液加到醋酸中:Ca(HCO3)2+2CH3COOH=Ca2++2CH3COO-+2CO2↑+2H2O
C.少量金属钠加到冷水中: Na+2H2O=Na++OH-+H2↑
D.氢氧化铜加到盐酸中: Cu(OH)2+2H+=Cu2++2H2O
5.下列叙述正确的是
A.同一主族的元素,原子半径越大,其单质的熔点一定越高
B.同一周期的元素,半径越小越容易失去电子
C.同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高
D.稀有气体元素的原子序数越大,其单质的沸点一定越高
6.已知充分燃烧ag乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量 bkJ,则乙炔燃烧的热化学方程式正确的是
A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=-4b kJ/mol
B.C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l);△H=2b kJ/mol
O2(g)=2CO2(g)+H2O(l);△H=2b kJ/mol
C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=-2b kJ/mol
D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=b kJ/mol
7.在一定条件下,下列粒子的还原性顺序为:Cl–<Br–<Fe2+<I–<SO2,由此判断以下各反应在溶液中不能发生的是
A.2Fe2+ + Cl2 === 2Fe3+ + 2Cl–
B.I2 + SO2 + 2H2O === 4H+ + SO42– + 2I–
C.2Br– + 4H+ + SO42–=== SO2 + Br2 + 2H2O
D.2Fe3+ + SO2 + 2H2O === 2Fe2+ + SO42– + 4H+
8.关于某无色溶液中所含离子的鉴别,下列判断正确的是
A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在
B.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-存在
C.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
D.加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO32-
第I卷答题表 班考号 姓名
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
第Ⅱ卷(非选择题共60分)
9.①(10分)已知A、B、C、D和E 5种分子所含原子数目依次为1、2、3、4和6,且都含有18个电子。又知B、C和D是由两种元素的原子组成。请回答:
(1)组成A分子原子的原子结构示意图 ;
(2)B和C的分子式分别是 和 ;
(3)若向D的稀溶液中加入少量二氧化锰,有无色气体生成。则D的分子式是 ,该反应的化学方程式为 ;
②(16分) A、B、C、D、E为短周期元素,原子序数依次增大。其中A与E同主族,B的最外层电子数是次外层电子数的2倍,C的最高价氧化物对应的水化物与其氢化物反应生成一种盐X。A、B、D、E可组成化合物A2D2、B2A2、E2D2,它们都含有非极性共价键。
(1)C元素在周期表中的位置是 ,写出B的最高价氧化物的电子式 。
(2)X的水溶液显 (填“酸”、“碱”或“中”)性,理由是(用离子方程式表示) ,溶液中各种离子浓度由大到小的顺序为 。
(3)A、B、D、E四种元素组成的化合物中原子个数最少的化合物的化学式为 。
(4)火箭推进器中装有液态的C2A4和液态A2D2,它们发生化学反应时生成气态C单质和水蒸气,并放出大量热。已知0.4mol液态C2A4跟液态A2D2完全反应时,放出256.6kJ热量,该反应的热化方程式为 。
10. (12分)A、B、C、D是四种可溶的化合物,分别由阳离子K+、Ba2+、Al3+、Fe3+和阴离子OHˉ、![]() 、
、![]() 、
、![]() 两两组合而成,它们的溶液发生如下反应:
两两组合而成,它们的溶液发生如下反应:
A与B反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失。
C与D反应生成有色沉淀。
B与C反应生成白色沉淀。
写出它们的化学式:
A: B: C: D:
11. (14分) 请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
_________+__________→__________+__________+__________+H2O
(2)反应物中发生氧化反应的物质__________,被还原的元素是_________。
(3)反应中1 mol氧化剂_______(填“得到”或“失去”)___________ mol电子。
(4)请将反应物的化学式及配平后的系数填入下列相应的位置中:
| |
| |
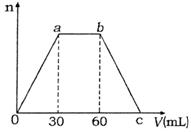 12.(8分)向Ca(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图所示,试回答:
12.(8分)向Ca(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图所示,试回答:
⑴a点之前反应的离子方程式为 ;
⑵c点的二氧化碳体积是 mL;
⑶混合稀溶液中Ca(OH)2和NaOH的物质的量之比为 。
2007秋钦州市六中高三10月份月考化学试题参考答案
第Ⅰ卷(选择题,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | D | C | B | D | D | A | C | C |
9. ②21.(10分)
(1)第二周期 第VA族(1分);电子式: (1分)
![]() (2)酸性(1分)NH4++H2O NH3H2O+H+(2分);c(NO3—)>c(NH4+)>c(H+)>c(OH-)(2分)
(2)酸性(1分)NH4++H2O NH3H2O+H+(2分);c(NO3—)>c(NH4+)>c(H+)>c(OH-)(2分)
(3)HCOONa(1分)
(4)N2H4(1)+2H2O2(1)=N2(g)+4H2O(g);△H=-641.5k/mol(2分)
10. 【答案】21. (10分)Ba(OH)2;Al2(SO4)3;K2CO3;Fe(NO3)3
11.
(1) FeSO4+HNO3→Fe(NO3)3+Fe2(SO4)3+N2O+H2O
(2) FeSO4 +5价N (3)得到 4 (4)24FeSO4+30HNO3→
12. ⑴Ca2++2OH-+CO2=CaCO3↓+H2O ⑵90(2分) ⑶l∶l
a、b、c、d、e是短周期元素,周期表中a与b、b与c相邻;a与e的最外层电子数之比为2∶3,b的最外层电子数比e的最外层电子数少1个;常见化合物d2c2与水反应生成c的单质,且溶液使酚酞试液变红。
(1)e的元素符号是 。
(2)a、b、c的氢化物稳定性顺序为(用分子式表示) ;b的氢化物和b的最高价氧化物的水化物反应生成Z,则Z中的化学键类型为 ,Z的晶体类型为 ;ab-离子的电子式为 。
(3)由a、c、d形成化合物的水溶液显碱性,其原因是(用离子方程式表示) 。
(4)一定量的d2c2与ac2反应后的固体物质,恰好与0.8 mol稀盐酸溶液完全反应,并收集到0.25 mol气体,则用物质的量表示该固体物质的组成为 、 。
(1)S
(2)CH4<NH3<H2O;共价健和离子键;离子晶体;[∶C![]() N∶]-
N∶]-
(3)CO32- +H2O![]() HCO3-+OH-或C7O42-+H2O
HCO3-+OH-或C7O42-+H2O![]() HC2O4-+OH-
HC2O4-+OH-
(4)0.3 mol Na2O2、0.1 mol Na2CO3