2008级高三化学模拟练习题
姓名: 学号:
6.化学与生活是紧密相联的,下列关于生活与化学的说法正确的是( )
A.随着人们生活节奏的加快,方便的小包装食品已被广泛接受,为了防止中秋月饼等富脂食品氧化变质,延长食品的保质期,在包装袋中常放入生石灰
B.现在用的清洁燃料主要有两类:一类是压缩天然气,另一类为液化石油气,它们属于碳氢化合物
C.福尔马林是一种良好的杀毒剂,也可用来消毒自来水
D.保护加酶洗衣粉的洗涤效果,应用沸水溶解洗衣粉
7.设NA表示阿伏加德罗常数,下列说法正确的是( )
A.在同温同压下,相同体积的任何气体单质所含的原子数目相同
B.电解硫酸铜溶液,若电解后产生标准状况下O25.6L,则转移的电子数目为2NA
C.室温下,42克乙烯和丙烯的混合气体中含碳原子为3NA
D.1mol镁与足量的氯气或氮气生成MgO或Mg3N2失去电子数分别为2NA和3NA
8.下列叙述正确的是( )
A.由不同种原子构成的纯净物一定是化含物
B.强酸可以制弱酸,但弱酸一定不能制强酸
C.离子晶体中一定含有离子键,而分子晶体中不一定有共价键
D.分子晶体的化学键越强,其熔、沸点就越高
9.X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法正确的是( )
A.Y、Z两元素形成的简单阴离子的还原性Z>Y
B.原子半径大小的顺序为W>X>Y>Z
C.X与W形成的化合物W2X2中含有离子键和共价键
D.Y、Z两种元素最高价氧化物的水化物的酸性Z>Y
10.下列各溶液中,微粒的物质的量浓度关系正确的是( )
A.0.1mol/L的(NH4)2SO4溶液中,c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B.25℃时,pH=7的氨水和硫酸铵的混和溶液中,c(NH4+)=c(SO42-)
C.0.1mol/L的Na2CO3溶液与0.05mol/L的盐酸等体积混合后的溶液中,
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液c[(NH4)2CO3]<[(NH4)2SO4]<c(NH4Cl)
11.常温下,下列各组离子在指定的环境中不能大量共存,且一定会放出无色气体的是( )
A.遇pH试纸变红色的溶液中:K+、Cl-、NO-3、NH+4
B.在c(H+)/c(OH-)=1×1012的溶液中:I-、Cl-、HCO-3、Na+
C.在c(H+)=![]() 的溶液中:Na+、S2-、NO-3、CO2-3
的溶液中:Na+、S2-、NO-3、CO2-3
D.由水电离出的c(H+)=1×10-12mol·L-1的溶液中:NH+4、Fe2+、SO42-、Cl-
12.用已知物质的量浓度的NaOH溶液滴定未知物质的量浓度的盐酸溶液时,用甲基橙做指示剂,下列实验操作会引起测量结果偏高的是( )
①酸式滴定管使用前,水洗后未用待测盐酸润洗;
②锥形瓶水洗后未干燥
③碱式滴定管用蒸馏水洗后,未用标准液洗
④读取滴定管终点读数时,俯视刻度线
⑤配制好的NaOH溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
A.③ B.②⑤ C.③⑤ D.③④⑤
13.在一定的条件下,当64gSO2气体被氧化成SO3气体时,共放出热量98.3KJ。已知SO2在此条件下转化率为80%,据此,下列热化学方程式正确的是( )
A.SO2(g)+1/202(g) ![]() SO3(g );△H=-98.3KJ·mol-1
SO3(g );△H=-98.3KJ·mol-1
B.2SO2(g)+02(g) ![]() SO3(1 );△H=-196.6KJ·mol-1
SO3(1 );△H=-196.6KJ·mol-1
C.SO2(g)+1/202(g) ![]() SO3(g );△H=-78.64KJ·mol-1
SO3(g );△H=-78.64KJ·mol-1
D.2SO2(g)+02(g) ![]() SO3(g );△H=+196.6KJ·mol-1
SO3(g );△H=+196.6KJ·mol-1
26.A、B、C、D四种短周期元素的原子半径依次减小,在周期表中B与A、C相邻,C的最外层电子数是其电子总数的3/4,D能分别与A、B、C形成电子总数相符的化合物X、Y、Z。试回答:
(1)在X、Y、Z三种化合物中稳定性由强到弱的顺序是(用化学式表示,下同) ,Z的电子式是 。
(2)常温下8gX完全燃烧生成液态水和CO2,放出热量akJ,写出表示X燃烧热的热化学方程式:
。
(3)将Y溶于水所得溶液与适量AlCl3溶液反应,其离子方程式是 。
(4)若由A、B、C、D四种元素组成一种离子化合物,1mol该化合物中含有10mol原子,则该化合物受热分解的化学方程式为 。
(5)Y跟HCl反应生成固体。该固体跟有毒的工业盐NaNO2的水溶液混合加热,NaNO2被完全破坏,当有1molNaNO2发生反应时,共有3mol电子转移,该反应的化学方程式 。
(1)H2O、NH3、CH4(2分) Z的电子式略H:C:H (2分)
(2)CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-2aKJ/mol(3分)
|
|
(5)NaNO2+NH4Cl NaCl+N2↑+2H2O(3分
27.已知:A、B、E为固体化合物;D、G为固体单质;F、X、Z为可燃性气体,F、X燃烧的火焰呈蓝色或淡蓝色。在一定条件下它们能实现如图所示的变化。
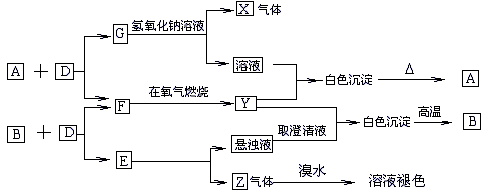
(1)写出A、B、Z、的名称。A_________,B________,E____________。
(2)G跟氢氧化钠溶液反应生成气体X和溶液,写出Y跟这种溶液所发生反应的类型______________________。
(3)写出G和氢氧化钠溶液反应的化学方程式:___________________________________________________。
(4)写出1molZ跟1molHCl反应的化学方程式:____________________________________________________。
(1)二氧化硅、氧化钙、碳化钙。(2)复分解反应。
(3)Si+2NaOH+2H2O=Na2SiO3+2H2+H2O。
(4)HC≡CH+HCl![]() CH2=CHCl。
CH2=CHCl。
28.回答下列问题:
⑴ 常温下将体积为v1、浓度为c1的一元弱酸与体积为v2、浓度为c2的一元弱碱混合。若v1·c1=v2·c2,混合后的溶液pH<7,则一元弱酸的电离程度 (选填“大于”、“小于”或“等于”)一元弱碱的电离程度;
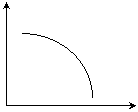 ⑵ 对于一定条件下体积可变的密闭容器中已达平衡的可逆反应:
⑵ 对于一定条件下体积可变的密闭容器中已达平衡的可逆反应:
A(g)+3B(g)![]() 2C(g);ΔH<0
2C(g);ΔH<0
若其他条件不变,只改变右图中横坐标所表示的物理量,纵坐标所表示的
物理量变化如右图所示:
① 若横坐标表示温度,则纵坐标可以表示 、 、
(至少填两个含义不同的物理量);
② 若横坐标表示压强,则纵坐标 (填“能”或“不能”)表示平衡混合物的密度,理由是:
。
⑴ 大于 (3分)
⑵ ① C的物质的量或百分含量、A或B的转化率、平衡混合物的平均相对分子质量(4分,每空2分)
② 不能 (2分) P增大,则容器体积减小,但混合气体的质量不变,故平衡混合物的密度增大(每空3分)
29.有机物A1和A2含有碳、氢、氧三种元素,且互为同分异构体。巳知6gA1在足量的氧气中完全燃烧生成13.2g二氧化碳和7.2g水。有关物质之间的转化关系如下:
已知:X为六元环状化合物
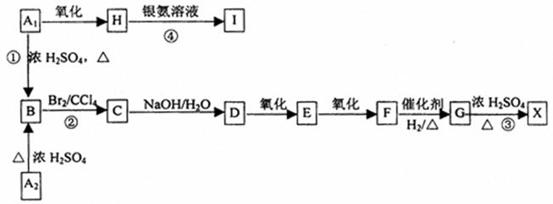
(1)A1的分子式为
(2)写出下列物质的结构简式:
A2 X
(3)书写化学方程式:反应④ ;
反应①属于 反应,反应②属于 反应
(4)与G具有相同官能团的G的同分异构体M在酸性条件下,加热失水生成N,N的甲酯可以发生加聚反应生成聚合物P,写出M→N的化学方程式:
聚合物P的结构简式为:
 (1)C3H8O(2分)
(1)C3H8O(2分)
(2)A2:CH3CHOHCH3(2分) X: (2分)
(3)④:CH3CH2CHO + 2 Ag(NH3)2OH ![]() 2Ag↓+ CH3CH2COONH4
+3NH3 + H2O (3分)
2Ag↓+ CH3CH2COONH4
+3NH3 + H2O (3分)
①:消去(1分) ②:加成 (1分)
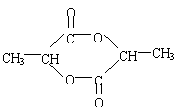
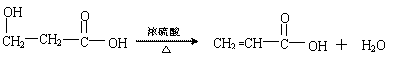 (4)
(4)
![]()
|
(2分)