机密 ★ 启用前[考试时间:2008 年 3 月 28 日上午 9 : 00 一 11 : 30 ]
08 级高三理综第三次诊断性考试能力检测化学卷
本试卷分第 I 卷(选择题)和第 II 卷(非选择题)两部分.第 I 卷 1 至 4 页,第 II 卷 5 至 12 页.满分 300 分.考试结束后,将试卷 II 和答题卡一并交回.试卷 I 由学生自己保留.
以下数据可供解题时参考,可能用到的相对原子质量:
H 一1 C 一 12 O 一 16 Na - 23 S - 32 K 一 39 Ca 一 40 Cu 一 64
第 I 卷(选择题 126 分)
注意事项:
1.答题前,考生务必将自己的姓名、准考证号、考试科目涂写在答题卡上.
2.每小题选出答案后,用铅笔将答题卡上对应题目的答案标号涂黑.如需改动,用橡皮擦干净后,再选涂其他答案,不能答在试卷上.只使用一张答题卡,科目栏填涂“综合”。
3.本卷共 21 小题,每小题 6 分,共 126 分.
一、选择题(本题包括 13 个小题.每小题只有一个选项符合题意)
6. 用 NA 表示阿伏加德罗常数的值,下列说法中正确的是
A.1.0L l mol·L-1氨水中 NH3·H2O 的分子数为 NA
B.标准状况下, 11.2 L 氯仿中含有的 C一Cl 键的数目为 1.5NA
C.0.6 g CaCO3 与 KHCO3 的混合物中所含质子数为 0.3NA
D.工业上铜的电解精炼,电解池中每转移 1 mol 电子时阳极上溶解的铜原子数为 0.5NA
7. 神州六号宇宙飞船发射升空,火箭使用的燃料是偏二甲肼[(CH3)2NNH2] ,火箭升空时发生的化学反应为: C2H8N2 + 2N2O4 === 2CO2↑+ 3N2↑ + 4H2O↑ 。下列有关该反应的说法正确的是
A.该反应的氧化剂是偏二甲肼
B.该反应进行时只有放热过程没有吸热过程
C.该反应中氮元素的化合价升高
D.该反应中每生成 l molCO2转移 8 mol 电子
8. X、Y 为同主族元素,Y 的原子半径大于X。下列说法正确的是(m、n 均为正整数) A.若X(OH)n为强碱,则 Y (OH)n也一定为强碱
B.若 H nXOm 为强酸,则X的氢化物溶于水一定显酸性
 C. 若 H nY为气态,则H n X的熔沸点一定比H nY 低
C. 若 H nY为气态,则H n X的熔沸点一定比H nY 低
D.若Y的最高正价为+7,则X的最高正价一定为+7
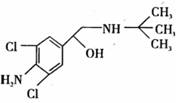
9. 去年,某地区约 300 多人,因食用“瘦肉精”喂养的猪肉而中毒,己知瘦肉精的结构如右图,则它可能发生的化学反应有: ① 酯化反应 ② 取代反应 ③ 氧化反应 ④ 消去反应
A.②④ B.②③
C.①②③ D.①②③④
10.由一种阳离子与两种酸根离子组成的盐称为混盐,混盐 CaOC12 在酸性条件下可以产生 C12 ,下列关于混盐 CaOCl2 的有关判断正确的是
A.该混盐与H2SO4溶液反应产生 l mo1C12 时转移 2 mol 电子
B.该混盐的水溶液呈酸性
C.该混盐具有较强的氧化性
D.该混盐中氯元素的化合价为+l 价
11.用下列装置测定水中氢、氧元素的质量比,其方法是分别测定通入氢气前后硬质玻璃试管的质量差和 U 形管的质量差,实验测得 m ( H ) : m ( O ) > 1 : 8 ,下列对导致这一结果的原因分析中,一定不正确的是
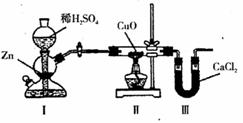
A.I、II 装置之间缺少干燥装置
B.实验后,II 装置中玻璃管内有水冷凝
C.II 装置中 CuO 没有全部被还原
D.III 装置后缺少干燥装置
12.下列各组离子在指定条件下一定不能大量共存的是
① 能使红色石蕊试纸变蓝的溶液中:Na+、K+、CO32-、NO3-、AlO2-
② c (H+)=0.lmol·L-1的溶液中:Cu2+、A13+、SO42-、NO3-
③ 能使碘化钾淀粉试纸变蓝的溶液中: Na+、NH4+、S2-、Br-
④ 由水电离出的c(H+)= 10-2mol·L-1的溶液中:Na+、Mg2+、Cl-、HCO3-
⑤ 在加入铝粉能产生氢气的溶液中:NH4+、 Fe2+、SO42-、NO3-
⑥ 在含有大量 Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
A.①②③ B.①③⑥ C.③④⑤⑥ D.②③④⑤
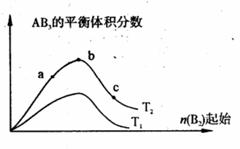 13.某化学科研小组针对反应:
A2 ( g ) + 3 B2 (g)
13.某化学科研小组针对反应:
A2 ( g ) + 3 B2 (g)![]() 2AB3
(g) , 研究在其他条件不变时,改变某一条件对化学平衡状态的影响,得到如图所示的变化规律(图中 T 表示温度, n 表示物质的量)。根据如图得出的判断结论正确的是
2AB3
(g) , 研究在其他条件不变时,改变某一条件对化学平衡状态的影响,得到如图所示的变化规律(图中 T 表示温度, n 表示物质的量)。根据如图得出的判断结论正确的是
A.正反应一定是放热反应
B.达到平衡时 A2 的转化率大小为: b > a > c
C.正反应一定是吸热反应,且 T2 > Tl
D. a、b、c 三点比较, b 点平衡体系中 A、B 原子数之比接近 1 : 3
自贡市普高 2008 级第三次诊断性考试
理科综合能力检测化学卷
第 II 卷(非选择题 174 分)
注意事项:
1、用钢笔或园珠笔直接答在试卷中.
 2、答题前将密封线内的各项填写清楚.
2、答题前将密封线内的各项填写清楚.
26.( 11 分)
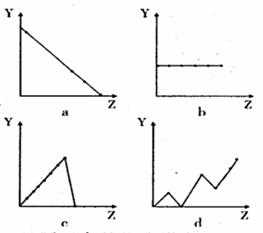
( l )右边曲线分别表示元素的某种性质与核电荷数的关系(Z 为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号(a、b、c、d )填入相应的空格中:
① IIA 族元素的价电子数___________
② 第3 周期元素的最高化合价______
③ F-、Na+、Mg2+、Al3+的离子半径_
______________________________。
( 2 )元素 X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。己知 Y 元素原子最外层电子数与核外电子总数之比为 3 : 4 ; M 元素原子的最外层电子数与电子层数之比为 4 : 3 ; N-、Z+、X+半径逐渐减小;化合物 XN 常温下为气体。据此回答:
① N 的最高价氧化物的水化物的化学式为_______________。
② 化合物 A、B 均为由上述五种元素中的任意三种组成的强电解质,且两种物质水溶液酸碱性相同,组成元素的原子数目比均为 1 : 1 : 1 , A 溶液中水的电离程度比 B 溶液中水的电离程度小,则化合物 A 中的化学键类型为__________________________,B 的化学式为_________________________________。
③ 工业上制取单质 M 的化学方程式为______________________________________。
![]()
27.(16 分)己知 (注:R , R/ 为烃基)。 A 为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物;其中的一种 B 可用于制取合成树脂、染料等多种化工产品, A 可能发生如图所示的变化。
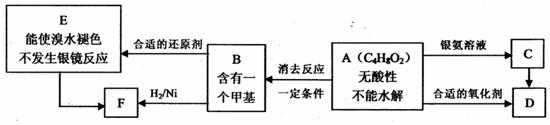
试回答:
( l )写出符合下述条件的 A 的同分异构体的结构简式(各任写一种):
a.具有酸性__________________________________________________________;
b.能发生水解反应____________________________________________________。
( 2 ) A 分子中官能团的名称是________________,D 的结构简式是_______________。
( 3 ) C→D 的反应类型是___________________________。
( 4 )写出化学方程式: A→B______________________________________________。
( 5 )写出 E 生成高聚物的化学方程式:____________________________________。
( 6 ) C 的同分异体C1与 C 有相同的官能团,两分子 C1脱去两分子水形成含有六元环的 C2 ,写出C2的结构简式:________________________________________________。
28.( 14 分)A、B、C、D、E、F 是常见单质,其中 A 是用量最大,应用最广泛的金属;元素 D 是地壳中含量最多的金属元素: D 元素和 E 元素在周期表中相邻, G、 H、l、J、K、L 是常见化合物,其中 G 在常温下是无色液体, H 是黑色晶体,以上物质相互间的转化关系如下图所示:
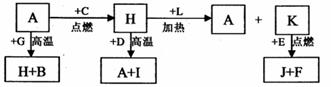
请回答下列问题:
( l )元素 A 在元素周期表中的位置为__________(周期)__________(族)。
( 2 )写出 K 的电子式_______________________________________。
( 3 )写出 H 和 D 反应的化学方程式_______________________________。
( 4 ) D 能与氢氧化钠溶液反应,请写出该反应的离子方程式:
_____________________________________________。
( 5 )写出 A 与 G 反应的化学方程式____________________________________。
( 6 ) K 与 E 反应时产生的现象有_________________________________________,
该反应的化学方程式为_______________________________________________。
29 . ( 19 分)为测定 Na2CO3 与 Na2SO3 混合物中各组分的含量,取样品 23.2g 按下图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)
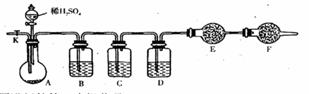
(l)将仪器连接好以后,必须进行的第一步操作是_____________________________。
(2)此实验还必须用到的最重要的仪器是_________________________;仪器 F 的作用是_____________________________________________________________。
(3)已知仪器 C 中装有品红溶液,其作用是_________________________________。
(4)实验室中备有以下常用试剂:a.浓硫酸 b.品红溶液 c.酸性高锰酸钾溶液 d.饱和碳酸氢钠溶液 e.氢氧化钠溶液 f.无水硫酸铜 g.碱石灰 h.五氧化二磷 请将下列容器中应盛放的试剂序号填入相应空格: B 中_______, D 中________, E 中_______。
实验过程中,当仪器 A 内的固体反应完全后,需打开活塞 K ,向 A 中通入大量的空气。这样做的目的是________________________________________________________。所通空气应先经过_______________试剂(填上述所供试剂的序号)处理,否则可能引起 Na2SO3 含量的测量结果比实际值_______________(填“偏高”“偏低”或“没影响”)。
( 5 )若仪器 E 在实验完成时增重 4.4 g ,则 Na2CO3与 Na2SO3 的物质的量之比为__________________________。
自贡市普高 2008 级第三次诊断性考试(理综)
化学参考答案及评分意见
第 I 卷( 48 分)
6 . C , 7 . D , 8 . A , 9 . D , 10 . C , 11 . C , 12 . C , 13 . D
第 II 卷( 60 分)
26.(11 分)
( 1 ) ( 6 分) ① b ② c ③ a
( 2 ) ① ( l 分) HClO4
② ( 2 分)离子键、(极性)共价键 NaClO
③ ( 2 分) SiO2
+ 2C![]() Si +2CO↑
Si +2CO↑
27.( 16 分,每空 2 分)
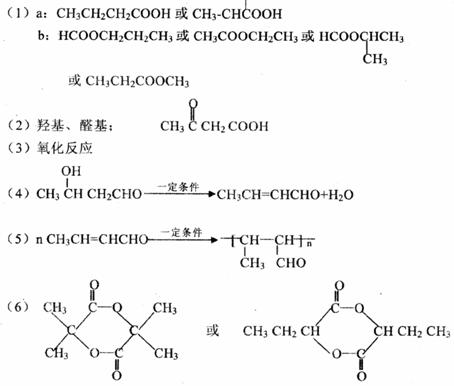
28.( 14 分,每空 2 分)
( l )四(周期)VIII(族)
( 2 ) ![]()
( 3 ) 3Fe3O4
+ 8Al ![]() 4A12O3 + 9Fe
4A12O3 + 9Fe
( 4 ) 2Al + 2OH-+2H2O = 2A1O2-+3H2↑
( 5 ) 3Fe +
4H2O ( g )![]() Fe3O4 + 4H2
↑
Fe3O4 + 4H2
↑
( 6 )镁带剧烈燃烧,(产生耀眼的白光,)瓶壁或瓶底出现白色固体和黑色颗粒。
2Mg + CO2 ![]() 2MgO + C
2MgO + C
29.( 19 分, 4 小问前三空每空 1 分,其余每空 2 分)
( l )检查装置的气密性
( 2 )托盘天平;防止空气中的水蒸气和 CO2 等进入 E 中
( 3 )检查 SO2是否除尽
( 4 ) c、a、g ;使 ABCD 各仪器中残留的 CO2 进入 E 被充分吸收; e 或 g ;偏低
( 5 ) l : l