08高考理综训练化学卷二
相对原子质量:H 1 C 12 O 16 Na 23 Al 27 N 14 S 32 K 39 Cl 35.5 Ba 137
6.从化学角度看,下列做法合理可行的是
A.使用聚氯乙烯塑料制品直接盛装食物
B.做发面馒头时可加入适量的烧碱
C.用灼烧的办法鉴别羊毛织品和纯棉织品
D.用铝制餐具可长时间存放咸味食物
7.下列除去杂质的方法正确的是
|
| 物 质 (杂 质) | 除 杂 方 法 |
| A | Cl2(HCl) | 将气体通过盛有氢氧化钠溶液的洗气瓶 |
| B | C2H4(SO2) | 将气体通过盛有高锰酸钾溶液的洗气瓶 |
| C | 氢氧化铁胶体(FeCl3) | 将混合物直接过滤 |
| D | SiO2 (CaCO3) | 加入盐酸后过滤 |
8.将两个铂电极插入氢氧化钾溶液中,向两极分别通入甲烷和氧气,即构成甲烷燃料电池,已知通入甲烷的一极,其电极反应为:CH4 + 10OH— — 8e— = CO32— + 7H2O;通入氧气的另一极,其电极反应式是2O2 + 4H2O +8e— = 8OH—,下列叙述正确的是
A、通入甲烷的电极为正极 B、燃料电池工作时,溶液中的阴离子向正极移动
C、正极发生氧化反应 D、该电池使用一段时间后应补充氢氧化钾
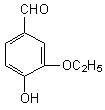 9.乙基香草醛是食品添加剂的增香原料,
9.乙基香草醛是食品添加剂的增香原料,
其结构简式如右图所示,下列对该物质叙述正确的是:
A.该物质可以进行消去反应
B.该物质可以进行水解反应
C.1mol该物质最多可与3 mol H2反应
D.该物质可以和Br2进行取代反应
10.常温下,下列各组气体等体积混合,充满试管倒立在水槽中,
试管内气体体积不会明显减少的一组是
| ① | ② | ③ | ④ | ⑤ | ⑥ |
| NO、O2 | C2H4、H2 | NO2、O2 | Cl2、SO2 | NH3、O2 | CO、O2 |
A.② ⑥ B.② ④ C.③ ⑤ D.① ③
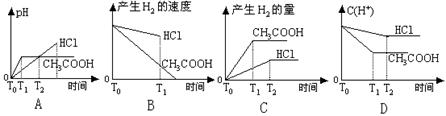
11.在体积都为1L,pH=2的盐酸和醋酸溶液中,投入0.65g锌粒,则下图所示比较符合客观事实的是
12.在一密闭容器中有如下反应:
L (s) + a G (g)
![]() b R (g)
b R (g)
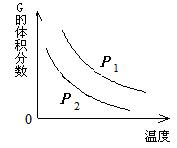 温度和压强对该反应的影响如右图所示,其中压强P1 < P2,
温度和压强对该反应的影响如右图所示,其中压强P1 < P2,
由此可判断
A. 正反应为放热反应
B. 化学方程式中的计量数a > b
C. G的转化率随温度升高而减小
D. 增大压强,容器内气体质量不变
13、某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或两种,现将13.8g样品加入足量水中,样品全部溶解,再加入过量的CaCl2溶液,得到9g沉淀。对样品所含杂质的正确判断是
A、肯定没有KNO3 B、肯定有KNO3,可能还有Na2CO3
C、肯定没有Ba(NO3)2,可能有KNO3 D、肯定没有Na2CO3和Ba(NO3)2
26.(15分)有X、Y、Z和W四种元素。已知:①X、Y、Z属同一短周期,其离子以X2+、
Y3+、Z-的形式存在。②W和Z组成化合物WZ3溶液遇苯酚呈紫色。请回答:
(1)Z的最高价氧化物对应水化物的名称为 。
(2)X的单质在二氧化碳中燃烧的化学方程式为 。
(3)Y的单质可用于冶炼金属锰,写出Y与二氧化锰反应的化学方程式:
,
Y的最高价氧化物对应的水化物既可溶于强酸又可溶于强碱,请用电离平衡理论解释其原因 。
(4)当有28.0 g W组成的单质,在加热条件下与足量水完全反应,则生成气体标准状况下的体积为 L。
(5)我国陆地上冶炼X的主要流程如图14所示
 |
已知当有 lmolX的氧化物参加反应时,有2 mol电子转移且生成三种产物,则步骤②反应的化学方程式为 。
(6)在新生代的海水中有一种细菌,它们提取海水中W2+,利用酶为催化剂把W2+转化为它们的皮鞘(可用W2O3表示其中W);该反应中的另一种反应物二氧化碳转化为甲醛,请用离子方程式表示上述转化过程(W用具体元素符号表示)
27.(16分)右图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有第ⅥA族和几种元素的位置。请回答下列问题:

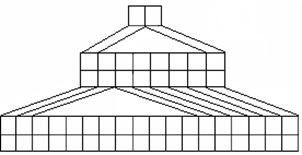
(1)请在上图中将铁元素所在族的位置全部涂黑。
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”。请写出NaH的电子式 。
(3)b元素的氢化物与其最高价氧化物的水化物可生成一种盐,该盐溶于水时
(“抑制”、“促进” 或“不影响”)水电离,其反应的离子方程式为:
;土壤中施用该盐做化肥时,其阴离子在水田中的利用率低,说明土壤胶体粒子带 (“正”或“负”)电荷。
(4)下列叙述正确的是 。
A.h的最高价氧化物对应的水化物是一种强碱
B.硒化氢的稳定性强于f的氢化物的稳定性
C.c的氢化物的水溶液是强酸
D.原子半径:h>e>a
E.相同条件下,d与f形成的化合物水溶液的pH大于d与g形成的化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性f弱于g
(5)d的某化合物呈淡黄色,可与氯化亚铁溶液反应生成红褐色沉淀和能使带火星的木条复燃的气体,若沉淀和气体的物质的量之比为2:1,反应的离子方程式为
28.(16分)钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程中的有关问题。
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
____________________________________________ 。
(2)铁在潮湿的空气中容易被腐蚀为铁锈(Fe2O3•x H2O),反应的化学方程式:
____________________________________________ 。
(3)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,
溶液中发生的化合反应的化学方程式______________________________ 。
(4)下列哪个装置可防止铁棒被腐蚀_____________ 。
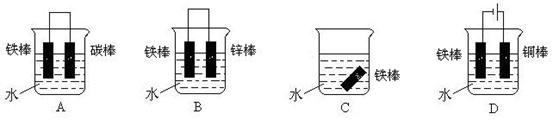
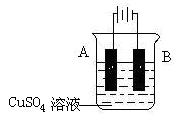 (5)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下:请回答:
(5)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下:请回答:
① A电极对应的金属是______(写元素名称),B电极的电极反应式是 。
② 若电镀前铁、铜两电极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为_________mol。
③ 镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
。
29. (13分)将![]() 和
和![]() 的混合物在密闭容器中加热至250℃,使其充分反应,混合物中
的混合物在密闭容器中加热至250℃,使其充分反应,混合物中![]() 的物质的量分数为X。
的物质的量分数为X。
(1)当X=1/2时,容器中固体产物________________________(写化学式),其物质的量为_______________________________。
(2)若反应后生成的气体为![]() 和
和![]() ,则X的取值范围__________________。
,则X的取值范围__________________。
(3)当![]() 时,产生气体的物质的量n与X的数学表达式
时,产生气体的物质的量n与X的数学表达式
_________________________________________。
参考答案
6 C 7 D 8 D 9 D 10 A 11 C 12 B 13 B

27.(16分) (1)(2分), (2)Na+[:H] -(2分)
(3)促进,NH4++H2O![]() NH3•H2O+ H+, 负 (2分,2分,2分)
NH3•H2O+ H+, 负 (2分,2分,2分)
(4)A、D、E(3分)
(5)3Na2O2+2Fe2++4H2O=2Fe(OH)3+O2↑+6Na++2OH-(3分)
28.(每空2分,共16分)
(1) ![]()
(2)4Fe + 3 O2 + x H2O === 2 Fe2O3•x H2O
(3)2 FeCl3 + Fe == 3 FeCl2
(4)B D
(5)① 铜 Cu2+ + 2e- == Cu
② 0.08 mol
③ 铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀。(其他答案合理也给分)
29. (13分)
(1)![]() ;(2分)
;(2分) ![]() (4分)
(4分)
(2)![]() (3分)
(3分)
(3)![]() (4分)
(4分)