高三化学上册月考试卷
Ⅰ卷(共54分)
选择题(每题只有一个选项符合要求)
1.化学反应前后肯定没有变化的是( )
①原子数目 ②分子数目 ③元素种类 ④物质的总质量 ⑤物质的种类
A.①④ B.①③⑤ C.①③④ D.①②③④
2.下列变化一定属于化学变化的是( )
①风化 ②变色 ③燃烧 ④爆炸 ⑤白磷转变成红磷 ⑥工业制氧气 ⑦久置氯水变成无色
A.①②③④ B.③④⑤⑦ C.①③⑤⑦ D.①③④⑦
3.下列说法或表示方法正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(金刚石,s)=C(石墨,s);△H=-1.90 kJ/mol可知,石墨比金刚石稳定
C.在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);△H=+285.8 kJ/mol
D.1 mol H2与0.5 molO2反应放出的热就是H2的燃烧热
4.单质X能从盐的溶液中置换出单质Y,由此可知( )
A.当X、Y都是金属时,X一定比Y活泼
B.当X、Y都是非金属时,Y一定比X活泼
C.当X是金属时,Y一定是非金属
D.当X是非金属时,Y可能是金属,也可能是非金属
5.下列说法中正确的是( )
A.碱性氧化物一定是金属氧化物 B.金属氧化物一定是碱性氧化物
C.酸性氧化物一定是非金属氧化物 D.非金属氧化物一定是酸性氧化物
6.某物质经分析知其中仅含一种元素,此物质是( )
A.一定是一种单质 B.一定是一种纯净物
C.一定是混合物 D.可能是纯净物也可能是混合物
7、FeS与一定浓度HNO3反应,生成Fe2(SO4)3、Fe(NO3)3、NO2、NO和H2O,当NO2和NO的体积为1∶1时实际参加反应的FeS与HNO3的物质的量之比是( )
A. 4∶9 B.2∶9 C.2∶11 D.1∶7
8.密度为![]() 的氨水,其溶质的质量分数为0.25,该氨水用等体积的水稀释后,所得氨水的质量分数为( )
的氨水,其溶质的质量分数为0.25,该氨水用等体积的水稀释后,所得氨水的质量分数为( )
A.等于12.5% B.大于12.5%
C.小于12.5% D.无法确定
9.将标准状况下的a LHCl(气)溶于1000 g水中得到的盐酸密度为![]() ,则该盐酸的物质的量的浓度是( )
,则该盐酸的物质的量的浓度是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
10.下列各组离子能在指定溶液中共存的是( )
①pH=0的溶液中:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
②使pH试纸变深蓝的溶液中:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
③水电离的C(H+)的溶液中:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
④加入Mg能放出![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
⑤使甲基橙变红的溶液中:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
A.①③ B.②④⑤ C.①②⑤ D.③⑥
11.下列离子方程式的书写正确的是( )
A.少量二氧化碳通入偏铝酸钠溶液中: ![]()
B.在溶液中亚硫酸氢铵与等物质的量氢氧化钠混合
![]()
C.氯气通入冷的烧碱溶液中: ![]()
D.硫酸氢钠溶液中加入碳酸氢钠溶液:![]()
12.下列叙述正确的是
A.直径介于1~100nm之间的微粒称为胶体
B.电泳现象可以证明胶体属于电解质溶液
C.利用丁达尔现象可以区别溶液和胶体
D.胶体粒子很小,可以透过半透膜
13.镁铁混合物4.9g,溶解在过量某浓度的稀硝酸中,完全反应得到标况下气体2.24L(假设气体全为NO),则向反应后的溶液中加入足量的烧碱,则可生成沉淀的量是
A、6g B、8g C、10g D、12g
14.在一定条件下,气体A可发生如下反应:2A(g)== B(g)+3C(g)。若已知所得混合气体对H2的相对密度为4.25。则A的式量是( )
A.8.5 B.16 C.17 D.34
15.若某钠原子的质量是ag,12C原子质量是bg,用NA表示阿伏加德罗常数,下列说法中正确的是
A.钠元素的相对原子质量一定是![]() B.mg该钠原子的物质的量一定是
B.mg该钠原子的物质的量一定是![]()
C.该钠离子mg中所含的电子数是![]() D.该钠原子的摩尔质量是aNAg
D.该钠原子的摩尔质量是aNAg
16.在MgCl2、KCl、K2SO4三种盐的混合溶液中,若K+、Cl-各为1.5mol,Mg2+为0.5mol,则SO42-的物质的量为
A.0.1mol B.0.5mol C.0.15mol D.0.25mol
17.同温同压下,某容器充满氧气时质量为116 g,若充满二氧化碳时质量为122g ,充满某气体时质量为114 g,则该气体的相对分子质量为
A、28 B、34 C、32 D、44
18.两种金属粉末的混合物2g,与足量稀硫酸反应,生成0.1gH2,则这种混合物的可能组成是
A.Fe、Mg B.Mg、Al C.Fe、Zn D.Fe、Cu
Ⅱ卷(共56分)
19.(18分)按要求写出下列方程式
⑴.(2分)写出下列物质在水溶液中的电离方程式
氯化铜
醋酸
⑵.(8分)写出下列反应的离子方程式
①硫酸铜溶液与氢氧化钠溶液混合
②碳酸钠溶液与稀盐酸混合
③边微热边向铵明矾![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液至中性.此时发生反应的离子方程式为______________ .
溶液至中性.此时发生反应的离子方程式为______________ .
向以上所得中性溶液中继续滴加![]() 溶液,这一步离子反应的离子方程式是______________.
溶液,这一步离子反应的离子方程式是______________.
⑶.(4分)写出符合离子方程式Ba2++SO42- =BaSO4↓的两个化学方程式
,
⑷.(4分)在反应KClO3+6HCl==3Cl2+KCl+3H2O中,KClO3被 ,是 剂;Cl2是 产物 ,被氧化和被还原的氯元素的物质的量之比为 。
20.(6分)某无色溶液,由Na+、Ag+、Ba2+、Al3+、、、、中的若干种组成。取该溶液进行如下实验:
(A)取适量试液,加入过量盐酸,有气体生成,并得到溶液;
(B)在(A)所得溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;
(C)在(B)所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。
根据上述实验回答下列问题:
⑴ 溶液中一定不存在的离子是 。
⑵ 一定存在的离子是 。
⑶ 判断沉淀乙成份的方法是 。
21.(16分)(1)(4分) 进行下面的实验,必须用到下述何种仪器,将正确的仪器名称填入空白处
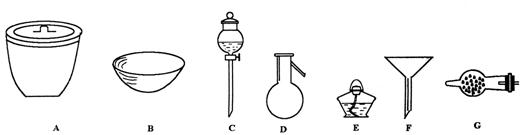
①欲干燥![]() 需使用仪器________________;
需使用仪器________________;
②欲分离互不相溶的两种液态物质,须使用________________;
③欲分离液态混合物中沸点不同的组分,须使用________________;
④欲分离浮于液体中的固体物质,须使用________________________________;
(2)(12分)实验室用固体烧碱配制500mL 0.1mol·L-1的NaOH溶液。
①需称量______ ____ g的烧碱固体,固体应放在____________中称量。
②配制过程中,不需要使用的仪器是(填符号)_____________。
A烧杯 B量筒 C玻璃棒 D1000mL容量瓶 E漏斗
③根据实验的实际需要和②中列出的仪器判断,完成实验还缺少的仪器
是____________________________________________ (填仪器名称)。
④ⅰ如果没有用蒸馏水洗涤烧杯、玻璃棒,配成的溶液的物质的量浓度比要求的_____ (填“偏高”或“偏低” );ⅱ有位同学在定容时不小心多加了水使液面高于刻度线,于是他用胶头滴管吸出过多的上层溶液。这样将会使配得的溶液的物质的量浓度 (填“偏高”、“偏低”或“无影响” )。
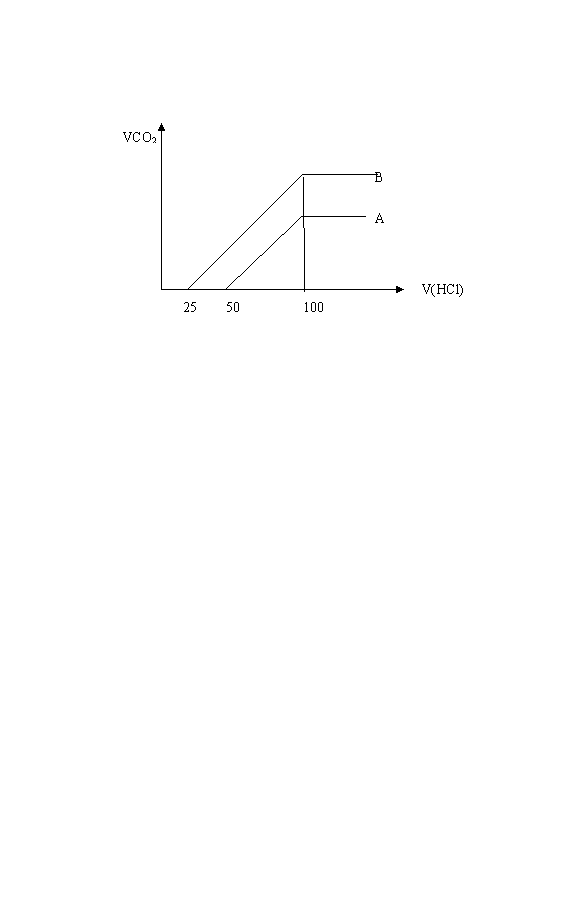
22.(16分)取等物质的浓度NaOH溶液两份A和B,每份20ml,向其中各通入一定量的CO2,然后分别将其稀释为100ml ,分别向稀释后的溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生CO2气体体积与所加盐酸的关系如下图所示
(1)曲线A表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式) ,加入盐酸后产生CO2体积的最大值 ml,滴入盐酸的过程中发生反应的离子方程式 、
。
(2)曲线B 表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式) ,两溶质物质的量之比为 ;加入盐酸后产生CO2体积的最大值为 ml。
(3)求原NaOH溶液物质的量的浓度 mol· L-1

 徐水一中高三月考 化学答卷纸
徐水一中高三月考 化学答卷纸
Ⅱ卷(共56分)
19.(18分)
⑴.氯化铜 醋酸
⑵.① ②
③ . .
⑶. ,
⑷. , ; ; 。
20.(8分) ⑴ 。 ⑵ 。
⑶ 。
21.(16分)(1)(4分)
①________________ ;②_______________;
③________________ ;④_______________________________;
(2)(12分)
①______ ____ ,____________。②_____________。
③____________________________________________ 。
④_____ , 。
22.(14分)
(1) , ,
、 。
(2) , ;
。
(3)


高三月考 化学试卷
答案
选择题:1---5 C C B C A 6----10 D C C D B
11-15 D C C C B 16—18 B A A
19(1)CuCl2= Cu2++2Cl- CH3COOH≒CH3COO-+H+
(2) Cu2++2OH-=Cu(OH)2 CO32-+2H+=CO2↑+H2O
NH4++Al3++2SO42-+2Ba2++4OH-=Al(OH)3↓+ 2BaSO4↓+NH3+H2O
AI(OH)3+ OH-=AlO2- +H2O
(3)还原 是氧化剂 氧化产物、还原产物 5:1
20 Ag+、、Ba2+、Al3+、MnO4- ; AlO2-、CO32-、Na+;
(滤出沉淀)加入盐酸,若沉淀全部溶解则是BaCO3;若沉淀部分溶解则为BaCO3和BaSO4的混合物。
21 (1)球形干燥管;分液漏斗;蒸馏烧瓶、酒精灯;漏斗。
(2)①2, 烧杯 ②DE ③ 胶头滴管 500ml容量瓶 ④偏低,偏低。
22(1)Na2CO3 112ml CO32-+H+=HCO3- HCO3-+H+=H2O+CO2↑
(2) Na2CO3 NaHCO3 1:2 168ml
(3)0.5ml·L-1