高三化学上半期联考试卷
(满分:100分;考试时间:100分钟)
命题:yuan
所需原子量:C-12 H-1 O-16 Ag-108 Ba-137 Mg-24 S-32 Na-23 Fe-56
I卷
一、 选择题(每小题只有一个正确答案,每题3 分,共48分)
1.禽流感病毒对常用消毒剂十分敏感,容易将其杀灭,如氧化剂、稀酸等都能迅速破坏其活性,下列不能杀灭禽流感病毒的物质是( )
A.H2O2溶液 B.NaClO溶液 C.矿泉水 D.醋酸
2、下列化学式能真实表示物质分子组成的是( )
A.HCOOH B. NaOH C.NH4HCO3 D.Si02
3. 一定条件下,碘单质与砹单质以等物质的量进行反应,可得AtI。它与Zn、NH3都能发生反应,化学方程式分别如下:2AtI+2Zn==ZnI2+ZnAt2 AtI+2NH3(1)==NH4I+NH2At 。则下列叙述正确的是( )
A.ZnI2既是氧化产物,又是还原产物
B.ZnAt2既是氧化产物,又是还原产物
C.AtI与液氨反应,AtI既是氧化剂又是还原剂
D.AtI与液氨反应,是自身氧化还原反应
4.阿伏加德罗常数约为6.02×1023mol-1,下列说法中一定正确的是( )
A.常温常压下,22g氧气和26g臭氧混合气体所含氧原子总数为3×6.02×1023
B.1L0.5mol/L的CH3COONa溶液中含有的CH3COO-数为0.5×6.02×1023
C.常温常压下,16g 14CH4所含中子数为8×6.02×1023
D.1 mol Cl2发生反应时,转移的电子数一定是2 NA
|
|
|
A.NH4Br:[NH+4] B.CaC12: [Ca2+]
|
C.N2:![]() D.Na2O2: Na+
Na+
D.Na2O2: Na+
Na+
6.下列离子反应方程式正确的是( )
A.澄清石灰水来吸收氯气:Cl2+OH-=Cl-+ClO-+H+
B.将金属Na加入冷水中:2Na+2H2O=2Na++2OH-+H2↑
C.硫酸镁溶液与氢氧化钡溶液反应:SO42─+Ba2+== BaSO4↓
D.在碳酸氢钙溶液中加入少量苛性钾溶液:
Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
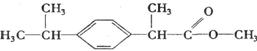 7.某种药物主要成分X的分子结构为
,
7.某种药物主要成分X的分子结构为
,
关于有机物X的说法中,错误的是( )
A.X难溶于水,易溶于有机溶剂 B.X不能跟溴水反应
C.X能使酸性高锰酸钾溶液褪色 D.X的水解产物能发生消去反应
8. 三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程为:用NaOH调NiCl2溶液pH至7.5,加适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是( )
A、可用铁作阳极材料
B、电解过程中阳极附近溶液的pH升高
C、阳极反应方程式为: 2Cl- - 2e- = Cl2
D、1mol二价镍全部转化为三价镍时,外电路中通过了2mol电子。
9.下列说法正确的是( )
A、原子晶体中只存在非极性共价键
B、稀有气体形成的晶体属于分子晶体
C、干冰升华时,分子内共价键会发生断裂
D、金属元素和非金属元素形成的化合物一定是离子化合物
10.常温下,下列溶液中一定能大量共存的离子组是( )
A.含有大量S2-的溶液:ClO-、Na+、Cl-、CO32-
B.无色澄清溶液:MnO4-、SO42-、K+、Fe3+
C.能使pH试纸变红的溶液:NH4+、Na+、SO42-、Fe3+
D.水电离产生的c(H+)=1×10-12mol/L的溶液:HCO3-、NH4+、Cl-、Ca2+
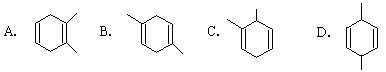
11、已知共轭二烯烃(两个碳碳双键间有一个碳碳单键)与烯烃或炔烃可发生反应生成六元环状化合物。如:1,3 ─丁二烯与乙烯反应可表示为:
则异戊二烯(2 ─甲基─1,3 ─丁二烯)与丙炔反应,
生成产物的结构简式可能是( )
|
A.电解法制铝时一般是用熔融态的氧化铝进行电解但也可用其相应的盐,如熔融态的A1C13
B.电解法生产铝时,需对铝土矿进行提纯,在提纯过程中应用了氧化铝或氢氧化铝的两性
C.在氯碱工业中,电解池中的阴极产生的是H2,NaOH在阳极附近产生
D.氯碱工业和金属钠的冶炼都用到了NaC1,在电解时它们的阴极都是C1-失电子
13.已知反应①2BrO3- + Cl2 =Br2 +2ClO3- ②5Cl2 + I2 +6H2O=2HIO3 +10HCl ③ClO3- +5Cl-+6H+=3Cl2 +3H2O,下列物质氧化能力强弱顺序正确的是( )C
A.ClO3->BrO3->IO3->Cl2 B.BrO3- >Cl2>C1O3->IO3-
C.BrO3->ClO3->Cl2>IO3- D.Cl2>BrO3->C1O3->IO3-
14.下列叙述中正确的是( )
A.相同条件下,N2和O3混合气与等体积的N2所含原子数相等
B.等物质的量的甲基(—CH3)和羟基(—OH)所含电子数相等
C.常温常压下28 g CO与22.4 L O2所含分子数相等
D.16g CH4与18 g NH4+ 所含质子数相等
15.向2mL0.5mol/L的FeCl3溶液中加入3 mL5mol/L的KF溶液,发现FeCl3溶液渐渐褪至无色,再加入KI溶液和CCl4振荡后,静置,不见CCl4层有紫红色,则下列说法正确的是( )
A.Fe3+不与I-发生反应 B.Fe3+与F-结合成不与I-反应的物质
C.F-使I-的还原性减弱
D.Fe3+被F-还原为Fe2+ ,使溶液中不再存在Fe3+
16.用类推的方法可能会得出错误结论,因此类推出的结论要经过实践的检验才能确定其正确与否。下列类推结论中正确的是:( )
A.Mg失火不能用CO2灭火,Na失火也不能用CO2灭火
B.工业上电解熔融MgCl2制取金属镁,工业上也用电解熔融AlCl3的方法制取金属铝
C.Al与S直接化合可以得到A12S3,Fe与S直接化合也可以得到Fe2S3
D.Fe3O4可以写成FeO·Fe2O3,Pb3O4也可写成PbO·Pb2O3
草 稿 纸
II卷
17、(1)、(10分)在某工厂在生产维尼纶过程中,先以乙炔和醋酸为原料,通过以下反应制得中间体。
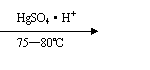 |
CH≡CH+CH3COOH CH3COOCH=CH2
(i)以上反应类型是 ,中间体名称是 。
(ii)写出中间体通过碳碳双键由小分子变成大分子的反应方程式
。
(iii)将中间体和稀碱溶液共热,可蒸馏出一种有机物甲的水溶液,含2.2g甲的溶液进行银镜反应可得10.8g银,则甲的结构简式为 。请写出该反应的化学方程式
。
(2)(15分)已知:
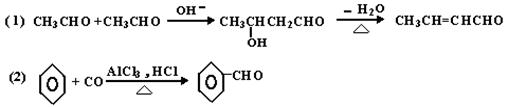
下列有机化合物A~H有如图的转化关系:
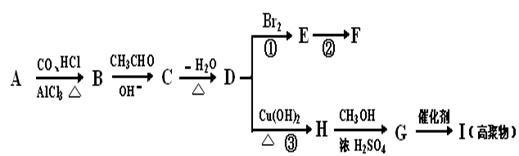
化合物D的分子式为C10H10O,其苯环上的一氯代物只有两种;F的分子式为C10H9OBr。请回答下列问题:
(i)写出下列化合物的结构简式:
A : I:
(ii)反应①的反应类型为 ,反应②的条件为 。
(iii)反应③的化学方程式为:
(iv)化合物D有多种同分异构体,其中属于酚类,结构中除苯环外无其他环且苯环上只有两种互为对位的取代基的同分异构体有 种(不考虑两双键直接相连)。请写出其中两种的结构简式
、 。
18、(8分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e→NO+2H2O。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生2mol气体,则转移电子的物质的量是 mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原
因是 。
19、(9分)(1)2mol/LNaHSO4与1mol/LBa(OH)2溶液等体积混合,反应的离子方程式为 ;若在反应后的溶液中继续滴加Ba(OH)2溶液,写出发生反应的离子方程式 ;
(2)、充分燃烧13 g乙炔气体时生成二氧化碳气体和液态水,并放出热量b kJ,写出乙炔燃烧的热化学方程式:
;
又已知:H2O(g)=H2O(l);△H2=-44.0kJ/mol,则1 mol乙炔燃烧生成二氧化碳气体和气态水放出热量为 。
20.(10分)
今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Cl-、Mg2+、Fe3+、CO32-、SO42-,现在每次取100.00ml进行实验。
(1)第一份加入AgNO3溶液有沉淀产生。
(2)第二份加足量NaOH后加热,收集到气体0.896L(标准状态下)。
(3)第三份加足量BaCl2后,得干燥沉淀6.27g,沉淀经足量盐酸洗涤干燥后,剩2.33g。试回答有关问题:
①判断Na+、Cl-是否存在?Na+ Cl- (填下列序号)
A.一定存在 B.可能存在 C.一定不存在
②肯定存在的离子在原溶液中的物质的量浓度分别为:
, ,
, 。
答题卷
评分栏 总分
| 选择题 | 第17题 | 第18题 | 第19题 | 第20题 |
一、单项选择题。(每题3分,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 |
| |||
| 答案 |
| |||||||||
II卷
17、(1)、(i)以上反应类型是 ,中间体名称是 。
(ii)
。
(iii) 。
。
(2)(i)写出下列化合物的结构简式:
A : I:
(ii)反应①的反应类型为 ,反应②的条件为 。
(iii)
(iv)
、 。
18、(8分)(1)
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生2mol气体,则转移电子的物质的量是 mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原
因是 。
19、(9分)
(1) ;
;
(2)、 ;
。
20.(10分)
①判断Na+、Cl-是否存在?Na+ Cl- (填下列序号)
②肯定存在的离子在原溶液中的物质的量浓度分别为:
, ,
, 。
参考答案
I卷
一、单项选择题。(每题3分,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | A | B | A | D | B | D | C | B | C |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 |
| |||
| 答案 | B | B | C | B | B | A |
| |||
II卷
17、
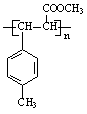 | |||
(1)A: I:
(2)加成反应 强碱的醇溶液、加热
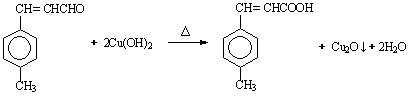 |
(3)
(4) 6种
18、(8分)
(1)14HNO3+3Cu2O→6Cu(NO3)2+2NO↑+7H2O
(2)酸性 氧化性
(3)6mol
(4)使用了较浓的硝酸,产物中有部分二氧化氮生成
19、(9分)(1)2H++SO42—+Ba2++2OH-=BaSO4 ↓ +2H2O;
SO42—+Ba2+= BaSO4 ↓
20、(10分)①A(1分) B(1分)
②c(Na+)≥0.2 mol·L-1 (2分) c(SO42-)=0.1 mol·L-1(2分)
c(CO32-)=0.2 mol·L-1(2分) c(NH4+)=0.4 mol·L-1(2分)