高三化学上学期单元测验题(1)
一、 选择题(单选题.每小题6分,共48分)
1.已知钡的活动性处于钾和钠之间,则下述说法可能实现的是( )
A.钡可以从氯化钠溶液中置换出钠 B.钡投入到硫酸铜溶液中可得两种沉淀和一种气体
C.钡不能从冷水中置换出氢而得到![]() D.在溶液中钡离子可氧化金属锌
D.在溶液中钡离子可氧化金属锌
2.一定温度下,Wg下列物质在足量氧气中充分燃烧,产物与过量的过氧化钠完全反应,过氧化钠固体增重Wg,符合此要求的是(1)H2 (2)CO (3)CO和H2 (4)HCOOCH3 (5)HOOC-COOH
A.全部
B.仅(4)(5)
C.仅(1)(2)(3) D.除(5)以外
3. 四种物质①氧化钠、②氢氧化钠、③过氧化钠、④亚硫酸钠。1 mol 上述固体物质,长期放置于空气中,最后质量增加情况是(不考虑潮解因素):( )
A.① = ② > ③> ④ B.① > ③ > ④ > ② C.② > ① = ③ > ④ D.④ > ② > ③ > ①
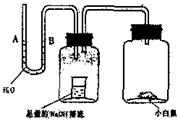 4.请据图回答,经数小时后,U型管(A)B两处的液面会出现下列哪种情况(实验装置足以维持实验期间小白鼠的生命活动,瓶口密封,忽略水蒸气和温度变化对实验结果的影响)( )
4.请据图回答,经数小时后,U型管(A)B两处的液面会出现下列哪种情况(实验装置足以维持实验期间小白鼠的生命活动,瓶口密封,忽略水蒸气和温度变化对实验结果的影响)( )
(A)A处上升,B处下降 (B)A、B两处都下降
(C)A处下降,B处上升 (D)(A)B两处都不变
5.把由Na2CO3·10H2O和NaHCO3组成的混合物7.4g溶于水配成100mL溶液,其中C(Na+)=0.6mol/L,若把等质量的混合物加热到恒重时,残留物的质量是
A.3.18g B.2.12g C.5.28g D.4.22g
6.某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理不正确的是:
| 50ml盐酸 | 50ml盐酸 | 50ml盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
|
| 2.24L | 3.36L | 3.36L |
A.盐酸的物质的量浓度为3.0mol·L—1 B.根据表中数据可以计算出混合物中NaHCO3的质量分数
C.加入混合物9.2g时盐酸过量 D.15.7g混合物恰好与盐酸完全反应
7.在甲、乙、丙、丁四个烧杯内放入0.1![]() 的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100
的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100![]() 水,搅拌,使固体完全溶解,则甲、乙、丙、丁所得溶液里溶质的质量分数大小的顺序是( )
水,搅拌,使固体完全溶解,则甲、乙、丙、丁所得溶液里溶质的质量分数大小的顺序是( )
A.甲<乙<丙<丁 B. 丁<甲<乙=丙 C. 甲=丁<乙=丙 D.丁<甲<乙<丙
8往含0.2 mol NaOH和0.1 mol Ca(OH)2的溶液中持续稳定地通入CO2气体,当气体为6.72 L(S.T.P)时立即停止,则这一过程中,溶液中离子数目和通入CO2气体的体积关系正确的图象是(气体的溶解忽略不计):
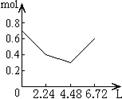
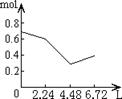
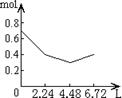
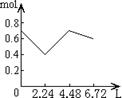
A B C D
二、非选择题(共60分)
9.此题包括两小题
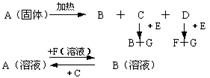
Ⅰ(8分)下图中A至F是化合物,G是单质.写出A、B、E、F的化学式A _____ B _____ E ______ F ____
Ⅱ(8分)X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。![]()
请回答:
(1)X与Y在溶液中反应的离子方程式是 。
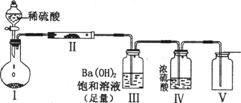
(2)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物利用上图装置(夹持固定装置己略去)进行实验,装置Ⅲ中生成白色沉淀,装置V中可收集到一种无色气体。
装置I中反应的化学方程式是 。
装置Ⅱ中反应的化学方程式是 。
装置Ⅲ中反应的化学方程式是 。
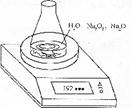
10.(16分)某种含有少量氧化纳的过氧化钠试样(已知试样质量为1.560g、锥形瓶和水的质量为190.720g),利用下图装置测定混合物中![]() 的质量分数,每隔相同时间读得电子天平的数据如表:
的质量分数,每隔相同时间读得电子天平的数据如表:
| 读数次数 | 质量/g | |
| 锥形瓶+水 +试样 | 第1次 | 192.214 |
| 第2次 | 192.164 | |
| 第3次 | 192 028 | |
| 第4次 | 192.010 | |
| 第5次 | 192.010 |
(1)写出![]() 和
和![]() 反应的化学方程式
。
反应的化学方程式
。
(2)计算过氧化钠质量分数时,必需的数据是 。不必做第6次读数的原因是 。
(3)测定上述样品(1.560g)中![]() 质量分数的另一种方案,其操作流程如下:
质量分数的另一种方案,其操作流程如下:
|
 操 作 Ⅰ → 溶液转移 → 操作Ⅱ → 称量
操 作 Ⅰ → 溶液转移 → 操作Ⅱ → 称量
①操作Ⅱ的名称是 。
②需直接测定的物理量是 。
③测定过程中需要的仪器有电子天平、蒸发皿、酒精灯,还需要 、 (固定、夹持仪器除外)。
④在转移溶液时,如溶液转移不完全,则![]() 质量分数的测定结果 (填偏大、偏小或不变)
质量分数的测定结果 (填偏大、偏小或不变)
11.(12分)现有一种碱金属的碳酸正盐和另一种碱金属的酸式碳酸盐组成的混合物,取0.506g加热至质量不再变化,把放出的气体通入足量的澄清石灰水中,得到白色沉淀0.200g。把加热后残留的固体与足量稀硫酸充分反应,生成的气体充分干燥后通过足量的过氧化钠粉末,结果过氧化钠粉末增重0.084g。试回答:
(1)混合物中酸式碳酸盐有
![]() (不用写计算过程)。
(不用写计算过程)。
(2)加热灼烧后残留的固体含碳酸盐
![]() (不用写计算过程)。
(不用写计算过程)。
(3)通过计算确定两种盐的化学式,写出计算和推理过程。
12.(16分)工业制纯碱,是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,它的反应原理可用下列化学方程式表示:①NH3+CO2+H2O=NH4HCO3…②NH4HCO3+NaCl(饱和)=NaHCO3↓+NH4Cl…
将所得碳酸氢钠晶体加热分解后即可得到纯碱。请回答:
(1)工业所制纯碱中常含有少量的氯化钠杂质,其原因 ______________
。
(2)现有甲、乙、丙三个小组学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计并完成实验如下。
甲组:取10.00g样品,利用下图所示装置,测出反应后装置C中碱石灰的增重为3.52g。
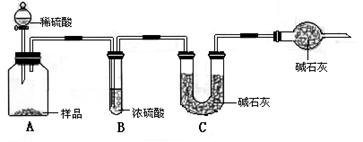 乙组:取10.00g样品,配成1000mL
乙组:取10.00g样品,配成1000mL
溶液,用碱式滴定管量取25.00mL放
入锥形瓶中,加入甲基橙作指示剂,
用0.150mol·L-1的标准盐酸溶液滴定
至终点(有关反应为Na2CO3+2HCl
=2NaCl+H2O+CO2↑)。完成三次平行实验后,消耗盐酸体积的平均值为30.00mL。
丙组:取10.00g样品,向其中加入过量的盐酸,直至样品中无气泡冒出,加热蒸发所得物并在干燥器中冷却至室温后称量。反复加热、冷却、称量,直至
所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g。请分析、计算后填表:
| 分析与 计算 分组 | 计算样品中碳酸钠 的质量分数 | 对实验结果 的评价 | 实验失败的主要原因 及对结果的影响 |
| 甲组 | 失败 | ||
| 乙组 | 成功 | ———————— | |
| 丙组 | 成功 | ———————— |
参考答案
1.B 2.D 3.B 4.C 5.A 6.D 7.B 8.C
9.Ⅰ A NaHCO3 B Na2CO3 E Na2O2 F NaOH
Ⅱ(1)HCO3-+OH-===H2O+CO32-
(2)Na2CO3+H2SO4===Na2SO4+H2O+CO2↑
或2NaHCO3+H2SO4===Na2SO4+2H2O+CO2↑
2Na2O2+2CO2===2Na2CO3+O2(若多写Na2O2与H2O反应的方程式且正确不扣分)
CO2+Ba(OH)2===BaCO3↓+H2O(以上每空2分,共8分)
10.(1)![]()
(2)试样质量、锥形瓶加水的质量、第4(或5)次的读数(或用具体数值表示);锥形瓶中质量已达恒重。
(3)①蒸发 ②![]() 的质量 ③烧杯、玻璃棒 ④偏大(每空2分)
的质量 ③烧杯、玻璃棒 ④偏大(每空2分)
11.(1)0.004(3分)
(2)0.003(3分)
(3)![]() (6分)
(6分)
12.(1)在饱和氯化钠溶液中通入氨气和二氧化碳,反应部分的水,从而有部分氯化钠晶体析出。(3分)
⑵84.8%(3分)反应生成的CO2部分残留在瓶A中,没有被完全吸收,结果偏小(2分)95.4%(3分)95.4%(3分)