高三化学实验测试题
第I卷(共70分)
一、选择题(每题只有一个正确选项,3分×9=27分)
1.化学工作者从反应![]() 受到启发,提出在农药和有机合成中可同时获得盐酸。这一设想已成为现实,试指出从上述反应物中得到盐酸的最佳方法
受到启发,提出在农药和有机合成中可同时获得盐酸。这一设想已成为现实,试指出从上述反应物中得到盐酸的最佳方法
A.蒸馏法 B.水洗分液法 C.升华法 D.有机溶剂萃取法
2.下列仪器:①量筒 ②普遍漏斗 ③滴定管 ④容量瓶 ⑤分液漏斗 ⑥蒸馏烧瓶,常用于物质分离的是
A.①③⑤ B.②④⑥ C.②⑤⑥ D.③⑤⑥
3.实验室进行下列实验:①苯与浓HNO3在浓H2SO4作用下制硝基苯 ②乙酸乙酯的水解 ③葡萄糖溶液的银镜反应 ④乙酸与乙醇在浓硫酸作用下制乙酸乙酯。其中需用水浴加热的有
A.①②③④ B.①②③ C.②③④ D.①③④
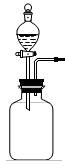
4.利用下列各组中的物质作用制备和收集相应气体,能采用右图实验装置的是
①浓氨水与固体NaOH ②浓硫酸与亚硫酸钠
③过氧化氢溶液与二氧化锰 ④稀硝酸与铜片
⑤镁条与稀硫酸 ⑥电石与水反应
A.仅①②③⑥ B.仅③ C.仅①②③ D.全部
5.对下列各种溶液中所含离子的判断合理的是
A.使紫色石蕊试液变红色的溶液中可能含:Na+、Ca2+、HCO3―
B.加铝粉有氢气放出,则溶液中可能含:Na+、H+、NO3―
C.在c(H+)=10-14mol/L的溶液中可能含:Na+、AlO2―、SO32―
D.向无色溶液中加氯水变橙色,溶液中可能含: SO42―、Br-、Ba2+
6.实验室中洗涤下列仪器的方法不合适的是
A.BaSO4沉淀用稀HNO3 B.硫磺用热碱溶液
C.酚醛树脂用酒精浸泡 D.银镜用稀HNO3
7.实验室里需用480ml 0.1mol/L的硫酸铜溶液,现选取合适规格的容量瓶进行配制,以下操作正确的是
A.称取7.68g硫酸铜,加入500mL水
B.称取12.0g胆矾配成500mL溶液
C.称取8.0g硫酸铜,加入500mL水
D.称取12.5g胆矾配成500mL溶液
8.下列除去少量杂质(括号内为杂质)的方法正确的是
①苯(苯酚):加入适量溴水、然后过滤 ②乙醇(水);加入足量新制生石灰、蒸馏 ③CO2(CO):点燃 ④KNO3(NaCl):重结晶 ⑤HCHO(HCOOH):加入足量新制生石灰、蒸馏 ⑥NaCl溶液(碘):酒精萃取、分液
A.①④⑤ B.①③⑥ C.②④⑤ D.②④⑥
9.用下列方法测定空气中的污染物含量:将一定体积的空气通入吸收剂,并测定其电导的变化(导体的电阻越小,它的电导越大),如测定空气中H2S的含量,若用CuSO4溶液作吸收剂,可测定很大范围内的H2S,但电导变化不大,灵敏度不高;若用溴水吸收,仅能测定低浓度范围内的H2S,有很高的灵敏度。现要测定空气中氯气的含量,并要兼顾吸收容量与灵敏度,则应选用下列吸收剂中的
A.Na2SO3溶液 B. KI溶液 C.NaOH溶液 D.NaCl溶液
10.下列各组物质均为两种无色溶液:①明矾溶液和NaOH溶液;②稀硫酸和碳酸氢钠溶液;③硝酸银溶液和氨水;④氢氧化钙溶液和盐酸;⑤碳酸钠溶液和稀硫酸。只用试管和胶头滴管而不用其它试剂,就可以将它们区分的是
A.只有①② B.①③⑤ C.①③④⑤ D.①②③④⑤
二、选择题(每题只有一至二个正确选项。正确答案有二个时,只选一个正确答案得2分,答案中只要有一个选项错误,得0分。4分×10=40分。)
11.下列化学实验措施不当的是
A.用纯锌片和稀硫酸反应制H2时反应不快,可将锌片的一角在硫酸铜溶液中浸一下,再和硫酸反应,可加快产H2速率
B.苯中滴入液溴未见反应,可加热促其进行
C.做催化裂化实验时,如无工业用优良催化剂,也可以用碎瓷片代替
D. 做石油分馏实验时,温度计的水银球应浸在液面下
12.现仅有下列仪器:烧杯,铁架台(带铁圈),三脚架,分液漏斗,石棉网,酒精灯,玻璃棒,蒸发皿,从缺少仪器的角度分析,不能进行的实验项目是
A. 过滤 B.蒸发 C.萃取 D.分馏
13.某学生实验完毕后,用下列方法清洗所用仪器:①用稀硝酸洗涤做过银镜反应的试验;②用酒精洗涤沾有酚醛树脂的试管;③用热的氢氧化钠溶液洗涤盛过油脂的烧杯;④用二硫化碳洗涤沾有硫璜的试管;⑤用盐酸洗涤盛过饱和石灰水的试剂瓶。则
A.除②外都正确 B.除④外都正确 C.只①③⑤正确 D.全都正确
14.对某酸性溶液(可能含有Br―、SO42―、H2SO3、NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色。
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝。
③加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。
对于下列物质不能确认原溶液中是否存在的是( )
A.Br— B.SO42― C.H2SO3 D.NH4+
15.按下述实验方法制备气体,合理而又实用的是
A.锌粒与稀硝酸反应制备H2
B.向饱和氯化铵溶液中滴加NaOH溶液制备氨气。
C.亚硫酸钠与浓硫酸反应制备SO2
D.大理石与浓硫酸反应制备CO2
16.某同学的实验报告中有以下数据:①用托盘天平称取11.7g食盐;②用量筒量取12.36ml盐酸;③用广范pH试纸测得某溶液的pH为3.6;④用标准NaOH溶液滴定未知浓度的盐酸,用去21.20mL NaOH溶液。其中数据合理的是
A.①④ B.②④ C.①③ D.②③
17.有一瓶无色气体,可能含有H2S、CO2、HBr、HCl、SO2中的一种或几种,向其中加入氯水,得到无色透明溶液,把溶液分成两份:向一份中加入盐酸酸化的BaCl2溶液,出现白色沉淀,另一份加入硝酸酸化了的AgNO3溶液,也有白色沉淀,下列结论正确的是( )
A.原气体中肯定有SO2 B.原气体中肯定没有H2S和HBr
C.原气体中肯定有SO2和HCl D.原气体中肯定没有CO2
18.有Na2CO3、AgNO3、BaCl2、HCl及NH4NO3五瓶无标签溶液,为鉴别它们,取四只试管分别装入一种溶液,再向上述四只试管中加入少许剩下的一种溶液,下列结论错误的是
A.若有三只试管出现沉淀时,则后加入的是AgNO3溶液
B.全部没有什么现象变化时,后加的是NH4NO3溶液
C.一只试管出现气体,两只试管出现沉淀时,最后加入的是HCl溶液
D.若只有两只试管出现沉淀时,则最后加入的是BaCl2溶液
19.在硫酸镁、硫酸铝、硫酸铁的混合溶液中,加入铁粉充分搅拌后,发现铁有剩余,将剩余的铁粉滤去,在滤液中加入过量的烧碱溶液,再滤去沉淀,则滤液中存在的阴离子是
A.只有SO42- B.只有OH-和SO42-
C.只有AlO2-和SO42- D.OH-、AlO2-、SO42-
20.将(NH4)2Fe(SO4)2和Al2(SO4)3各0.1mol溶解于烧杯中,分别慢慢加入含0.7molNaOH的溶液,并把生成的沉淀过滤、洗涤、灼烧。得到的固体再分别与1mol•L―1的盐酸反应,分别恰好与V1mL、V2mL盐酸反应。则:
A.V1=300mL V2=300mL B.V1=200mL V2=600mL
C.V1=300mL V2=600mL D.V1=150mL V2=450mL
第II卷(共80分)
21.为提纯下列物质(括号内的物质是杂质),请填写所选用的除杂试剂和分离方法。
| 被提纯的物质 | 除杂试剂 | 分离方法 |
| 氯化钠溶液(碘化钠) | ||
| 氯化铵溶液(氯化铁) | ||
| 二氧化碳(一氧化碳) | ||
| 苯(苯酚) |
22.某工厂废液经测定,主要含有乙醇,其中还溶有丙酮、乙酸和乙酸乙酯。根据各物质的性质(见下表),确定通过下列步骤回收乙醇和乙酸。
| 物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
| 沸点(℃) | 56.2 | 77.06 | 78 | 117.9 |
①向废液中加入烧碱溶液,调整pH=10。
②将混合液放入蒸馏器中缓缓加热。
③收集温度在70~85℃时的馏出物。
④排出蒸馏器中的残液,冷却后,向其中加浓硫酸(过量),然后再放入耐酸蒸馏器中进行蒸馏,回收馏出物。
据此回答下列问题:
(1)实验中②③用蒸馏方法分离和提纯该混合物,除了蒸馏烧瓶、冷凝管、锥形瓶、自来水外,尚缺少的玻璃仪器和用品是__________________。
(2)加入烧碱溶液调整pH=10的目的是____________________
(3)在70~85℃时馏出物的主要成分是______________________。
(4)在步骤④中,加入过量浓硫酸的目的是(用化学方程式表示)______________________,回收馏出物的温度控制在85~125℃,这时残留液中的主要成分是__________________。
23.(6分)两位同学设计了下述两个方案, 并都认为如果观察到的现象和自己所设计的方案一致,即可确定无色气体中一定含有SO2和CO2气体。
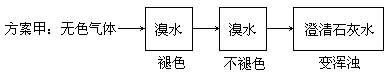
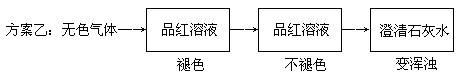
请你评价上述两个方案是否严密,并说明理由。
方案甲:_________,_____ 。
方案乙:_________,_______ _________________ 。
24.(10)下图是一个制取氯气并以氯气为原料进行特定反应的装置:
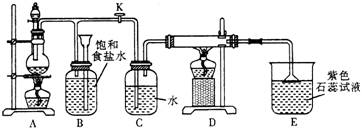
(1)A是氯气发生装置,其中的化学反应方程式为______________。
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,连接上E装置。Cl2通过C瓶后再进入D。D装置的硬质玻管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。试写出D中反应的化学方程式:_____________________________,装置C的作用是_________________。
(3)在E处,紫色石蕊试液的颜色变为红色,再变为无色,其原因是____________。
(4)若将E处烧杯中溶液改为澄清石灰水,反应过程中现象为______________。
(选填序号)
A.有白色沉淀生成 B.无现象 C.先生成白色沉淀 ,而后白色沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有![]() 产生,此时B中的现象是______________,B的作用是_________________。
产生,此时B中的现象是______________,B的作用是_________________。
25.(9分)下面a-e是中学化学实验中常见的几种定量仪器:
(a)量筒(b)移液管(c)滴定管(d)托盘天平(e)温度计
(1)其中标示出仪器使用温度的是_________(填写编号);
(2)能够用以精确量取液体体积的是________(填写编号);
(3)由于错误操作,使得到的数据比正确数据偏小的是____(填写编号);
(A)用量筒量取一定量液体时,俯视液面读数
(B)中和滴定达终点时俯视液面定管内液面读数
(C)使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度
(4)称取10.5g固体样品(1g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为________g。
(5)有下列实验:①苯与溴的取代反应 ②苯的硝化反应 ③乙醛的银镜反应
④酚醛树脂的制取 ⑤乙酸乙酯的制取 ⑥石油分馏实验
其中需要使用温度计的有_______(填写编号)
26.(12分)某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
①称量a g样品,置于烧杯中;
②加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;
③准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,加热使反应完全;
④趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到坩埚(质量为W1g)内,加热,直到固体全部由红褐色变为红棕色后,在干燥器中冷却至室温后,称量固体和坩埚的质量为m1g。
⑦……
请根据上面叙述,回答:
 (1)下图所示仪器中,本实验步骤①②③中必须用到的仪器是E和
(填字母)。
(1)下图所示仪器中,本实验步骤①②③中必须用到的仪器是E和
(填字母)。
A B C D E F G
(2)写出步骤③④中发生反应的离子方程式
、 。
(3)第⑥步的操作中,将沉淀物加热,冷却至室温,称量其质量为m1g,再次加热并冷却室温称量其质量为m2g,且m1-m2=0.3,接下来的操作应当是
。
(4)若坩埚质量是W1,坩埚和加热后固体总质量是W2,则样品中铁元素的质量分数为
。(请化简)
(5)该兴趣小组中甲学生认为:实验步骤③中不加入氯水,其余步骤不变,仍可达到目的。你认为甲学生的观点是否正确 ,请说明理由:
。
27.(14分)空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:

(1)溴在周期表中位于_________周期,_________族。
(2)步骤④的离子方程式:________________________________________ 。
(3)溴微溶于水,步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,上层为饱和溴水,它们的相对密度相差较大。分离出液溴的实验方法 ,主要仪器的名称是_____________。
(4)步骤⑥⑦⑧如果在实验室中进行,需用到的玻璃仪器有 。
(5)为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”: 。
(6)苦卤水还可以用制取金属镁,用化学方程式或离子方程式表示从苦卤水制取金属镁的反应原理 。
化学实验测试题
班级 坐号 姓名 成绩
一、二、选择题答案栏
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 21.
22.(1)尚缺少的玻璃仪器和用品是__ ________________ 。 (2)目的是__ __________________。 (3)在70~85℃时馏出物的主要成分是______________________。 (4)目的是(用化学方程式表示)___ __________________, 回收馏出物的温度控制在85~125℃,这时残留液中的主要成分是_______________。 23.(6分) 方案甲:_________,_____ 。 方案乙:_________,_______ _________________ 。 24.(10)(1)化学反应方程式为_ _____________。 (2)D中反应的化学方程式:____ _________________________,装置C的作用是_________________。 (3)其原因是___ _________。 (4)现象为_ (选填序号) A.有白色沉淀生成 B.无现象 C.先生成白色沉淀 ,而后白色沉淀消失 (5)此时B中的现象是__ ____________,B的作用是_________________。 25.(9分) (1)_________;(2)________;(3)_ ___; (4)则所称样品的实际质量为________g。 (5)其中需要使用温度计的有_______。 26.(12分)(1)①②③中必须用到的仪器是E和 (填字母)。 (2)写出步骤③④中发生反应的离子方程式 、 。 (3)接下来的操作应当是 。 (4)则样品中铁元素的质量分数为 。(请化简) (5)你认为甲学生的观点是否正确 ,请说明理由: 。 27.(14分)(1)溴在周期表中位于_________周期,_________族。 (2)步骤④的离子方程式:________________________________________ 。 (3)分离出液溴的实验方法 ,主要仪器的名称是_____________。 (4)需用到的玻璃仪器有 。 (5)要经过“空气吹出、SO2吸收、氯化”: 。 (6)反应原理 。 |
参考答案
21.(8分)为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是
| 被提纯的物质 | 除杂试剂 | 分离方法 |
| ①氯化钠溶液(碘化钠) | 氯水、四氯化碳 | 萃取、分液 |
| ②氯化铵溶液(氯化铁) | 氨水 | 调节PH=4,过滤 |
| ③二氧化碳(一氧化碳) | 氧化铜粉末 | 加热 |
| ④苯(苯酚) | 氢氧化钠溶液 | 分液 |
①漏写四氯化碳扣1分,漏写分液扣1分
②用氢氧化钠溶液不给分,引入新杂质Na+。
③用O2点燃,不给分。
④用浓溴水,溴可溶于苯,引入新杂质溴,且生成的三溴苯酚也可溶于苯中。不给分
22.(12分)
(1)温度计、承接管、酒精灯、碎瓷片(4分)
(2)中和乙酸,使乙酸转变为乙酸钠;使酯水解生成乙醇和乙酸钠。(2分)
(3)乙醇(或CH3-CH2OH)(2分)
(4)2CH3COONa+H2SO4=Na2SO4+2CH3COOH, Na2SO4和H2SO4 (4分)
23. (共6分)方案甲:_不严密_(1分),_若含乙烯、乙炔等气体也会使溴水褪色,因而不能确定无色气体一定含有SO2 。(2分)
方案乙:_严密__(1分),__能使品红褪色的无色气体只有SO2 ____。(2分)
24.(14)
(1)MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
(2分)
MnCl2+Cl2↑+2H2O
(2分)
(2)2Cl2+2H2O+C![]() 4HCl+CO2(2分);提供反应物Cl2和H2O(使逸出Cl2中混有水蒸气)(2分)
4HCl+CO2(2分);提供反应物Cl2和H2O(使逸出Cl2中混有水蒸气)(2分)
(3)生成HCl溶于水溶液程酸性,紫色石蕊试液变红;反应过程中,过量氯气溶于水中生成HClO有漂白性使紫色石蕊试液褪色(2分)。
有如下表述“氯气有漂白性”,扣1分。
(4)B(2分)
(5)分液漏斗液面上升(2分),
储存最后生成的Cl2,使烧瓶A中气压不致过高,产生危险,起安全瓶作用(2分)
25.(11分)
(1)其中标示出仪器使用温度的是___abc__(填写编号) (3分);
(2)能够用以精确量取液体体积的是__bc _(填写编号)(2分);
(3)B (2分)
(4)9.5 (2分)
(5)②⑥ (2分)
26.(14分)(1)C F G(2分)(对1个不给分,对2个1分,对3个2分)
(2)2Fe2+ +Cl2=2Fe3++2Cl- (2分) Fe3++3NH3•H2O=Fe(OH)3+3NH4+(2分)
(3)继续加热,放置干燥器中冷却,称量,至最后两次称得的质量不超过0.1g
为止。(2分)
(4)![]() ×2×56g/mol×
×2×56g/mol×![]() ÷
÷![]() g×100% (3分)
g×100% (3分)
(5)正确(1分),FeCl3、FeCl2溶液中加入过量氨水,生成Fe(OH)3和Fe(OH)2沉淀,在操作过程中Fe(OH)2会被空气进一步氧化生成Fe(OH)3,最后所得生成物只有Fe2O3,
对实验结果无影响。(2分)
27.(15分)(1)四 VIIA (2分)
(2)Br2+SO2+2H2O=4H++2Br-+SO42- (2分)
(3)分液漏斗 (2分)
(4)酒精灯、蒸馏烧瓶、温度计、冷凝管、接液管、锥形瓶(4分,少一个扣1分,扣完为止。)
(5)①氯化后的海水虽然含有溴单质,但浓度低,如果直接蒸馏原料,产品成本高。 ② “空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的浓缩过程。(2分,回答①②任一点均得分)
(6)Mg2++2OH―=Mg(OH)2↓ 2H++Mg(OH)2=Mg2++2H2O MgCl2 ![]() Mg+Cl2↑(3分)
Mg+Cl2↑(3分)