高三化学实验综合检测试卷
本试卷满分100分,考试时间90分钟。
相对原子质量:H—1 N—14 O—16 Na—23 K—39 S—32 Cl—35.5 Cu—64
| 题类 | 一 | 二 | 三 | 四 | 总分 |
| 得分值 |
|
|
|
|
|
一、 选择题(本题共8分,每小题2分,只有一个正确答案。)
1.实验室制取下列气体,其反应放热的是 ( )
A.由无水醋酸钠制CH4 B.由乙醇制C2H4 C.由电石制C2H2 D.由氯酸钾制O2
2.以下实验能获得成功的是 ( )
A.用含结晶水的醋酸钠和碱石灰共热制甲烷气体
B.将铁屑、溴水、苯混合制溴苯
C.在苯酚溶液中滴入少量稀溴水出现白色沉淀
D.将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色
3.某同学在实验报告中写有以下实验数据:① 用托盘天平称取11.7g食盐;② 用量筒量取5.26mL的盐酸;③ 用广泛pH试纸测得某酸溶液的pH值是3.3;④ 滴定盐酸时用去23.00mLNaOH溶液,其中数据合理的是( )
A. ①② B. ③④ C. ①④ D. ①③④
4.实验室需用480毫升0.1摩升的硫酸铜溶液,现选取500毫升容量瓶进行配制,以下操作正确的是( )
A.称取7.68克硫酸铜,加入500毫升水 B.称取12.0克胆矾配成500毫升溶液
C.称取8.0克硫酸铜,加入500毫升水 D.称取12.5克胆矾配成500毫升溶液
二、 选择题(本题共24分,每小题3分,只有一个正确答案。)
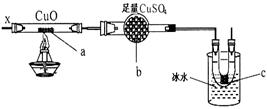
5.下图装置可用于 ( )
 A.加热NaHCO3制CO2
A.加热NaHCO3制CO2
B.用铜与稀HNO3反应制NO
C.用NH4Cl与浓NaOH溶液制NH3
D.用铜与浓HNO3反应制NO2
 6.()如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤
6.()如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤
入集气瓶后,烧杯中的水会进入集气瓶,集气瓶气体是 ( )
① CO、O2 ② Cl2、CH4 ③ NO2、O2 ④ N2、H2
A.①② B.②④ C.③④ D.②③
7.右图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是 ( )
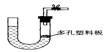 A.大理石和稀硫酸制取二氧化碳 B.锌粒和稀硫酸制氢气
A.大理石和稀硫酸制取二氧化碳 B.锌粒和稀硫酸制氢气
C.浓盐酸和二氧化锰制取氯气 D.电石和水制取乙炔
8.用98%的浓H2SO4(![]() )配制
1mol/L的稀硫酸100mL,按配制溶液时仪器的选用顺序排列,选择正确的是( )
)配制
1mol/L的稀硫酸100mL,按配制溶液时仪器的选用顺序排列,选择正确的是( )
① 玻璃棒 ② 胶头滴管 ③ 100mL容量瓶 ④ 托盘天平 ⑤ 50mL烧杯 ⑥10mL量筒
⑦ 100mL量筒 ⑧ 移液管 ⑨ 滴定管
A. ⑥③⑧⑤①② B. ⑥⑤③①⑨② C. ④⑤③②①⑨ D. ⑥⑤①③②
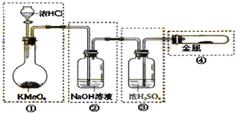 9.已知KMnO4与浓HCl在常温下反应能产生Cl2。若用图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是(不考虚①单元装置)( )
9.已知KMnO4与浓HCl在常温下反应能产生Cl2。若用图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是(不考虚①单元装置)( )
A.只有④处 B.只有②处
C.只有②和③处 D.②、③、④处
10.关于下列各装置图的叙述中,不正确的是 ( )
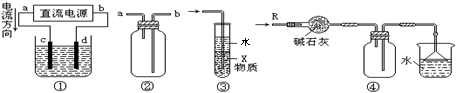
A.装置①中,d为阳极、c为阴极
B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
11.某同学进行胆矾结晶水测定实验,得到下(1)~(4)组数剧:
| 编号 | 加 热 前 | 加 热 后 | |
| 坩埚质量(克) | 坩埚+胆矾质量(克) | 坩埚+无水CuSO4质量(克) | |
| (1) | 5.0 | 7.5 | 6.6 |
| (2) | 5.42 | 7.95 | 6.8 |
| (3) | 5.5 | 8.0 | 7.1 |
| (4) | 5.0 | 7.5 | 6.8 |
实验数据表明有两次实验失误,失误的实验是( )
A.(1)和(2) B.(2)和(4) C.(1)和(3) D.(3)和(4)
12.下列实验操作会引起测定结果偏高的是( )
A. 测定硫酸铜晶体结晶水含量的实验中,晶体加热完全失去结晶水后,将盛试样的坩埚放在实验桌上自行冷却
B. 中和滴定用的锥形瓶加入待测液后,再加少量蒸馏水稀释
C. 为了测定一包白色粉末的质量,将药品放在右盘,砝码放在左盘,并需移动游码使之平衡
D. 取待测液的移液管用水洗后,没用待测液润洗2~3次
三、 选择题(本题共12分,每小题4分,每小题有一个或两个正确选项。只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个该小题不给分。)
13.下面是实验室制取氨气的装置和选用的试剂,其中错误的是 ( )
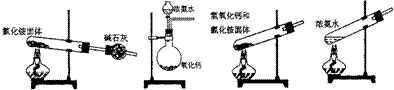

A B C D
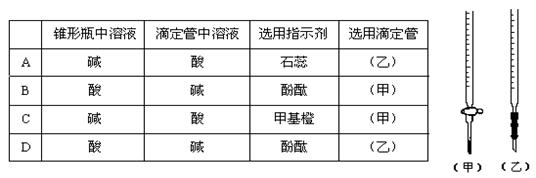
14.用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考右图,从下表中选出正确选项
15.按下图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到液体,
|
A.CH3CH2OH(气)
B.CO和H2
C.NH3
D.H2
四、 填空题 (共7题,合计56分)
16.(6分)⑴下列实验操作中,错误的是
①用10mL量筒量取6.4mL盐酸;
②切割白磷时,必须用镊子夹取,置于桌面上的玻璃片上,小心用刀切割;
③配制FeSO4溶液,应先将盐溶解在稀硫酸中,再加水稀释到所需浓度,并加入少量铁屑;
④加热烧杯(瓶)时要垫石棉网,所以在加热前,烧杯(瓶)外壁不必擦干;
⑤不慎接触过多的氨,应及时吸人新鲜的空气和水蒸气,并用大量水冲洗眼睛;
 ⑥用带橡皮塞的棕色试剂瓶存放浓HNO3。
⑥用带橡皮塞的棕色试剂瓶存放浓HNO3。
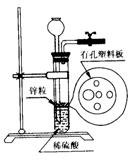
⑵右图为实验室制H2的装置。若液面刚好不与锌粒接触而又无
酸液可加入,则可以从长颈漏斗中加入适量试剂是
①食盐水 ②苯 ③四氯化碳
④Na2CO3溶液 ⑤硫酸铜溶液 ⑥KNO3溶液
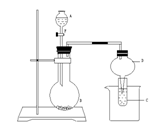 17.(6分)某研究性学习小组设计了如图所示的装置进行下列有关实验
17.(6分)某研究性学习小组设计了如图所示的装置进行下列有关实验
(1) 若A为浓H2SO4 ,B为第三周期金属元素组成的片状金属单质,它在常温下难与水反应,C为品红溶液,实验中观察到溶液红色褪去,
则B为 ________:然后向烧杯中注入沸水,又可观察到的现象是____________________________________________________。
(2) 若B为生石灰,实验中观察到C溶液先生成沉淀,而后沉淀溶解,当沉淀恰好澄清时,关闭F,然后向C中滴入E的溶液并向烧杯中加热水,静置片刻,观察到试管壁上有光亮的银镜,则C是____ _的溶液。
(3) 在上述反应过程中仪器D中可能观察到的现象为_____________________ ______。
(4)仅用上述装置的左边部分作发生装置,不能用于制取①CO2,②H2 ,③O2 ,④C2H2
四种气体中的________________;其最主要理由是________________________________ 。
18.(7分)三农问题是政府和社会关注的问题,化肥是土地的营养品。某农资商店出售一种化肥,其有效成分为氯化铵,现欲测定该种化肥中氮元素的质量分数,设计实验步骤如下(杂质中不含氮元素,且杂质均不与盐酸或氢氧化钠溶液反应):
①配制1.00mol/L的HCl溶液和1.00mol/L的NaOH溶液;
②每次取1.00g此化肥样品,溶于20mL蒸馏水中;
③加入30.00mL1.00mol/L的NaOH溶液,将反应后的溶液加热煮沸约1分钟,冷却至常温;
④……………………;
⑤重复②③④步操作1-2次;
⑥记录整理实验所得数据,计算该化肥中氮元素的质量分数。
请回答下列问题:
(1)写出步骤④中的实验内容 ,写出实验步骤④中的离子方程式: 。
(2)下列仪器中,配制盐酸和氢氧化钠溶液都能用到的是( )
A.玻璃棒 B.托盘天平 C.烧杯 D.漏斗
(3)步骤⑤的实验目的是 。
(4)配制本实验所需的1.00mol/L的盐酸和1.00mol/L的NaOH溶液从节约化学药品的角度出发,最好应选用的容量瓶规格分别为 (填字母选项)。
A.50mL,50mL B. 150mL,100mL C. 100mL,150mL D. 250mL,500mL
(5)若以Vx(mL)表示实验所测定消耗盐酸数据的平均值,该化肥样品中氮元素的质量分数计算表达式为 。(不需要化简)
19.(8分) 补铁剂中铁元素的含量是质检部门衡量其质量的重要指标,实验主要包括如下步骤:
①配制0.01mol/L、0.008mol/L等一系列浓度的[Fe(SCN)6]3—(红色)标准比色液
 ②样品处理
②样品处理
③准确量取一定体积的待测液于溶液中(比色管),加入稍过量的KSCN溶液,并稀释到10mL。
④比色,直到与选取的标准颜色一致或相近即可。
试回答下列问题:
①配制100mL0.01mol/L溶液,需要的玻璃仪器有:烧杯、玻璃棒、量筒,还需要:
、 。
②步骤②脱色过程包括加入: (填:脱有机色素的吸附剂名称)→搅拌煮沸→冷却→ (填操作)。
③比色法确定待测液的浓度其原理是
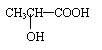 ④若其补铁剂是由乳酸(
)与铁粉作用生成的,请写出该反应的化学
④若其补铁剂是由乳酸(
)与铁粉作用生成的,请写出该反应的化学
方程式:
20.(6分)某同学运用已有的Na2O2和CO2反应的知识进行迁移,认为Na2O2也可和SO2反应,反应式可能为:![]() ,为此设计如下一套装置,来验证Na2O2和SO2的反应产物。
,为此设计如下一套装置,来验证Na2O2和SO2的反应产物。
如图安装仪器,检查装置气密性后添加药品并滴入适量浓硫酸,回答下列问题:
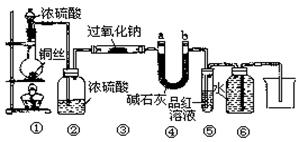
(1)点燃①处酒精灯,不久,观察到①处产生大量气体;③处两通管管壁发热,管内药品的颜色变化为 色逐渐变为 色。
(2)在反应过程中如何用较简便的操作证明反应产生了O2?
(3)⑥处用排水法收集气体,从什么现象可证明收集的气体中已不含SO2?
(4)待反应结束后,取两通管内少量固体,装入试管中,加水溶解时未产生气体,如何证明产物中有Na2SO3?
(5)待反应结束后,取两通管内少量固体,装入试管中,加入足量盐酸溶液,再加入氯化钡溶液,有白色沉淀生成,试分析产生沉淀的原因。
21. (11分) 在实验室可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
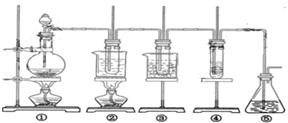
图中: ① 为氯气发生装置;②的试管里盛有15mL30%KOH 溶液.并置于水浴中; ③ 的试管里盛有15mL 8 % NaOH 溶液.并置于冰水浴中; ④ 的试管里加有紫色石蕊试液; ⑤ 为尾气吸收装置。请填写下列空白:
( l )制取氯气时,在烧瓶里加人一定量的二氧化锰.通过_____________________(填写仪器名称)向烧瓶中加人适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在① 与② 之间安装盛有_____________________(填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
( 2 )比较制取氯酸钾和次氯酸钠的条件.二者的差异是:
______________________________________________________
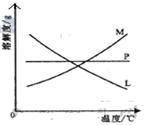 反应完毕经冷却后,② 的试管中有大量晶体析出。右图中符合该
反应完毕经冷却后,② 的试管中有大量晶体析出。右图中符合该
晶体溶解度曲线的是_____________________(填写编号字母);
从②的试管中分离出该晶体的方法是__________(填写实验操作名称)
(3)本实验中制取次氯酸钠的离子方程式是:___________________________________________
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为____色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | _______________________________________________ |
| 然后溶液从无色逐渐变为____色 | _______________________________________________ |
22.(12分)目前测定空气中SO2含量主要用氧化还原反应。已知SO2气体与酸性KMnO4溶液反应时,MnO![]() 被还原为Mn2+,SO2被氧化成SO
被还原为Mn2+,SO2被氧化成SO![]() 。
。
为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:
![]()
![]()
![]() ①其中:
或 表示密闭容器;
表示气体流速管(单位时间内通过气体的体积
①其中:
或 表示密闭容器;
表示气体流速管(单位时间内通过气体的体积
![]()
![]() 恒定,且无除尘和吸收气体作用); 表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;
表示气体的流向。
恒定,且无除尘和吸收气体作用); 表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;
表示气体的流向。
②酸性KMnO4溶液体积为200mL,浓度为0.1mol·L-1。回答下列问题:
(1)配制200mL0.1mol·L-1酸性KMnO4溶液,需用到的仪器按使用的先后顺序依次有 、玻璃棒、 、 、 。玻璃棒的作用是 。
(2)写出并配平测定SO2含量的离子方程式:____________________________________________
(3)若气体流速管中气体流速为acm3/min,当tmin时酸性KMnO4溶液恰好褪色,则空气中SO2的含量为_____________ (g/cm3)。
(4)实验中棉花的作用是______________________________________________;
若要测定空气中可吸入颗粒的含量(g/L),还需要测出的数据是 。
(5)乙同学按照同样的方法测量空气中SO2的含量,所测得的数值总是比实际含量偏低,最可能的原因是(假设溶液配制、称量或量取及各种读数均无错误): ___________________。
参考答案:
一、 选择题(本题共8分,每小题2分,只有一个正确答案。)
1.C 2.D 3.C 4.D
二、 选择题(本题共24分,每小题3分,只有一个正确答案。)
5. B 6. D 7. B 8. D 9. D 10. A 11. B 12. C
三、 选择题(本题共12分,每小题4分,每小题有一个或两个正确选项。只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个该小题不给分。)
13. AC 14. CD 15. A
四、 填空题
16. (6分) ⑴②④⑥(3分);⑵①③⑤ (3分) (答对一个给1分,答错1个不得分。)
17. (6分) (1)Mg(1分) ,
试管中的无色溶液又变红色(1分) (2)![]() (1分)
(1分)
(3)C中的液体进入D中(其它可能现象不作要求)(1分)
(4)4(1分) 缺少加热装置(填无温度计者不给分)(1分)
18. (7分)(1)以酚酞为指示剂,用1.00mol/L的HCl溶液滴定,达到滴定终点用去V(mL);(1分)
OH-+H+ →H2O (1分)
(2)AC (1分) (3)减小误差,提高实验结果的准确度。(1分) (4)C (1分)
(5)(30×10-3×1-Vx×10-3×1)×14/1 ×100% (2分)
19. (8分) ⑴100mL容量瓶,胶头滴管;(各1分)⑵活性炭,过滤;(各1分)
⑶溶液颜色与物质的量浓度成正比(2分)
⑷2CH3CHOHCOOH+Fe → (CH3CHOHCOO)2Fe+H2 (2分)
20. (6分)(1)淡黄(1分); 白(1分)
(2)打开④处U型管a处橡皮塞,插入带火星的木条,如果复燃,说明产生了O2(1分)
(3)⑤处品红溶液不褪色,说明氧气中不混有二氧化硫(1分)
(4)向该溶液中加入稀盐酸,有气体产生。(1分)
(5)由于过氧化钠有氧化性,反应过程中有部分亚硫酸钠被氧化为Na2SO4,和BaCl2反 应产生难溶于盐酸的BaSO4。(1分)
21. (11分) ( l ) 分液漏斗(1分)
B(1分)
(2)碱溶液(或反应物)的浓度不同,反应温度不同(1分) M(1分) 过滤(1分)
(3)Cl2 + 2OH-→ClO- + Cl一+H2O
(2分)
(4)
| 红(1分) | |
| 氯气与水反应生成的HClO将石蕊氧化为无色物质(1分) | |
| 黄绿(1分) | 继续通入的氯气溶于水使溶液呈黄绿色(1分) |
22. (12分)(1)天平(1分)、烧杯(1分)、200mL容量瓶(1分)、胶头滴管(1分);搅拌和引流(1分)。
(2)5SO2 + 2MnO4-
+ 2H2O →5SO42-+
2Mn2+ + 4H+ (2分)(3)![]() (2分)
(2分)
(4)防止可吸入颗粒堵塞导气管或进入酸性高锰酸钾溶液中,使测量质量不准(1分)
吸收前后颗粒吸附剂、棉花、盛放容器的总质量(1分)。(或将装置用编号表示回答,或答颗粒吸附剂、棉花、盛放容器的总质量的增加值)
(5)通入气流速率过快,二氧化硫未和酸性高锰酸钾溶液充分反应就已经被排出(1分)