高三化学平衡图象及平衡常数同步测练(第四周)
一、填空题
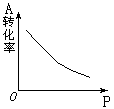 1.密闭容器中mA(g)+nB(g)
1.密闭容器中mA(g)+nB(g)![]() pC(g),反应达到平衡,经测定增大压强P时,A的转化率随P而变化的曲线如右图。则:
pC(g),反应达到平衡,经测定增大压强P时,A的转化率随P而变化的曲线如右图。则:
(1)增大压强,A的转化率__ __,平衡向__ __移动,达到平衡后,混合物中C的质量分数______。上述化学方程式中的系数m、n、p的正确关系是__ __。
(2)当降低温度时,C的质量分数增大,则A的转化率___ _,正反应是__ 热反应。
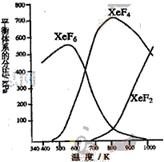 2(05广东高考)在密闭容器中,有一定起始浓度的氙(Xe)和F2反应,可得到三种氟化物。各种生成物在平衡体系内的分压与反应温度的关系如右图所示(已知气体的分压之比等于物质的量之比)。
2(05广东高考)在密闭容器中,有一定起始浓度的氙(Xe)和F2反应,可得到三种氟化物。各种生成物在平衡体系内的分压与反应温度的关系如右图所示(已知气体的分压之比等于物质的量之比)。
(1)420K时,发生反应的化学方程式为:
________________________________________ ,
若反应中消耗1mol Xe,则转移电子__ ____mol。
(2)600~800K时,会发生反应:
XeF6(g)![]() XeF4(g)+F2(g),其反应热
XeF4(g)+F2(g),其反应热
△H________0(填“>”、“=”或“<”),
理由是_____________________ 。
(3)900K时,容器中存在的组分有__________ _______。
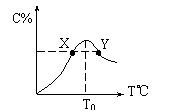 3.将物质的量均为3.00mol物质A、B混合于5L溶器中,发生如下反应 3A+B
3.将物质的量均为3.00mol物质A、B混合于5L溶器中,发生如下反应 3A+B![]() 2C,在反应过程中C的物质的量分数随温度变化如图所示:
2C,在反应过程中C的物质的量分数随温度变化如图所示:
(1)T0对应的反应速率V正和V逆的关系是____ _(用含“>”“<”“=”表示,下同);
(2)此反应的正反应为______热反应;
(3)X、Y两点A物质正反应速率的大小关系是______________;
(4)温度T<T0时,C%逐渐增大的原因是________________________;
(5)若Y点的C的物质的量分数为25%,则参加反应的A的物质的量为_______;若Y点时所耗时间为2min,则B物质的反应速率为__________。
4.已知NO2和N2O4可以相互转化:2NO2![]() N2O4(正反应为放热反应)。现将一定量NO2和N2O4的混合气体通入一体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。根据右图,回答下列问题:
N2O4(正反应为放热反应)。现将一定量NO2和N2O4的混合气体通入一体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。根据右图,回答下列问题:
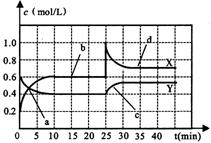 (1)图中共有两条曲线X和Y,其中曲线 表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是
。
(1)图中共有两条曲线X和Y,其中曲线 表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是
。
(2)前10min内用NO2表示的化学反应速率v(NO2)= mol/(L·min);反应进行至25min时,曲线发生变化的原是 。
(3)若要达到与最后相同的化学平衡状态,在25min时还可以采取的措施是 。
A.加入催化剂 B.缩小容器体积 C升高温度 D加入一定量的N2O4
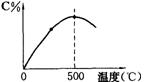 5.可逆反应A+3B
5.可逆反应A+3B![]() 2C,在反应过程中,C的百分含量C%与温度的关系如右图所示。
2C,在反应过程中,C的百分含量C%与温度的关系如右图所示。
(1)该反应是(吸热,放热) 反应;
(2)温度t<500℃时,C%逐渐增大的原因是 ;
(3)温度t>500 t时,C%逐渐减小的原是 。
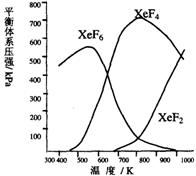 6.Xe和F2反应,可得三种氟化物,视反应条件而定。下图表述的是将0.125mol/L
Xe和1.225mol/L F2为始态得到的生成物在平衡体系内的分压与反应温度的关系。
6.Xe和F2反应,可得三种氟化物,视反应条件而定。下图表述的是将0.125mol/L
Xe和1.225mol/L F2为始态得到的生成物在平衡体系内的分压与反应温度的关系。
(1)应在什么温度下制备XeF2和XeF4?
(2)Xe和F2生成XeF6和XeF4,哪个反应放热更多?
生成 的反应放热更多。理由:
(3)为有效地制备XeF2,应在什么反应条件下为好?简述理由。
7.已知可逆反应CO+H2O(g)![]() CO2+H2,达到平衡时,K=
CO2+H2,达到平衡时,K=![]() ,K是常数,只与温度有关,与浓度无关。
,K是常数,只与温度有关,与浓度无关。
(1)830K时,若起始时:c(CO)=2mol/L,c(H2O)=3mol/L,平衡时CO的转化率为60%,水蒸气的转化率为 ;K值为 。
(2)830K,若只将起始时c(H2O)改为6mol/L,则水蒸气的转化率为 。
(3)若830K时,起始浓度c(CO)=a mol/L,c(H2O)=b mol/L,H2的平衡浓度c(H2)=c mol/L,
①a、b、c之间的关系式是 ;②当a=b时,a= c。
8.平衡常数(K)是衡量某可逆反应在一定条件下反应进行程度的数值。一定温度下,可逆反应达平衡时,生成物浓度的反应系数次幂的乘积与反应物浓度的反应系数次幂的乘积之比值,即平衡常数。以2A+3B![]() 3C+D为例,平衡常数的表达式为K={c(C)}3·{c(D)}/{c(A)}2·{c(B)}3。现往1L的容器中通入CO2、H2各2mol。在一定条件下让其发生反应:CO2+H2
3C+D为例,平衡常数的表达式为K={c(C)}3·{c(D)}/{c(A)}2·{c(B)}3。现往1L的容器中通入CO2、H2各2mol。在一定条件下让其发生反应:CO2+H2![]() CO+H2O,回答下列问题:
CO+H2O,回答下列问题:
(1)在830℃条件下,反应达到平衡时CO2的浓度为1mol/L。该条件下平衡常数K1 。
(2)在(1)基础上,把体系的温度降至800℃。已知该条件下的平衡常数K2=0.81,可以推知平衡时c(H2O)= (保留2位有效数字)。
(3)该可逆反应的正反应为 反应(填吸热或放热)。
(4)在(1)基础上,压缩容器体积至0.5L。该条件下的平衡常数为K3。则K3 K1(填“大于”“等于”“小于”)。理由是 。
9.在一定条件下,反应x
A+Yb![]() zC达到平衡:
zC达到平衡:
(1)若A、B、C均为气体,则该反应的平衡常数表达式为_______________________;
(2)若A、B、C均为气体,减压后平衡向逆反应方向移动,则x、y、z间的关系是___________;
(3)已知C是气体,且x+y=z,在增大压强时,若平衡发生移动,则一定向________(填“正”或“逆”)反应方向移动;
(4)已知B、C是气体,当其他条件不变时,增大A的物质的量,平衡不移动,则A为______态 (5)加热后C的质量分数减少,则正反应是________(填“放热”或“吸热”)反应。升高温度达到新的平衡后,该反应的平衡常数将变__________(填“大”或“小”)。
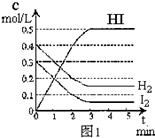
10.在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:
H2(g)+I2(g)![]() 2HI(g)+Q(Q>0)
2HI(g)+Q(Q>0)
反应中各物质的浓度随时间变化情况如图1:
(1)该反应的化学平衡常数表达式为 ;
(2)根据图1数据,反应开始至达到平衡时,平均速率v(HI)为 ;
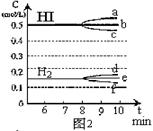
(3)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K(填写增大、减小或不变)HI浓度的变化正确 ;
(用图2中a~c的编号回答)
②若加入I2,H2浓度的变化正确的是 。(用图2中d~f的编号回答)
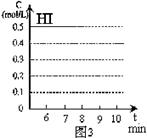
(4)反应达到平衡后,第8分钟时,若反容器的容积扩大一倍,请在图3中画出8分钟后HI浓度的变化情况。
11.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
(a)容器中压强不变 (b)混合气体中 c(CO)不变
(c)v正(H2)=v逆(H2O) (d)c(CO2)=c(CO)
 (4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
℃。
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
℃。
12.在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2(g)![]() 2SO3(g)(正反应放热)
2SO3(g)(正反应放热)
(1)写出该反应的化学平衡常数表达式K=
(2)降低温度,该反应K值 ,二氧化碳转化率 ,化学反应速度 (以上均填增大、减小或不变)
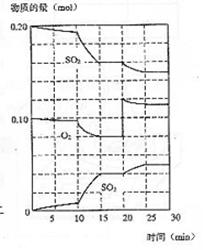
(3)600℃时,在一密闭容器中,将二氧化碳和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是 。
(4)据图判断,反应进行至20min时,曲线发生变化的原因是 (用文字表达);10min到15min的曲线变化的原因可能是 (填写编号)。
A 加了催化剂 B 缩小容器体积 C 降低温度 D 增加SO3的物质的量
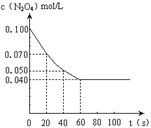
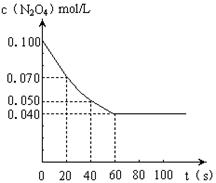 13.在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4
13.在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4![]() 2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
(1)计算在20至40秒时间内,NO2的平均生成速率
为 mol•L—1•S—1。
(2)该反应的化学平衡常数表达式为 。
(3)下表是不同温度下测定得到的该反应的化学平衡常数。
| T/ K | 323 | 373 |
| K值 | 0.022 | 0.36 |
据此可推测该反应(生成NO2)是 反应(选填“吸热”或“放热”)
(4)若其他条件不变,反应在423K时达到平衡,请在上图中找出相应的位置,添画出此温度下的反应进程曲线。
14.560℃时,在恒容闭容器中发生如下反应:C(s)+H2O(g)![]() CO(g)+H2(g)(正反应吸热)(1)请写出上述反应的平衡常数表达式
,若温度升高,则平衡常数_____(填“变大”、“变小”或“不变”)。
CO(g)+H2(g)(正反应吸热)(1)请写出上述反应的平衡常数表达式
,若温度升高,则平衡常数_____(填“变大”、“变小”或“不变”)。
(2)若560℃时,在恒容密闭容器中,若起始浓度[H2O]=0.03mol/L,当5秒钟时,测得
[H2O]=0.01mol/L,则前5秒钟H2的平均反应速率V(H2)=________________。
(3)能判断该反应是否达到化学平衡状态的依据是_____________。
A 容器中压强不变 B 混合气体中密度不变,C V正(H2)=V正(H2O) D c (CO)=c (H2)
(4)达到平衡后且恒容情况下,往容器中充入适量的H2S气体,重新达到平衡时,H2O的反应速率将______(填“增大”、“减小”或“不变”),理由是 。
15.烟草不完全燃烧时产生的一氧化碳被吸进肺里跟血液中的血红蛋白(用Hb表示)化合,发生下述反应:CO+Hb·O2![]() O2+Hb·CO,实验表明,Hb·CO的浓度即使只有Hb·O2浓度的2%,也足以使人智力受损。当空气中的CO浓度较大时,人体就感到缺氧,胸闷,此时血液中羰基血红蛋白达到10%,通常人肺的血液中O2的溶解浓度达1.6×10-6mol/L,而其中血红蛋白的浓度稳定在8×10-6mol/L。而当过多的血红蛋白与一氧化碳结合时,就会因窒息而引起死亡。上述反应K为K=[O2][Hb·CO]/[CO][Hb·O2],K只限温度有关,与浓度无关。
O2+Hb·CO,实验表明,Hb·CO的浓度即使只有Hb·O2浓度的2%,也足以使人智力受损。当空气中的CO浓度较大时,人体就感到缺氧,胸闷,此时血液中羰基血红蛋白达到10%,通常人肺的血液中O2的溶解浓度达1.6×10-6mol/L,而其中血红蛋白的浓度稳定在8×10-6mol/L。而当过多的血红蛋白与一氧化碳结合时,就会因窒息而引起死亡。上述反应K为K=[O2][Hb·CO]/[CO][Hb·O2],K只限温度有关,与浓度无关。
(1)血红蛋白的生理学功能为
(2)一氧化碳使人中毒的机理为
(3)Hb与CO通过什么化学键结合成HbCO分子的? ,并判断Hb·CO分子与Hb·O2分子的稳定性强弱
(4)抽烟后,吸入肺部的空气测得CO和O2的浓度分别为10-6mol/L和10-2mol/L。已知37℃时,平衡常数K=220,这时Hb·CO的浓度是Hb·O2浓度的多少倍?这时候是否达到损伤人的智力的程度?请通过计算回答。
(5)设血红蛋白与O2反应的速率常数k=2.1×106L/mol s(37℃),求氧血红蛋白(Hb·O2)的生成速率。
(6)在一氧化碳中毒的情况下,需要将Hb·O2的生成速率提高到1.1×10-4L/mol s。
①假设血液中的血红蛋白浓度是恒定的,计算所需的氧的浓度。
②假设血液中的氧浓度与进入肺的氧分压成正比。试问用怎样的方法来治疗一氧化碳中毒的患者是合乎逻辑的?运用你所学的关于气体定律的知识和勒沙特列原理,设想一种增强这种治疗效果的方法。
16.某城市的管道煤气是水煤气和焦炉煤气混合而成的,但煤气泄露能致人中毒。煤气中毒就是CO中毒,其原因是CO与血红蛋白(Hb)结合成Hb·CO,使血红蛋白失去输送O2功能的缘故。CO进入血液后有如下平衡:CO+Hb·O2![]() O2+Hb·CO,已知该反应平衡时,
O2+Hb·CO,已知该反应平衡时,![]() 的比值是一个不受浓度影响的常数,在人体体温37℃下,该常数为220。试回答:
的比值是一个不受浓度影响的常数,在人体体温37℃下,该常数为220。试回答:
(1)生产水煤气的化学反应方程式是
(2)燃气灶具因燃气成分、供气压力不同而结构不同。如果该城市管道气改通液化石油气(C4H10),则居民厨房中的炉灶改装时在燃气进口直径不变的情况下,通风口直径应怎样改 变? (增大or减小),原因是
(3)门窗紧闭的厨房内一旦发生煤气大量泄漏,极容易发生爆炸。当你从室外进入厨房嗅到极浓的煤气异味时,在下列操作中,你认为合适的是 (可以多选)
A 立即开启抽油烟机排出煤气,关闭煤气源
B 立即打开门和窗,关闭煤气源 C 立即打开电灯,寻找泄漏处
(4)煤气中毒病人,可以通过进入高压氧舱的方法来救治,请用化学平衡的原理加以说明:
(5)已知当血液中![]() 的比值大于0.02时,人的智力会受到损伤,此时c(CO)与c(O2)的比值应 (<、>or=)
。
的比值大于0.02时,人的智力会受到损伤,此时c(CO)与c(O2)的比值应 (<、>or=)
。
(6)抽烟时,进入肺部的空气中c(CO)=10-6mol/L,c(O2)=10-2mol/L,则c(Hb·CO)为c(H·O2)的 倍,因此长期抽烟对人智力 影响。(有or无)
17.Fe3+和I-在水溶液中的反应如下:2I-+2Fe3+![]() 2Fe2++I2
2Fe2++I2
(1)该反应的平衡常数K的表达式为:K= 。当上述反应达到平衡后,加入CCl4萃取I2,且温度不变,上述平衡向 移动。
(2)上述反应正向反应速度和I-、Fe3+的浓度关系为:v=![]() (k为常数)
(k为常数)
| CI-(mol/L) | Cfe3+(mol/L) | v(mol/Ls) | |
| (1) | 0.20 | 0.80 | 0.032 |
| (2) | 0.60 | 0.40 | 0.144 |
| (3) | 0.80 | 0.20 | 0.128 |
通过所给的数据计算得知:在v=![]() 中,m= 、n= 。
中,m= 、n= 。
18.平衡常数KC的数值大小,是衡量化学反应进行程度的标志。在25℃时,下列反应的平衡常数如下:
N2(g)+O2(g)=2NO(g) K1=1×10-30 2H2(g)+O2(g)=2H2O(g) K2=2×1081
2CO2 (g)=2CO(g)+O2(g) K3=4×10-92
(1)常温下,NO分解产生O2反应的平衡常数的表达式为K= 。
(2)常温下,水分解产生O2,此时平衡常数值约为K= 。
(3)常温下,NO,H2O,CO2三种化合物分解放出氧气的倾向大小顺序为 。
19(07广东高考)黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g)![]() 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母)
A 升高温度 B 降低温度 C 增大压强 D 减小压强 E 加入催化剂 G 移出氧气
(3)SO2尾气用饱和Na2SO3溶液吸收可得到更要的化工原料,反应的化学方程式为
。
(4)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其原因是 。
![]()
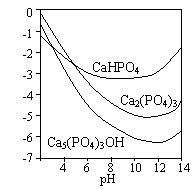 20(07广东高考)羟基磷灰石[Ca5(PO4)3OH]是一种一种重要的生物无机材料。其常用的制备方法有两种:
20(07广东高考)羟基磷灰石[Ca5(PO4)3OH]是一种一种重要的生物无机材料。其常用的制备方法有两种:
方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中。
方法B:剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中。
3种钙盐的溶解度随溶液pH的变化如上图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:
(1)完成方法A和方法B中制备Ca5(PO4)3OH的化学反应方程式:
①5Ca(NO3)2+3(NH4)2HPO4+4NH3·H2O=Ca5(PO4)3OH↓+ +
②5Ca(OH)2+3H3PO4=
(2)与方法A相比,方法B的优点是 。
(3)方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是
。
(4)图中所示3种钙盐在人体中最稳定的存在形式是 (填化学式)。
(5)糖沾附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿。结合化学平衡移动原理,分析其原因 。
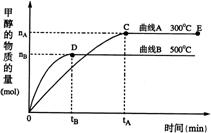 21(07上海高考)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)
21(07上海高考)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=
,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a 氢气的浓度减少 b 正反应速率加快,逆反应速率也加快
c 甲醇的物质的量增加 d 重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
同步测练—化学平衡(第四周)参考答案
1(1)减小 逆向 减小 p>m+ n (2)增大 放热
2(1)Xe+3F2=XeF6 6
(2)> 随着温度的升高,XeF6(g)=XeF4+F2平衡向右移动,根拒温度升高平衡向吸热反应方向移动的原理,则该反应的△H>0。
(3)XeF6、XeF4、XeF2
3(1)V正=V逆
(2)放 热反应;
(3)Y>X;
(4)反应未达到平衡,反应仍在向正反应方向进行,故C%的逐渐增大。
(5)1.8mol;0.06mol/L·min
4(1)X b和d (2)0.04 加入0.4molNO2 (3)BD
5 (1)放热 (2)平衡建立过程 (3)打破平衡,向逆方向移动
6(1)约550K 约850K
(2)XeF6 若Xe与F2生成XeF4的反应放热多,反应XeF4+F2=XeF6将是吸热反应,温度升高应有利于XeF6的生成,而由附图可见,事实恰恰相反。(或答:反应XeF6=XeF4+F2发生在相对高的温度下;或答:上述正向反应是体积增大的反应,所以正向反应是吸热的)
(4)在上图条件下必须在高温下才能制备XeF2, 但高温要求的技术问题太多,因而,应降低投料中F2/Xe的比值,可有效制备XeF2。
7(1)40% 1 (2)25% (3)①c2=(a-c)(b-c) ②a=2c
8(1)1
(2)0.95
(3)吸热
(4)等于 压强改变对该平衡不影响(或平衡常数只与温度有关)
9(1)K=[C]z/[A]x[B]y
(2)x+y>z
(3)逆
(4)固或液
(5)放热 小
[1]0
(1)K=![]()
(2)0.167mol/L·min
(3)①减小c ②f
(4)
11(1)![]() (2)吸热 (3)b、c (4)830
(2)吸热 (3)b、c (4)830
12(1)![]()
(2)增大 增大 减小
(3)15~20min和25~30 min
(4)增加了O2的量 a
b
13(1)0.002;
(2)c2 (NO2)/c(N2O4);
(3)吸热;
(4)423K的曲线在373K下方,达平衡时间在60s前
14(1)K=[CO][H2]/[H2O] 变大
(2)0.004mol/L·s
(3)A、B
(4)增大,该温度时,H2S分解产生H2增大H2浓度,可加快反应速度
[1]5
(1)血红蛋白是红细胞中的一种,能把肺部的氧气运送到全身细胞中的蛋白质
(2)一氧化碳与血红蛋白结合成一种配合物(Hb·CO)而导致的,这种配合物比氧气与血红蛋白形成的配合物结合力强100倍,这就使得细胞运送氧气的能力降低,使人中毒
(3)配位键 Hb·CO稳定性强
(4)0.022(>2%),已达到损伤智力的程度
(5)2.688×10-5mol/L s
(6)①6.55×10-6mol/L ②富氧呼吸 (略)
16(1)C+H2O![]() CO+H2
CO+H2
(2)增大 同体积液化气比水煤气燃烧耗氧多,故风门口径要增大。
(3)B
(4)在高压氧舱中,煤气中毒患者吸入氧气浓度较高的空气后,CO+Hb·O2![]() O2+Hb·CO,平衡向左移,使Hb·CO转化为Hb·O2,恢复血红蛋白的输氧功能。
O2+Hb·CO,平衡向左移,使Hb·CO转化为Hb·O2,恢复血红蛋白的输氧功能。
(5)因为![]() =220,是一个常数,当
=220,是一个常数,当![]() =0.02时,
=0.02时,![]() =
=![]() ÷220=
÷220=![]() =9.09×10-5,即小于该值时,人的智力还未受到损伤。
=9.09×10-5,即小于该值时,人的智力还未受到损伤。
(6)将c(CO)、C(O2)数位代入常数表示式:![]() =220 则
=220 则![]() =220×
=220×![]() =0.022(即0.022倍)。
=0.022(即0.022倍)。
(7)因为0.022>0.02,故从这一角度分析,长期抽烟,对人的智力有损伤作用。
[1]7 (1)K=[Fe2+]2/[I-]2[Fe3+]2 向右 (2)m=2 n=1 大于
[1]8
(1)K=![]() (2)5×10-82 (3)NO>H2O>CO2
(2)5×10-82 (3)NO>H2O>CO2
(4)NO、CO与O2反应进行的程度很大,使用合适的催化剂加快反应速率,在水蒸气存在下生成HNO3和CO2,则基本上可以除去污染气体。 或由第1,3个反应及平衡常数可知2CO+2NO=2CO2+N2的K=1/K1K2=2.5×10121,使用合适的催化剂加快反应速率,基本上可以除去污染气体。
[1]9
(1)1.6×103L/mol 80%(计算过程略) (2)B、C
(3)SO2+H2O+Na2SO3=2NaHSO3
(4)抑制Fe2+、Fe3+的水解,防止Fe2+被氧化成Fe3+
20 (1)①10NH4NO3
3H2O ②Ca5(PO4)3OH↓+9H2O
(2)唯一副产物为水,工艺简单
(3)反应液局部酸性过大,会有CaHPO4产生
(4)Ca5(PO4)3OH
(5)酸性物质使沉淀溶解平衡:Ca5(PO4)3OH(s)![]() 5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿
5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿
2[1]
(1)K=c(CH3OH)/c(CO)·c2(H2) 减小
(2)2nB/3tBmol·(L·min)-1 (3)b c
(4)Cu2O+CO![]() 2Cu+CO2
2Cu+CO2