高三化学科上学期测试试题
可能用到的相对原子质量:H-1 C-12 O-16 Mg-24 S-32 Fe-56 Cu-64 Na 23 Cl 35.5
第I卷(选择题 共70分)
一、选择题 (本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意。)
1.关于同温、同压下等体积的N2O和CO2的叙述:
①质量相同 ②碳原子数和氮原子数相等
③所含分子数相等 ④所含质子总数相等
A.①②③ B.②③④ C.①②④ D.①③④
2.阴离子Xn-含中子N个,X原子的质量数为A,则WgX元素的气态氢化物中含质子的物质的量是
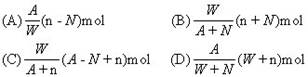
3.吸进人体内的O2,有2%转化为氧化性极强的活性氧副产物,如O等,这些活性氧能加速人体衰老,被称为“生命杀手”,中国科学家尝试用含硒化合物Na2SeO3清除人体内的活性氧,在消除活性氧时,Na2SeO3的作用是
A.还原剂 B.氧化剂 C.既是氧化剂又是还原剂 D.以上均不是
4.将淀粉碘化钾混合溶液装在羊皮纸制成的袋中,将此袋下半部浸泡在盛有蒸馏水的烧杯里,过一段时间后取烧杯中液体进行实验,下列现象不能证明羊皮纸袋一定破损的是
A.加入碘水变蓝色 B.加入淀粉变不蓝色
C.加入酸性H2O2溶液变蓝色 D.加入溴水变蓝色
5.下列反应的离子方程式书写正确的是
A.次氯酸钙溶液中通入过量的二氧化碳
Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
B.硫酸亚铁溶液中加过氧化氢溶液 Fe2++2H2O2+4H+=Fe3++4H2O
C.用氨水吸收少量二氧化硫 NH3·H2O+SO2=NH4++HSO3-
D.硝酸铁溶液中加过量氨水 Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+
6.设NA表示阿伏加德罗常数的数值,下列说法正确的是
A.由2H和18O所组成的水11g,其中所含的中子数为5NA
B.2.4g金属镁变为镁离子时失去的电子数为0.1NA
C.常温常压下,48gO2和O3混合气含有的氧原子数为3NA
D.在标准状况下,2.24L苯中含有0.6mol碳原子
7. 将标准状况下,将VL A气体(摩尔质量为Mg/mol)溶于0.1L水中,所得溶液密度为ρg/cm3,则此溶液的物质的量浓度(mol/L)为
A.![]() B.
B.![]()
C.![]() D.100VρM/(MV+2240)
D.100VρM/(MV+2240)
8.RO![]() +2Rx+6H+===3R+3H2O是某同学作业中的一个离子方程式,其中Rx所带电荷模糊不清,若R所带的电荷用x表示,则x应是
+2Rx+6H+===3R+3H2O是某同学作业中的一个离子方程式,其中Rx所带电荷模糊不清,若R所带的电荷用x表示,则x应是
A.“+” B.“2-” C.“3+” D.“4-”
9.已知:t℃时,某物质的不饱和溶液ag中含溶质mg。若该溶液蒸发bg水并恢复到t℃时,析出溶质m1g。若原溶液蒸发掉cg水并恢复到t℃时,则析出溶质m2g.用S表示该物质在t℃时的溶解度,下式中正确的是( )
A.S=100m/(a-m) B.S=100m2/c
C.S=100(m1-m2)/(b-c) D.S=100(m-m1)/(a-b
10.下列离子方程式书写正确的是
A.碳酸氢钙溶液中加入浓盐酸:CO32-+2H+=CO2↑+H2O
B.碳酸钠发生水解:CO32—+2H2O ![]() H2CO3+2OH—
H2CO3+2OH—
C.苯酚钠溶于醋酸溶液:C6H5O¯+CH3COOH=C6H5OH+CH3COO¯
D.FeI2溶液中通入少量氯气:2Fe2++Cl2=2Fe3++2Cl¯
二、多选题 (本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且正确的给4分,但只要选错一个,该小题为0分。)
11.由CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同。则该混合气体中CO2、H2和CO的体积比为
A.29∶8∶13 B.22∶1∶14 C.13∶8∶29 D.26∶16∶57
12.已知某盐在不同温度下的溶解度(见下表):
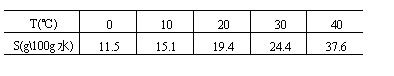
若把质量分数为 22%的该盐溶液由60℃逐渐冷却,则开始析出晶体的温度应在
A.0℃~10℃ B.10℃~20℃ C.20℃~30℃ D.30℃~40℃
13.在20℃时,将一种可溶性盐与一种不溶物组成的固体混合物30g投入40g水中,充分搅拌溶解、过滤,尚余固体15.6g。此15.6g固体再加入40g水中充分搅拌溶解、过滤,还剩下5g,则该可溶性盐在20℃时的溶解度为
A.26.5g B.31.25g C.36.0g D.无法计算
14.在同温、同压下,相同物质的量的氢气和氦气,具有相同的
A.原子数 B.质子数 C.体积 D.质量
15.0.2L 1mol·L-1的KCl溶液和0.5L 1mol·L-1的FeCl3溶液中,Cl-的浓度的比是
A.1∶3 B.3∶1 C.1∶1 D.2∶15
16.已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断正确的是
A.上述实验证明氧化性:MnO4—>Cl2>Fe3+>I2
B.上述实验中,共有两个氧化还原反应
C.实验①生成的气体能使湿润的淀粉KI试纸变蓝
D.实验②证明Fe2+既有氧化性又有还原性
17.某无色溶液中加入铝片有氢气产生,则在该溶液中一定大量共存有的离子组是
A.Cl-、NO3-、Ba2+、Na+ B.SO42-、CH3COO-、Al3+、Mg2+
C.Na+、K+、SO42-、Cl- D.Na+、Ba2+、Cl-、HCO3-
18.用0.1mol/LNa2SO3溶液30mL,恰好将2×10-3molXO4-离子还原,则元素X在还原产物中的化合价是
A.+1 B.+2 C.+3 D.+4
19.设NA表示阿伏加德罗常数。在下面的反应中,
4(NH4)2SO4![]() N2+6NH3+3SO2+SO3+7H2O
N2+6NH3+3SO2+SO3+7H2O
若有NA个电子发生转移时,以下各种说法中错误的是
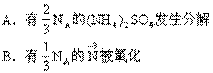
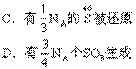
20.在pH=0的溶液中,下列各组离子因发生氧化还原反应而不能大量存在的是
A.Ag+、Ca2+、Cl-、CO32- B.Cl-、SO42-、K+、Na+
C.Fe2+、Na+、NO3-、K+ D.I-、K+、MnO4-、SO42-
金山中学化学科测试
座号 姓名 班级
第II卷(非选择题 共80分)
三、实验题(共题包括3小题。)
21.(8分)实验室可用Na2CO3制备Na2SO3晶体,有关装置如下图。
①将17gNa2CO3溶于80mL水中,装在B中的广口瓶中;
②再将25g铜屑放入圆底烧瓶中,用60mL浓H2SO4和10mL水的混合液装在分液漏斗中。逐滴加入硫酸后,加热使SO2逐渐产生。将SO2通入Na2CO3溶液中至饱和。
③通气结束后,慢慢向B中加入17g Na2CO3,充分拌搅。
④蒸发浓缩,冷却结晶,过滤,得到亚硫酸钠晶体。(2分)
回答下列问题:
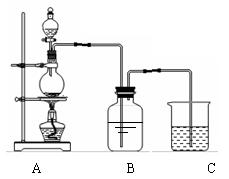
(1)A中反应的化学方程式为 。
(2)步骤②中B中所发生反应的离子方程式是_______。
(3)通入气体结束后,再加入Na2CO3,有关的离子方程式为___________________。
(4)C为尾气吸收装置,与该装置的使用目的有关的离子方程式
。
22.(10分)要配制200mL1.50mol·L-1的稀硫酸,根据下列题意填空:
(1)若使用98%(ρ=1.84g·cm-3)的浓硫酸时,所需浓硫酸的体积为________。
(2)精确量取所需的浓硫酸,应选用的仪器是___________,使用该仪器的准备工作有①_______________________________________________________;
②_______________________________________________________;
③_______________________________________________________;
④_______________________________________________________。
(3)下面是某学生配制稀硫酸的操作过程,其中错误的操作有_____________。
A.用50mL的量筒量取本实验所需的VmL浓硫酸
B.稀释浓硫酸
C.将稀释后的硫酸立即倒入容量瓶里
D.定容时用胶头滴管加水至刻度线,使溶液的凹液面与刻度线相切
E.将刚制好的稀硫酸倒入刚洗净的试剂瓶中
F.在试剂瓶上贴上标签
23.(8分)已知在过量FeSO4溶液中滴入几滴NaClO溶液,并加入适量硫酸,溶液立即变黄。(1)甲同学推测该反应的还原产物有两种可能,①Cl2、②Cl-。
乙同学结合甲的推测,认为其中一种可能可以排除,你认为可以排除的是哪种可能,并用简要的文字和离子方程式说明理由
。上述反应的离子方程式为 。
(2)为检验上述反应中的还原产物,请选择所需实验步骤,并按先后次序排列:
。
A.取一支试管,加入上述反应后的溶液少许
B.再加入过量Ba(NO3)2溶液,出现白色沉淀。
C.再加入过量BaCl2溶液,出现白色沉淀。
D.过滤;取滤液加入的硝酸酸化的AgNO3溶液出现白色沉淀。
E.加入的硝酸酸化的AgNO3溶液出现白色沉淀。
G.加入的盐酸酸化的AgNO3溶液出现白色沉淀。
四、(本题包括6题)
24.(7分)某待测液含有Fe2+、Fe3+、Ag+、Al3+、Ba2+。现利用实验室常用的仪器如烧杯、过滤装置等,进行下述实验,实验中所加试剂均是过量的。
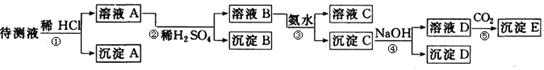
(1)写出实验步骤③④⑤中发生的反应的化学方程式,能写成离子方程式的写成离子方程式。
25.(10分)恐怖分子可能用剧毒的KCN污染水源,进行恐怖活动。为此某国环保部门准备了如下预案:受KCN污染的水源在TiO2的催化下,用NaClO将CN-氧化成 CNO-(价态C:+4;N:-3);CNO-在酸性条件下继续被NaClO氧化而生成N2和CO2。
(1)写出以上两个反应的离子方程式
;
。
(2)环保部门还可以根据以上反应,测定被污染的水源中CN-的浓度。测定在如图的装置中进行。
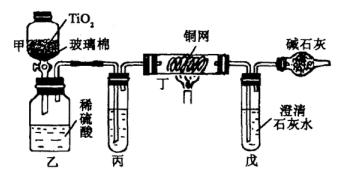
实验中将过量的NaClO溶液和200mL含CN-的样水倒入甲中。反应中会产生副反应:
ClO―+2H++Cl―=Cl2↑+H2O
因此反应中生成的N2和CO2中含有Cl2。
①丁的作用是 。实验后戊中生成0.8g沉淀,则原水样中 CN-的物质的量浓度为 。
26.(6分)已知NaCl晶胞的结构如图。
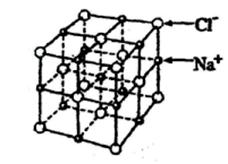
经X射线衍射测得晶体中Na+与Cl-平均距离为acm。利用上述信息和数据,有一简单可行的测定阿伏加德罗常数(NA)方法,具体步骤如下:
①将固体食盐研碎,干燥后,准确称取mgNaCl固体,并加入定容仪器A中。
②用滴定管向仪器A中加苯,并不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固的体积为VmL。回答下列问题:
(1)步骤①中A仪器最好用 (填仪器名称)。
(2)能否用胶头滴管代替步骤②中的滴定管? (填“能”或“不能”),原因是
。
(3)利用上述方法测得的阿伏加德罗常数表达式为NA= 。
27.(14分)在元素周期表中,锌(30Zn)、镉(48Cd)、汞(80Hg)同属于锌族,锌和汞在自然界中常共生,镉的金属活动性介于锌和汞之间,镉离子呈+2价。湿法炼锌过程中产生的铜镉渣中含有Cu、Cd、Zn等多种金属,可用于生产金属镉。镉的主要用途可以用作镍—镉电池。镉的生产流程如图示意如下:
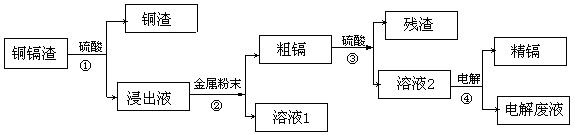
请回答下列问题:
(1)Zn元素的核外电子排布式为 ;它在周期表中的位置 。
(2)写出步骤①反应的离子方程式 。
(3)步骤②的反应的离子方程式是 。
(4)步骤④用“溶液2”作电解液,镉在 极析出,该电极材料是
(5)“电解废液”中含有镉,不能直接作为污水排放。目前含镉的废水处理的方式有两种,其中之一是在含镉污水中加入硫化钠,沉淀镉离子。写出硫化钠沉淀镉离子的离子方程式 。
28.(9分)t℃时,ag Na2SO4·10H2O晶体溶于水配成饱和溶液bg。 若溶液密度为dg•cm-3,
(1)t℃时,Na2SO4的溶解度是 。
(2)此饱和溶液的Na2SO4质量分数为 。
(3)此饱和溶液的物质的量浓度是 。
29.(8分)已知Fe2O3在高炉中有下列反应:
Fe2O3+CO=2FeO+CO2
反应形成的固体混合物(Fe2O3、FeO)中,元素铁和氧的质量比用m(Fe):m(O)表示。
(1)上述固体混合物中m(Fe):m(O)不可能是 (选填a、b、c多选扣分)
(a)21:9 (b)21:7.5 (c)21:6
(2)若m(Fe):m(O)=21:8,计算Fe2O3被CO还原的百分率A%= 。
(3)设Fe2O3被CO还原的百分率为A%,则A%和混合物中m(Fe):m(O)的关系式为(用含m(Fe)、m(O)的代数式表示) A%= 。
金山中学化学科测试
座号 姓名 班级
第一、二题答题栏
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
|
三、实验题(共题包括3小题。) 21.(8分) (1)A中反应的化学方程式为 ______ 。 (2)发生反应的离子方程式是_______________________________________________。 (3)有关的离子方程式为___________________________________________________。 (4)C中发生反应的离子方程式 ________ 。 22.(10分)(1)所需浓硫酸的体积为____________________。 (2)应选用的仪器是___________________,使用该仪器的准备工作有①_______________________________________________________________________; ②_______________________________________________________________________; ③_______________________________________________________________________; ④_______________________________________________________________________。 (3)其中错误的操作有_____________。 23.(8分)(1)可以排除的是哪种可能,并用简要的文字和离子方程式说明理由
。 上述反应的离子方程式为 。 (2)请选择所需实验步骤,并按先后次序排列: 。 四、(本题包括6题) 24.(7分) (1)③④⑤中发生的反应的化学方程式,能写成离子方程式的写成离子方程式。
25.(10分)(1)写出以上两个反应的离子方程式 ; 。 (2)①丁的作用是 。实验后戊中生成0.8g沉淀,则原水样中CN-的物质的量浓度为 。 26.(6分)(1)步骤①中A仪器最好用 (填仪器名称)。 (2)能否用胶头滴管代替步骤②中的滴定管? (填“能”或“不能”),原因是 。 (3)利用上述方法测得的阿伏加德罗常数表达式为NA= 。 27.(14分)(1)电子排布式为 ;位置 。 (2)写出步骤①反应的离子方程式 。 (3)步骤②的反应的离子方程式是 。 (4)步骤④用“溶液2”作电解液,镉在 极析出,该电极材料是 。 (5)硫化钠沉淀镉离子的离子方程式 。 28.(9分) (1)t℃时,Na2SO4的溶解度是 。 (2)此饱和溶液的Na2SO4质量分数为 。 (3)此饱和溶液的物质的量浓度是 。 29.(8分)(1)m(Fe):m(O)不可能是 (选填a、b、c多选扣分) (2)A%= 。(3)A%= 。 |
参考答案
一、选择题
1.D 2.C 3.A 4.B 5.D
6.C 7. B 8.B 9.C 10.C
二、多选题
11.CD 12.D 13.C 14.BC 15.A
16.AC 17.C 18.D 19.CD 20.CD
三、实验题(共题包括3小题。)
21.(8分)(1)Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O(2分)
CuSO4+SO2↑+2H2O(2分)
(2)2SO2+CO32-+H2O=2HSO3-+CO2↑ (2分)
(3) 2HSO3-+CO32―=2SO32―+CO2↑+H2O (2分)
(4) SO2+2OH―=SO32―+H2O (2分)
22.(10分)(1)16.3mL (2分)
(2)酸式滴定管。(2分)
①检查酸式滴定管的活塞是否漏水;
②用蒸馏水洗净滴定管;
③用待盛放的浓硫酸润洗滴定管2~3次;
④向滴定管里注入浓硫酸,使尖嘴部分充满溶液,并使液面位于“0”刻度或“0”刻度以下。(每空1分;共4分)
(5)A、C、E(2分)
23.(8分)
(1)可以排除①,因为FeSO4过量,反应中有剩余,而Cl2与Fe2+不能共存,因此还原产物不可能为Cl2。2Fe2++Cl2=2Cl-+2Fe3+ 。(4分)
2Fe2+ +ClO-+2H+=2Fe3++Cl-+H2O(2分)
(2) ABD(2分)
四、
24.(7分)H++NH3•H2O=NH4++H2O
Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+
Al3++3NH3•H2O=Al(OH)3↓+3NH4+
Fe2++2NH3•H2O=Fe(OH)2↓+2NH4+
4Fe(OH)2+4H2O+O2=4Fe(OH)3
Al(OH)3+OH―=AlO2―+2H2O
CO2+2H2O+AlO2―=Al(OH)3↓+HCO3―。
CO2+OH―=HCO3―
(各1分,共7分)
25. (10分)
(1)ClO-+CN-=CNO-+Cl― (2分)
3ClO-+2CNO-+2H+=N2↑+2CO2↑+H2O+3Cl― (2分)
(2)除去混合气体中的氯气(2分);0.04mol/L(4分)
26.(6分)(1)容量瓶(2分)
(2)不能(1分),无法测出加入苯的体积(1分)
(3)![]() (2分)
(2分)
27.(14分)
(1)核外电子排布式为 1s22s22p63s23p63d104s2 (2分);周期表中第 第四 周期,第 IIB 族。(各1分,共2分)
(2) Cd+2H+=Cd2++H2↑ Zn+2H+=Zn2++H2↑ 。(4分)
(3)步骤②的反应的离子方程式是 Zn+Cd2+=Zn2++Cd 。(2分)
(4)镉在 阴 极析出,该电极材料是 精镉 (2分)
(5)硫化钠沉淀镉离子的离子方程式 S2-+Cd2+ =CdS↓ 。(2分)
28.(9分)(1)![]() (2)(7100a/161b)%(3)
(2)(7100a/161b)%(3)![]()
(1)(3)没有给出单位不给分。
29.(8分)(1)(2分);(2)(3分);(3)(3分)
