08届高三化学基本概念与理论专题月考试题
可能用到的原子量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5 K 39 Ca 40 Mn 55 Fe 56 Pt 195
第Ⅰ卷 选择题(共70分)
一.选择题(本题包括10小题,每小题3分,共30分。每小题只有1个选项符合题意)
1、下列物质属于非电解质的是( )
A.金属铝 B.硫酸钡 C.酒精 D.漂白粉
2、物质发生化学变化时:①电子总数 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量 ⑥物质的总能量,反应前后肯定不发生变化的是
A. ①③⑤ B. ①②⑤ C. ①⑤⑥ D. ①④⑤
3、正确掌握化学用语和化学基本概念是学好化学的基础。下列有关表述中正确的一组是
A.16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体
B.胆矾、油酯、苛性钾、氢硫酸、三氧化硫,按纯净物、混合物、强电解质、弱电解质、非电解质排列
C.Ca2+的结构示意图为 ,NH4Cl的电子式为
,NH4Cl的电子式为![]()
D.过氧乙酸(CH3COOOH)与羟基乙酸(HOCH2COOH)所含官能团相同;两者互为同分异构体
4、(2007年高考上海化学卷)下列过程或现象与盐类水解无关的是( )
(A)纯碱溶液去油污 (B)铁在潮湿的环境下生锈
(C)加热氯化铁溶液颜色变深 (D)浓硫化钠溶液有臭味
5、用右图表示的一些物质或概念间的从属关系中不正确的是
| X | Y | Z | |
| 例 | 氧化物 | 化合物 |
|
| A | 置换反应 | 氧化还原反应 | 化学反应 |
| B | 胶体 | 分散系 | 混合物 |
| C | 电解质 | 离子化合物 | 化合物 |
| D | 碱性氧化物 | 金属氧化物 | 氧化物 |
6、(2007年高考全国理综卷II)已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量
②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量,则下列叙述正确的是( )
(A)氢气和氯气反应生成氯化氢气体的热化学方程式是 H2(g)+Cl2(g) = 2HCl(g)
(B)氢气和氯气反应生成2 mol氯化氢气体,反应的DH = 183 kJ/mol
(C)氢气和氯气反应生成2 mol氯化氢气体,反应的DH =-183 kJ/mol
(D)氢气和氯气反应生成1 mol氯化氢气体,反应的DH =-183 kJ/mol
7、(2007年高考上海化学卷,NA)设NA为阿伏加德罗常数,下列叙述中正确的是( )
(A)常温下11.2 L的甲烷气体含有甲烷分子数为0.5NA个
(B)14 g乙烯和丙烯的混合物中总原子数为3NA个
(C)0.1 mol/L的氢氧化钠溶液中含钠离子数为0.1NA个
(D)5.6 g铁与足量的稀硫酸反应失去电子数为0.3NA个
8、(2007年高考理综天津卷)25 ℃时,水的电离达到平衡:H2O![]() H++OH-;DH>0,下列叙述正确的是( )
H++OH-;DH>0,下列叙述正确的是( )
(A)向水中加入稀氨水,平衡逆向移动,c(OH-)降低
(B)向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
(C)向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
(D)将水加热,KW增大,pH不变
9、(2007年高考江苏卷)下列离子方程式书写正确的是( )
(A)过量的SO2通入NaOH溶液中:SO2+2OH- = SO32 -+H2O
(B)Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I- = 2Fe2++I2
(C)NaNO2溶液中加入酸性KMnO4溶液:2MnO4- +5NO2- +6H+ = 2Mn2++5NO3- +3H2O
(D)NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3- +Ba2++2OH- = BaCO3↓+2H2O+CO32 -
10、(2007年高考海南化学卷,阿伏加德罗定律)下列叙述正确的是( )
(A)一定温度、压强下,气体体积由其分子的大小决定
(B)一定温度、压强下,气体体积由其物质的量的多少决定
(C)气体摩尔体积是指1 mol任何气体所占的体积为22.4 L
(D)不同的气体,若体积不等,则它们所含的分子数一定不等
二、选择题(本题包括10小题,每小题4分,共40分。每小题有个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只先一个且正确的得2分,选两个且都正确的得4分,但只要选错一个,该小题就为0分)
11、(2007年理综北京卷)在由水电离产生的H+浓度为1×10-13 mol/L的溶液中,一定能大量共存的离子组是( )
①K+、Cl-、NO3- 、S2-; ②K+、Fe2+、I-、SO42 -; ③Na+、Cl-、NO3- 、SO42 -
④Na+、Ca2+、Cl-、HCO3- ⑤K+、Ba2+、Cl-、NO3-
(A)①③ (B)③⑤ (C)③④ (D)②⑤
12、在密闭容器中通人一定量的HI气体,使其在一定条件下发生反应:
![]() 2HI H2+I2 (气) 。下列叙述中一定属于平衡状态的是
2HI H2+I2 (气) 。下列叙述中一定属于平衡状态的是
A.HI、H2、I2的浓度相等 B.混合气体的颜色不变化时
C.混合气体的总压不变时 D.v(HI):v(H2):v(I2)=2:1:1时
13、(2007年高考重庆卷)如图所示,下列叙述正确的是( )
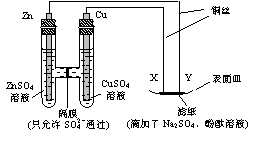 |
(A)Y为阴极,发生还原反应
(B)X为正极,发生氧化反应
(C)Y与滤纸接触处有氧气生成
(D)X与滤纸接触处变红
14(2007年高考上海化学卷)下列关于盐酸与醋酸两种稀溶液的说法正确的是( )
(A)相同浓度的两溶液中c(H+)相同 (B)pH=3的两溶液稀释100倍,pH都为5
(C)100 mL 0.1 mol/L的两溶液能中和等物质的量的氢氧化钠
(D)两溶液中分别加入少量对应的钠盐,c(H+)均明显减小
15、(2007年高考江苏卷,电解)某同学按图所示的装置进行电解实验。下列说法正确的是( )
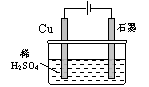 (A)电解过程中,铜电极上有H2产生
(A)电解过程中,铜电极上有H2产生
(B)电解初期,主反应方程式为:Cu+H2SO4![]() CuSO4+H2↑
CuSO4+H2↑
(C)电解一定时间后,石墨电极上有铜析出
(D)整个电解过程中,H+的浓度不断增大
16、平衡体系H2CO3![]() H++HCO3-和HCO3-
H++HCO3-和HCO3-![]() H++CO32-中,PH值增大时,[CO32-]将( )
H++CO32-中,PH值增大时,[CO32-]将( )
A.增大 B.减小 C.不变 D.可能增大也可能减小
17、(2007年理综北京卷)有①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液各25 mL,物质的量浓度均为0.1 mol/L,下列说法正确的是( )
(A)三种溶液pH的大小顺序是③>②>① (B)若将三种溶液稀释相同倍数,pH变化最大的是③
(C)若分别加入25 mL 0.1mol/L盐酸后,pH最大的是①
(D)若三种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
 18、(2005江苏卷)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为 3Zn + 2K2FeO4 + 8H2O
3Zn(OH)2 + 2Fe(OH)3 + 4KOH下列叙述不正确的是
18、(2005江苏卷)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为 3Zn + 2K2FeO4 + 8H2O
3Zn(OH)2 + 2Fe(OH)3 + 4KOH下列叙述不正确的是
A.放电时负极反应为:Zn—2e— +2OH—= Zn(OH)2
B.充电时阳极反应为:Fe(OH)3 —3e— + 5 OH— = FeO![]() + 4H2O
+ 4H2O
C.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
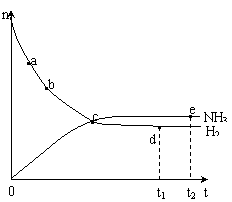 19、合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:
19、合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:
N2(g)+3H2(g)![]() 2NH3(g),673K,30MPa下n(NH3)和
2NH3(g),673K,30MPa下n(NH3)和
n(H2)随时间变化的关系如下图所示。下列叙述正确的是
A.点a的正反应速率比点b的大
B.点 c处反应达到平衡
C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大
20、(2007年高考江苏卷,电解质)下列溶液中各微粒的浓度关系不正确的是( )
(A)0.1 mol·L-1 HCOOH溶液中:c(HCOO-)+c(OH-) = c(H+)
(B)1 L 0.1 mol·L-1 CuSO4·(NH4)2SO4·6H2O的溶液中:c(SO42 -)>c(NH4+ ))>c(Cu2+)>c(H+)>c(OH-)
(C)0.1 mol·L-1 NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3) = c(HCO3- )+c(CO32 -)+c(OH-)
(D)等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
2008英德市二中化学基本概念与基本理论专题复习月考试题
班级 姓名 坐号 成绩
第Ⅱ卷 非选择题(共80分)
一、二选择题答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
三、(本题包括2小题,共22分)
21、(2007年高考上海化学卷,氧化还原反应)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3- +4H++3e- = NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:_______________________________________。
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2 mol气体,则转移电子的物质的量是 mol。
(4)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
。
22、(2007年高考上海化学卷,新课标-平衡常数)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
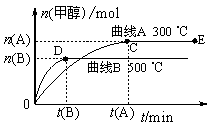
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500 ℃,从反应开始到平衡,氢气的平均反应速率v (H2)= 。
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是 。
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:_______________ ________________________(用化学方程式表示)。
四、(本题包括2小题,共22分)
23、(12分)酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:
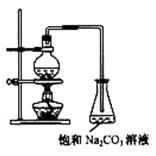 CH3COOH+C2H5OH
CH3COOH+C2H5OH ![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有 、
等。
(2) 若用右图所示装置来制备少量的乙酸乙酯,产率往往偏低,
其原因可能为 、
等。
(3)此反应以浓硫酸为催化剂,可能会造成 、 等问题。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)
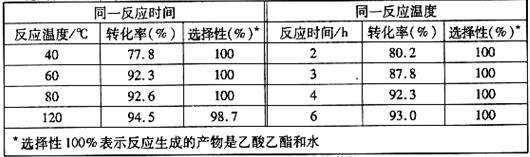
①根据表中数据,下列 (填字母)为该反应的最佳条件。
A.120℃,4h B.80℃,2h C.60℃,4h D.40℃,3h
② 当反应温度达到120℃时,反应选择性降低的原因可能为
。
24、(10分)某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向溶液中滴加稀硫酸至溶液pH=8~9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4:将得到的溶液范发浓缩、冷却、结晶、过滤、干燥。
请回答以下问题:
(1)上述实验中的过滤操作需要玻璃棒、 、 等玻璃仪器。
(2)步骤1过滤的目的是 。
(3)当步骤2中溶液的pH=8~9时,检验沉淀是否完全的方法是
。
(4)步骤2中溶液的pH较难控制,可改用 。
五、(本题包括2小题,28分)
25、(16分)(2007年高考理综宁夏卷)氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:□SiO2+□C+□N2![]() □Si3N4+□CO
□Si3N4+□CO
(1) 配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应中的氧化剂是________ __,其还原产物是______ _______。
(3)该反应的平衡常数表达式为K =______________ _________;
(4)将知上述反应为放热反应,则其反应热DH____ ____零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值_____ _ __(填“增大”、“减小”或“不变”);
(5)若使压强增大,则上述平衡向_____ __反应方向移动(填“正”或“逆”);
(6)若已知CO生成速率为v (CO) =18 mol/(L·min),则N2消耗速率为v (N2) =_ _ mol/(L·min)。
26、(12分)从有关资料中可查得,工业上为了处理含有Cr2O72-的酸性工业废水,采用下面的处理方法:往工业废水中加入适量的NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于排放标准。清回答下列问题。
①两极发生反应的电极反应式:阳极: ;
阴极: 。
②写出Cr2O72-变为Cr3+的离子方程式: 。
③工业废水由酸性变为碱性的原因是: 。
④能否改用石墨电极? 原因是:
。
六、(必做题。本题包括1小题,10分)
27、(10分)为测定某氧化物(化学式为MO)中M是何种金属,做下列实验:称取该氧化物8.0克,溶于适量的稀硫酸中,再配制成250毫升溶液。取该溶液50毫升,以铂电极进行电解,当刚好电解完全时,电极增重1.28克。试计算:
(1)M是 金属?
(2)电解过程中,导线上通过 摩电子?
(3)最初配制的溶液中,该金属离子物质的量浓度是 ;
(4)若电解液在电解后体积缩小为原体积的0.8倍,此溶液的[H+]是 。
(答案)
一、二选择题答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | B | B | B | C | C | B | B | C | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | B | A | C | BC | D | BC | C | AD | CD |
21、[答案](1)14HNO3+3Cu2O = 6Cu(NO3)2+2NO↑+7H2O。 (2)酸性; 氧化性。 (3)0.6 mol
(4)使用了较浓的硝酸,产物中有部分二氧化氮生成。
22、[答案](1)K=![]() ;
减小。 (2)
;
减小。 (2)![]() mol·(L·min)-1。 (3)b; c。
mol·(L·min)-1。 (3)b; c。
(4)Cu2O+CO![]() 2Cu+CO2。
2Cu+CO2。

24、(1)烧杯、漏斗 (2)除去铁等不溶于碱的杂质
(3)取上层清液,逐滴加入稀硫酸,若变浑浊则说明沉淀不完全,若不变浑浊则说明沉淀完全(4)通入足量的CO2气体
25、[答案](1)3,6,2,1,6 。 (2)N2; Si3N4。 (3)K =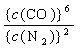 。 (4)小于;减小。 (5)逆。
(6) 6。
。 (4)小于;减小。 (5)逆。
(6) 6。
26.①阳极Fe-2e=Fe2+ 阴极2H++2e=H2↑
②Cr2O72-在H+存在的条件将Fe2+氧化为Fe3+ Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
③H+不断放电, Cr2O72-与Fe2+反应中消耗H+都导致水的电离平衡被坏,使[OH-]>[H+]
④不能,用石墨作电极,阳极将产生Cl2,得不到Fe2+,无还原剂,无法将Cr2O72-变为Cr(OH)3而除去。
27.(1)Cu (2)0.4摩 (3)0.4摩/升 (4)1摩/升
 纯净物
纯净物