08届高三理科化学九月考试题
化 学 试 题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分,考试用时100分钟。
相对原子质量:H—1,C—12,N—14,O—16,Na—23,P—31, S-32,Cl-35.5,K-39,
Ca-40, Fe—56, Cu-64
第Ⅰ卷(选择题,共48分)
一.单项选择题(本题有15小题,每小题2分,共30分。每小题只有一个选项符合题意)
1.2007年3月22日是第十五届“世界水日”。我国纪念“世界水日”和开展“中国水周”活动的宣传主题为“水利发展与和谐社会”。下列有关活动不符合这一主题的是
A.大力提倡全民节约用水,加强城市生活污水处理,坚持达标排放
B.大力推广使用纯净水代替自来水作生活用水,以保障用水安全
C.加快产业结构调整,建立水资源节约型、环保型的国民经济体系
D.加强工业用水净化系统工程的改造,提高水的重复利用率
2.正确掌握化学用语和化学基本概念是学好化学的基础。下列有关表述中正确的一组是
A.过氧乙酸(CH3COOOH)与羟基乙酸(HOCH2COOH)所含官能团相同;两者是同分异构体
B.16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体
C.P4、CH4、NH4+粒子的空间构型均为正四面体型;CO2、C2H2均为直线型分子
D.Ca2+的结构示意图为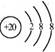 ,NH4Cl的电子式为
,NH4Cl的电子式为![]()
3.阿伏加德罗常数约为6.02×1023 mol-1,下列说法不正确的是
A.常温常压下,22g氧气和26g臭氧所含氧原子总数为3 NA
B.6.2g白磷P4中所含的P-P键的个数为0.3 NA
C.在标准状况下,V L CH2O中含有的氧原子个数为![]()
D.1L 0.5 mol/L CH3COONa溶液中含有的CH3COO-个数为0.5 NA
4.体积相同的某植物营养液两份,其配方如下,两份营养液中各离子浓度
| KCl | K2SO4 | ZnSO4 | ZnCl2 | |
| (1) | 0.3mol | 0.2mol | 0.1mol | |
| (2) | 0.1mol | 0.3mol | 0.1mol |
A.完全相同 B.完全不同 C.仅c(K+)相同 D.仅c(C1—)相同
 5.某分子式为C10H20O2的酯,在一定条件下可发生如下图的转化过程:
5.某分子式为C10H20O2的酯,在一定条件下可发生如下图的转化过程:
则符合上述条件的酯的结构有
A.2种 B.4种 C.6种 D.8种
6.X、Y、Z、W为四种短周期主族元素。其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法正确的是
A.X与W可以形成W2X、W2X2两种化合物
B.Y元素最高价氧化物对应水化物的化学式为H2YO4
C.原子序数由小到大的顺序为W<X<Y<Z
D.Y、Z两元素的简单离子的半径Y>Z
7.将溶质的质量分数为a%、物质的量浓度为C1 mol·L-1的H2SO4溶液蒸发掉一定量的水,使其溶质的质量分数变为2a%,此时物质的量浓度为C2 mol·L-1,则C1和C2的关系是
A. C2>2C1 B. C2=2C1
C. C2<2C1 D. C1=2C2
8.某一密闭容器中盛有饱和Ca(OH)2溶液,当加入少量CaO粉末,反应后恢复到原来温度,下列说法正确的是
①有晶体析出 ②c[Ca(OH)2]增大 ③pH不变 ④c(H+)c(OH-)的积不变 ⑤c(H+)一定增大
A. ①② B. ①③④ C. ①②④ D. ①③⑤
9.一定条件下,体积为10L的密闭容器中,1mol X和1mol Y进行反应:
2X(g)+Y(g)![]() Z(g),经60s达到平衡,生成0.3mol Z。下列说法正确的是
Z(g),经60s达到平衡,生成0.3mol Z。下列说法正确的是
A.若升高温度,X的体积分数增大,则该反应的△H>0
B.将容器体积变为20 L,Z的平衡浓度变为原来的![]()
C.以X浓度变化表示的反应速率为0.001mol/(L·S)
D.若增大压强,则物质Y的转化率减小
10.从海水中提取镁,可按如下步骤进行:
①把贝壳制成石灰乳; ②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物; ③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物; ④将得到的产物熔融电解得到镁。下列说法不正确的是
A.第④步电解时阴极产生氯气
B.①②③步骤的目的是从海水中提取MgCl2
C.以上提取镁的过程中涉及化合、分解和复分解反应
D.此法的优点之一是原料来源丰富
11、Na2FeO4是一种高效多功能水处理剂,应用前景广阔。一种制备Na2FeO4的方法可用化
学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
对此反应下列说法中不正确的是
A.Na2O2在反应中只作氧化剂
B.O2是氧化产物
C.Na2FeO4既是氧化产物又是还原产物
D.2mol FeSO4发生反应时,共有10mol电子转移
12.下列各溶液中,各离子组一定能大量共存的有
A.含有大量Ba2+的溶液中:HCO3-、Fe3+、Ag+、SO42-、SCN-
B.滴加无色酚酞试液后变红色的溶液中:Na+、CO32-、K+、ClO-、AlO2-
C.由水电离的c(OH-)=10-14mol·L-1 的溶液中:CH3COO-、C6H5O-、Na+、K+
D.加入铝粉后产生氢气的溶液中:NH4+、Na+、NO3-、Cl-、HS-
13.已知M2O7x-+3S2-+14H+=2M3++3S↓+7H2O,则M2O7x-中的M的化合价为
A.+2 B.+3 C.+4 D.+6
 14.最近意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构与P4相似,已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量。根据以上信息和数据,下列说法正确的是
14.最近意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构与P4相似,已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量。根据以上信息和数据,下列说法正确的是
A.N4属于一种新型的化合物 B.N4沸点比P4(白磷)高
C.N4与N2互为同素异形体 D.1mol N4气体转变为N2将吸收882kJ热量
15.在100 mL某混合溶液中,C(HNO3)=0.4mol/L,C(H2SO4)=0.1mol/L。向其中加入1.92g铜粉,微热,充分反应后溶液中C(Cu2+)为(假设溶液体积不变)
A、0.15 mol/L B、0.3 mol/L C、0.225 mol/L D、无法计算
二.不定项选择题(本题包括6小题,每小题3分,共18分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
16.下列各组中,两种气体的分子一定相等的
A.温度相同,体积相同的O2和N2 B.压强相同,体积相同的O2和N2
C.体积相等,密度相等的CO和C2H4 D.质量相等,密度不等的C2H4和N2
17.某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)
| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
| m(混合物) | 9.2 g | 15.7 g | 27.6 g |
| V(CO2)(标况) | 2.24 L | 3.36 L | 3.36 L |
则下列分析推理中不正确的是
A.盐酸的物质的量浓度为3.0 mol·L—1
B.根据表中数据不能计算出混合物中NaHCO3的质量分数
C.加入混合物9.2 g时盐酸过量
D.15.7 g混合物恰好与盐酸完全反应
18.下列离子方程式书写正确的是
A.用大理石与盐酸制取CO2:CO32-+2H+ H2O+CO2↑
B.苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-
C.澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2HCO3- CaCO3↓+CO32-+2H2O
D.硝酸亚铁溶液中滴加盐酸:3Fe2++4H++NO3- 3Fe3++2H2O+NO↑
19.草酸是二元中强酸,草酸氢钠溶液显碱性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A.V(NaOH)=0时,c(H+)=1×10-2 mol/L
B.V(NaOH)<10 mL时,不可能存在c(Na+)=![]()
C.V(NaOH)=10 mL时,c(H+)=1×10-7 mol/L
D.V(NaOH)>10 mL时, ![]()
20.含11.2gKOH的稀溶液与1L0.12mol/L的H2SO4 溶液反应放出11.46kJ的热量。该反应的热化学方程式是
A.KOH(aq)+1/2H2SO4 (aq)=1/2K2SO4(aq)+H2O (1) △H= 一11.46kJ/mol
B.2KOH(aq)+H2SO4 (aq)=K2SO4(aq)+2H2O (g) △H= 一114.6kJ/mol
C.2KOH(aq)+H2SO4 (aq) =K2SO4(aq)+2H2O (1) △H= 一114.6kJ/mol
D.KOH(aq)+1/2H2SO4 (aq)=1/2K2SO4(aq)+H2O (1) △H= 一57.3kJ/mol
21.为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性。
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加Ag NO3溶液,产生白色沉淀。
根据实验以下推测正确的是
A.一定有SO32-离子 B.一定有CO32-离子
C.不能确定C1—离子是否存在 D.不能确定HCO3-离子是否存在
 08届高三理科九月考
08届高三理科九月考
化 学 试 题
第Ⅰ卷(选择题,共48分)答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 选项 |
|
|
|
|
|
|
|
|
|
|
|
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 |
|
| 选项 |
|
|
|
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题,共52分)
三.(本题包括1小题,12分)
22.(12分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:
NH3+CO2+H2O NH4HCO3 ;
NH4HCO3+NaCl
NaHCO3↓+NH4Cl ;
![]() 2NaHCO3 Na2CO3+CO2↑+H2O
2NaHCO3 Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号)。
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
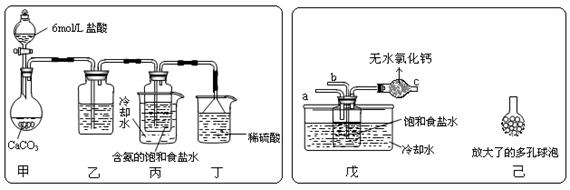
试回答下列有关问题:
![]() (Ⅰ)乙装置中的试剂是 ;
(Ⅰ)乙装置中的试剂是 ;
(Ⅱ)丁装置中稀硫酸的作用是 ;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。
② 另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从 管通入 气体,再从 管中通入 气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是 ;
(3)请你再写出一种实验室制取少量碳酸氢钠的方法: 。
四.(本题包括5小题,40分)
23.(10分)根据下列框图关系填空,已知反应①、③是我国工业生产中的重要反应,X常温下为无色无味透明液体;C焰色反应火焰呈黄色,J为红褐色沉淀;D、E常温下为气体,且E能使品红溶液褪色;A是黄色固体且A仅含两种元素,其中金属元素的质量分数约为46.7%。
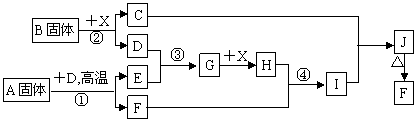 |
(1)G的化学式为 ;
(2)固体A中所包含的化学键与固体B类似,则A的电子式为 ;
(3)反应②的离子方程式: ;
(4)反应④的离子方程式: ;
(5)已知每生成16 g E,放出106.5 kJ热量,则反应①的热化学方程式为:
。
24.(6分)某无色溶液,由Na+、Ag+、Ba2+、Al3+、、、、中的若干种组成。取该溶液进行如下实验:
(A)取适量试液,加入过量盐酸,有气体生成,并得到溶液;
(B)在(A)所得溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;
(C)在(B)所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。
根据上述实验回答下列问题:
⑴ 溶液中一定不存在的离子是 。
⑵ 一定存在的离子是 。
⑶ 判断沉淀乙成份的方法是
。
25.(8分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3-+4H++3e→NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是: 。
26.(6分)一定量的氢气在氯气中燃烧,所得混合物用100mL 3.00mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。
(1)原NaOH溶液的质量分数为
(2)所得溶液中Cl-的物质的量为 mol
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)= 。
27.(10分)(1)苯氯乙酮是一具有荷花香味且有强催泪作用的化学试剂,它的结构简式如图所示:
![]() 则苯氯乙酮不可能具有的化学性质是 (填字母序号)。
则苯氯乙酮不可能具有的化学性质是 (填字母序号)。
a.加成反应 b.取代反应 c.消去反应
d.水解反应 e.银镜反应
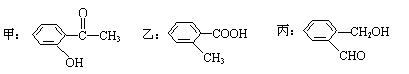
(2)今有化合物
①请写出丙中含氧官能团的名称: ;
②请判别上述哪些化合物互为同分异构体: ;
③请按酸性由强至弱排列甲、乙、丙的顺序: ;
(3)由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。
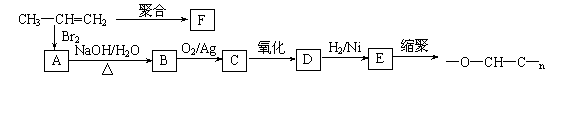
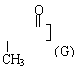 | |||
①丙烯分子中,最多有 个原子在同一个平面上;
②聚合物F的结构简式: ;
③B转化为C的化学方程式: ;
④在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物
的结构简式: 。
试题到此结束,请认真检查。
08届高三理科九月考
化 学 试 题 答 案
第Ⅰ卷(选择题,共48分)答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 选项 | B | C | D | A | B | A | A | B | C | A | A |
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 |
|
| 选项 | B | D | C | C | CD | BD | BD | BD | CD | BC |
|
第Ⅱ卷(非选择题,共52分)
三.(本题包括1小题,12分)
22.(12分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:
NH3+CO2+H2O NH4HCO3 ;
NH4HCO3+NaCl
NaHCO3↓+NH4Cl ;
![]() 2NaHCO3 Na2CO3+CO2↑+H2O
2NaHCO3 Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 C (1分)(填字母标号)。
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
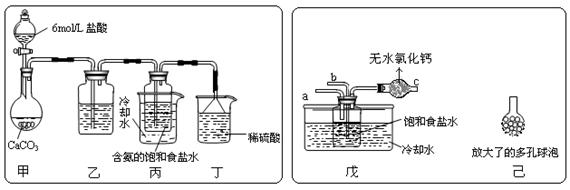
试回答下列有关问题:
![]() (Ⅰ)乙装置中的试剂是 NaHCO3溶液(1分) ;
(Ⅰ)乙装置中的试剂是 NaHCO3溶液(1分) ;
(Ⅱ)丁装置中稀硫酸的作用是 吸收挥发出来的氨气 (1分) ;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 过滤 (1分) (填分离操作的名称)。
② 另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从 a (1分) 管通入 NH3 (1分) 气体,再从 b (1分) 管中通入CO2 (1分) 气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是 增大气体与溶液的接触面积,使 CO2与NH3 充分反应生成NH4HCO3 (2分) ;
(3)请你再写出一种实验室制取少量碳酸氢钠的方法: 向 NaOH 溶液中通入过量的 CO2 (其它合理答案也得分) (2分) 。
四.(本题包括5小题,40分)
23.(10分)根据下列框图关系填空,已知反应①、③是我国工业生产中的重要反应,X常温下为无色无味透明液体;C焰色反应火焰呈黄色,J为红褐色沉淀;D、E常温下为气体,且E能使品红溶液褪色;A是黄色固体且A仅含两种元素,其中金属元素的质量分数约为46.7%。
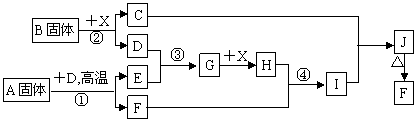 |
(1)G的化学式为 SO3 (1分) ;
.. ..
(2)固体A中所包含的化学键与固体B类似,则A的电子式为 Fe2+[:S :S:]2- (2分) ;
.. ..
(3)反应②的离子方程式: 2Na2O2 + 2H2O == 4Na+ + 4OH- + O2↑ (2分)
(4)反应④的离子方程式: Fe2O3 + 6H+ == 2Fe3+ + 3H2O (2分) ;
(5)已知每生成16 g E,放出106.5 kJ热量,则反应①的热化学方程式为:
4FeS2(s) + 11O2(g) == 2Fe2O3(s) + 8SO2(g) ΔH=_-3408KJ/mol (3分) 。
24.(6分)某无色溶液,由Na+、Ag+、Ba2+、Al3+、、、、中的若干种组成。取该溶液进行如下实验:
(A)取适量试液,加入过量盐酸,有气体生成,并得到溶液;
(B)在(A)所得溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;
(C)在(B)所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。
根据上述实验回答下列问题:
⑴ 溶液中一定不存在的离子是 Ag+、Ba2+、Al3+ MnO4- (2分) 。
⑵ 一定存在的离子是 Na+ AlO2- CO32- (2分) 。
⑶ 判断沉淀乙成份的方法是 向沉淀乙中加入足量稀HCl(HNO3)沉淀完全溶解,则乙为BaCO3 ,不能完全溶解则为BaCO3 BaSO4的混合物 (2分) .
25.(8分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3-+4H++3e→NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:3Cu2O + 14HNO3 = 6Cu(NO3)2 + 2NO + 7H2O (2分)
(2)反应中硝酸体现了 酸性(1分) 、 强氧化性 (1分) 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 0.6 (2分) mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:还原产物中有NO2 (2分) 。
26.(6分)一定量的氢气在氯气中燃烧,所得混合物用100mL 3.00mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。
(1)原NaOH溶液的质量分数为 10.7% (2分)
(2)所得溶液中Cl-的物质的量为 0.25 (2分) mol
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)= 3:2 (2分) 。
27.(10分)(1)苯氯乙酮是一具有荷花香味且有强催泪作用的化学试剂,它的结构简式如图所示:
![]() 则苯氯乙酮不可能具有的化学性质是 c e (1分) (填字母序号)。
则苯氯乙酮不可能具有的化学性质是 c e (1分) (填字母序号)。
a.加成反应 b.取代反应 c.消去反应
d.水解反应 e.银镜反应

(2)今有化合物
①请写出丙中含氧官能团的名称: 羟基、醛基 (1分) ;
②请判别上述哪些化合物互为同分异构体: 甲、乙、丙 (1分) ;
③请按酸性由强至弱排列甲、乙、丙的顺序: 乙甲丙 (1分) ;
(3)由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。
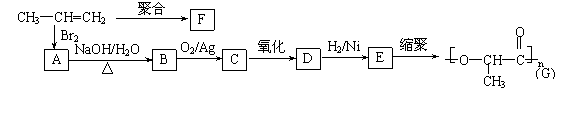 |
①丙烯分子中,最多有 7 (2分) 个原子在同一个平面上;
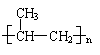 |
②聚合物F的结构简式: ;
③B转化为C的化学方程式:(2分)
![]()
![]()
CH3 CH3
 ④在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物
④在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物
的结构简式: (1分)