08年高考化学复习4月随堂考试 (5)
6.右图中的两条曲线分别代表的是:1gC3H6和1gM气体在相同体积的容器中,测得容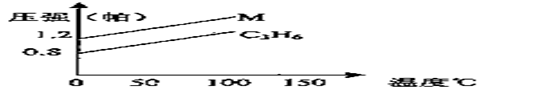 器中的压强和温度的关系,试根据图形判
器中的压强和温度的关系,试根据图形判
|
A.C3H8 B.C2H4 C.H2S D.N2O4
7.下列化学用语表示正确的是
![]() A.HS—离子的水解离子方程式:HS—+H2O H2O++S2—
A.HS—离子的水解离子方程式:HS—+H2O H2O++S2—
![]() B.Na2S的水解离子方程式:S2++2H2O H2S+2OH—
B.Na2S的水解离子方程式:S2++2H2O H2S+2OH—
C.软脂酸的结构简式:C15H31COOH
D.S2—的结构示意图![]()
![]() 8.下列事实不能用勒沙特列原理解释的是①氯化铁溶液加热蒸干最终得不到氯化铁固体;②铁在潮湿的空气中容易生锈;③实验室可用排饱和食盐水的方法收集氯气;④常温下,将1mL
pH=3的醋酸溶液加水稀释至100mL,测得其pH<5;⑤钠与氯化钾共融制备钾Na(1)+KC1(1) K(g)+NaC1(1);⑥二氧化氮与四氧化氮的平衡体系,加压后颜色加深
8.下列事实不能用勒沙特列原理解释的是①氯化铁溶液加热蒸干最终得不到氯化铁固体;②铁在潮湿的空气中容易生锈;③实验室可用排饱和食盐水的方法收集氯气;④常温下,将1mL
pH=3的醋酸溶液加水稀释至100mL,测得其pH<5;⑤钠与氯化钾共融制备钾Na(1)+KC1(1) K(g)+NaC1(1);⑥二氧化氮与四氧化氮的平衡体系,加压后颜色加深
A.①②③ B.只有②⑥ C.③④⑤ D.②⑤⑥
9.设NA代表阿伏加德罗常数,下列说法正确的是 ( )
|
B.常温下含有NA个NO2、N2O4分子的混合气体,温度降至标准状况,其体积约为22.4L
C.在标准状况下,各为1mol的二氧化硫和三氧化硫的体积均为22.4L
D.含有4NA个Si – O键的石英晶体中,有2NA个氧原子
10.食品安全已是百姓最关心的问题之一,食品在油炸过程中会产生一种不利人体健康的物质CH2=CH-CO-NH2(丙烯酰胺),对这种物质的叙述不正确的是
A.能发生加聚反应生成高分子化合物 B.该物质与HCl加成产物只一种
C.具有多种同分异构体 D.可与强酸反应
![]() 11. 可逆反应:I2(g)+H2(g) 2HI(g)在一定条件下已达到化学平衡状态。由于改变一个条件,达到新平衡时,可能引起下列变化,这些变化中能说明平衡一定向正反应方向移动的是:①I2(g)浓度减小;②混合气体颜色加深;③I2(g)转化率增大;④HI(g)的含量增大;⑤正反应速率增大
11. 可逆反应:I2(g)+H2(g) 2HI(g)在一定条件下已达到化学平衡状态。由于改变一个条件,达到新平衡时,可能引起下列变化,这些变化中能说明平衡一定向正反应方向移动的是:①I2(g)浓度减小;②混合气体颜色加深;③I2(g)转化率增大;④HI(g)的含量增大;⑤正反应速率增大
A.③④ B.①②⑤ C.②③④ D.①③⑤
12.有M、N两溶液,各含下列14种离子中的7种:H+、NH+4、Al3+、Fe3+、Na+、K+、NO-3、Cl-、OH-、S2-、MnO-4、AlO-2、CO2-3、SO2-4。已知两溶液所含离子各不相同,M溶液里的阳离子只有两种,则N溶液里的阴离子应该是
A.OH-、S2-、CO2-3 B.MnO-4、SO2-4、NO-3
C.Cl-、NO-3、SO2-4 D.AlO-2、MnO-4、SO2-4
13. 某溶液中只可能含有下列离子中的几种(不考虑溶液中 含的较少的H+和OH-)Na+、NH4+、SO42-、CO32-、NO3-。取200mL该溶液,分为等体积的二等份做下列实验。实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL。实验2:第二份先加入足量的盐酸,无现象,再加足量的BaCl2溶液,得固体2.33克。下列说法正确的是
A.该溶液中可能含有Na+ B.该溶液中肯定含有NH4+、SO42-、CO32-、NO3-
C.该溶液中一定不含NO3- D.该溶液中一定含Na+,且c(Na+)≥0.1 mol/L
26.(12分)由新型无机非金属材料制成的无水冷发动机,热效率高、寿命长。这类材料中研究较多的是化合物G。
(1)化合物G的相对分子质量为140,G中含硅元素,其质量分数为60%,另有元素Y。G可以由化合物E(含两种元素)与NH3反应而生成,同时产生HCl气体。请推断:G和E的化学式分别为 、 。
(2)粉末状G能够与氧气反应,所得产物中有一种是空气中的主要成分,另一种是工业上生产玻璃的主要原料。请写出化合物G与氧气反应的化学方程式 。
(3)常压下在G中添加氧化铝,经高温烧结可制制成一种高强度、超硬义、耐磨损、抗腐蚀的陶瓷材料,它的商品名叫“赛伦”,化学通式可表示为Si6-XAlXOXY8-X。在接近1700℃时x的极限值约为4.0,在1400℃时x为2.0,以保持整个化合物呈电中性。推测:赛伦中以下元素的化合价:Si Y ,塞伦的晶体类型 。
27.(16分)X、Y、Z为三个不同短周期非金属元素的单质。在一定条件下有如下反应:Y+X→A(气体), Y+Z→B(气体)。请针对以下两种不同情况回答:
(1)若常温下X、Y、Z、均为气体,A和B化合时有白烟产生,且A是某些豆科植物自然固氮的产物,则:
①A分子的空间构型为 ;工业上合成A的条件是 。
②A与氧气反应生成C和D,是化工生产上的重要反应,写出该反应的化学方程式
,C是大气污染物,将C与A混合,在一定条件下可转化为无毒的X和D,该反应中氧化产物与还原产物的质量之比为 。
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
①B的化学式是 ;
②向苛性钠溶液中通入过量的A,所发生反应的离子方程式是
;
③将Y与(1)中Z单质的水溶液充分反应可生成两种强酸,该反应的化学方程式是 。
28. (16分)现有物质B-I的转化关系如下图:
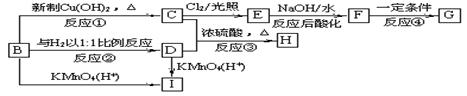 |
若B的分子式为C8H8O,其苯环上的一元取代物只有两种;G为高分子化合物。请回答下列问题:
(1)反应②的反应类型是 。
(2)写出有关物质的结构简式:F ,I 。
(3)写出下列反应的化学方程式:
B→C ;
C+D→H 。
(4)C的同素分异构体且属于酯类的芳香族化合物共有6种,以下已有三种,请写出另三种同分异构体的结构简式:
![]() 、
;
、
;
 29.(16分)将KOH和Ca(OH)2的混合物1.3g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体。
29.(16分)将KOH和Ca(OH)2的混合物1.3g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体。
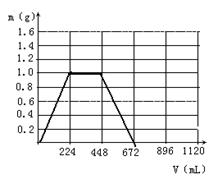
(1)当生成沉淀的质量刚好最大时,消耗CO2
的体积为224mL。
① 在图示坐标系中,画出生成沉淀的质量m(g)
与通入CO2的体积V(mL)的关系图象。
②图示坐标系中,生成沉淀的最大质量
是 ,沉淀
恰好全部溶解时消耗CO2体积为 mL。
③原混合物中KOH的质量为 g。
(2)若KOH和Ca(OH)2以任意比例混合,总质量仍然保持1.3g不变,则消耗CO2总体积V的取值范围为(取整数) 。
附加题
![]() 1.合成氨的反应在一定条件下已达到平衡状态:N2+3H2 2NH3+Q。
1.合成氨的反应在一定条件下已达到平衡状态:N2+3H2 2NH3+Q。
(1)用氢气表示正反速率,氨气表示逆反应速率,两者的关系式为 。
|
(3)若增加氢气的浓度,氮气的转化率 ;
若将氨分离出来,平衡向 移动,
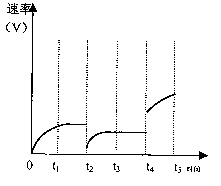
(4)请在右图定性表示H2的逆反应速率变化与时
间的关系图象,相应的变化特点为:t1达平衡、t2
降温、t3又达平衡、t4增压、t5再次达平衡。
|
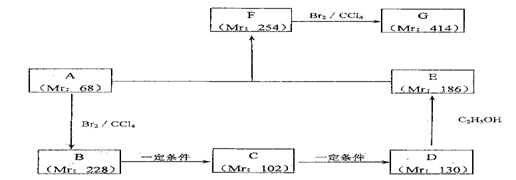
根据上图回答问题:
(1)D的化学名称 ;(2)反应③的化学方程式是 ;
(3)B的结构简式是 ,A的结构简式是 ,反应③的反应类型是 ;
(4)G是重要的工业原料,用化学方程式表示G的一种重要的工业用途 。
|
请利用已知反应方程式,回答下列问题:
(1)写出下列反应产物的结构简式:H2C=CH—CH=CH—CH3+H2C=CH—CHO→ 。
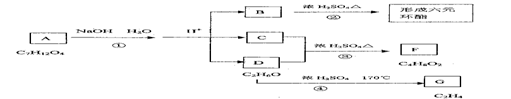
(2)以某链烃A为起始原料合成化合物G的路径如下(图中Mr表示相对分子质量)
|
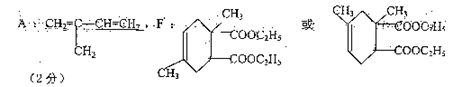
①指出反应类型B→C: ,F→G 。
②写出下列物质的结构简式:A: , F: 。
③写出下列反应式的化学方程式:
B→C: ;
D→E: 。
④写出G与氢氧化钠溶液反应的方程式 。
26.(14分)有X、Y、Z、W、M五种短周期元素,它们满足如下关系:①原子序数依次增大;②ZX4+ + WX-= ZX3 + X2W,且反应物和产物中各微粒的电子总数与M+相等;③Z2与YW分子中质子数相等。回答下列问题:
(1)M单质的蒸气中存在着少量的双原子分子,其电子式为 ;实验室中MWX溶液的保存方法是 。
(2)由X、Y、Z、W四种元素组成的离子化合物A,其原子个数比为7:2:1:2,则A为 (写名称),A的水溶液pH约等于7,其可能原因是 。
(3)化学式为X5Y2ZW2的化合物B既能与盐酸反应,又能与NaOH溶液反应,且在一定条件下可形成高分子化合物,则B的结构简式为 。
(4)M2W2与FeSO4按物质的量之比为1:2混合溶于水中,反应的离子方程式为
。
(5)与M同族的元素N和N2W共n g 投入到足量的X2W中完全反应,生成物蒸干后得1.25 n g化合物NWX,M′是 (填元素名称)。
6.B7C8.B9D10B11A12B13D
26.(11分)
(1)Si3N4、SiC14;
(2)Si3N4+3O2=3SiO2+2N2;
(3)+4,-3(2分)原子晶体(方程式各3分,其它每空2分)
27.(16分)
(1)①三角锥型,(1分) 高温、高压、催化剂(2分)
|
|
(2)①SO2(1分)
②H2S+OH- HS-+H2O(3分)
③3C12+4H2O+S H2SO4+6HC1(3分)
28.(16分)(1)(2分)加成(或还原)反应 (2)(各2分) CH3CH2OOCC6H5
![]()
(3)(各2分)
![]()
![]()
 (4)(各2分)
(4)(各2分)
![]()
29(14分)
(1)①(3分) ②1g (2分) 672 (2分)
③0.56(3分)
(2)520mL <V<787 mL
(4分)
 28.(8分)(1)乙醇(1分)
28.(8分)(1)乙醇(1分)
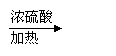
(2)CH3COOH+CH3+CH2OH CH3COOH2CH3+H2O(2分)
(3)CH3CH(OH)COOH CH3COOCH(CH3)COOCH2CH3; 酯化反应(各1分共3分)
![]()
![]() (4)
(4)
![]()
![]() nCH3=CH2
[ CH2—CH2 ] n 或CH3=CH2+H2O
CH3CH2OH (2分)
nCH3=CH2
[ CH2—CH2 ] n 或CH3=CH2+H2O
CH3CH2OH (2分)
|
29.(1) (2分)
(2)①水解反应 加成反应(2分)
|
②
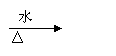 ③
③
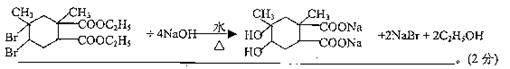
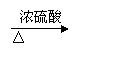 BrCH2—C(CH3)=CH—CH2Br+2NaOH
CH2(OH)—C(CH3)=CH—CH2(OH)+2NaBr;
BrCH2—C(CH3)=CH—CH2Br+2NaOH
CH2(OH)—C(CH3)=CH—CH2(OH)+2NaBr;
HOOC—C(CH3)=CH—COOH+2CH3CH2OH H5C2OOC—C(CH3)=CH—COOC2H5+H2O
|
25.(8分)
(1)2VH2(正)=3VNH3(逆)(1分)
![]() (2)减小 正方向 N2(g)+3H2(g) 2NH3(g)+92.4KJ(2分)
(2)减小 正方向 N2(g)+3H2(g) 2NH3(g)+92.4KJ(2分)
|
(4)如图
五26.(14分,每空2分)
(1)Na:Na(2分) 密闭保存在带橡胶塞的试剂瓶中(2分)
(2)醋酸铵(乙酸铵)(2分,“铵”字写错,写化学式均不得分)
CH3COO-水解与NH4+水解程度相当(2分)
(3)H2NCH2COOH(2分)
![]() (4)3Na2O2 + 6Fe2+ + 6H2O 6Na+
+ 4Fe(OH)3↓+ 2Fe3+
(4)3Na2O2 + 6Fe2+ + 6H2O 6Na+
+ 4Fe(OH)3↓+ 2Fe3+
(5)钾(2分,填元素符号不得分)