08年高考理科综合能力(化学)调研试题
命题人:河南省内乡县高级中学(邮政编码:474350) 陈宗申
可能用到的相对原子质量:H—I N—14 O—16 Al—27 S—32 Zn—65 Cu—64
第I卷(选择题,共48分)
一、选择题(本题包括8小题,每小题只有一个选项符合题意)
1.设NA为阿伏加德罗常数,下列说法正确的是( )
A.1mol甲基所含有的电子数为10NA
B.标准状况下,22.4LCO2与CO的混合气体含有的碳原子数约为NA
C.1L 1mol/L的盐酸中,所含有的氯化氢分子数为NA
D.标准状况下,11.2L三氧化硫所含有的分子数为0.5NA
2.将下列每组内的四种物质同时加入到水中,充分搅拌后,既有氧化还原反应发生,又有沉淀产生的一组是(酸均过量)( )
A. Na2O2、NH4Cl、NaCl、Na2SO4
B. Na2CO3、BaCl2、K2S、盐酸
C. KHCO3、Ca(OH)2、MgCl2、硫酸
D. FeO、AlCl3、Na2SiO3、硝酸
3.下列反应的离子方程式正确的是( )
A.碳酸氢钠溶液显碱性:HCO3-+H2O![]() H2CO3+OH-
H2CO3+OH-
B.向沸水中滴加三氯化铁溶液制备氢氧化铁胶体:Fe3++3H2O![]() Fe(OH)3+3H+
Fe(OH)3+3H+
C.向次氯酸钙溶液中通入二氧化硫:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
D.向氢氧化钡溶液中滴加硫酸铜溶液:Ba2++SO42-=BaSO4↓
4.对危险化学品要在包装标签上印有警示性标志。氢氧化钠溶液应选用的标志是( )




A.爆炸品 B 氧化剂 C 剧毒品 D腐蚀品
5. 某溶液的PH=a,向其中插入两惰性电极,通电一段时间后为测知溶液的PH=b,且b=a.则该电解质是(设电解液的温度没有变化)
A.稀H2SO4 B.饱和CuSO4溶液 C.NaCl溶液 D.饱和Na2CO3溶液
6.A、B混合气体在密闭容器中发生如下反应:xA(g)+yB(g)![]() zC(g),
△H<0;达到化学平衡后测得A气体的浓度为0.5mol/L;当恒温下将密闭器的容积扩大一倍并再次达到平衡时,测得A气体的浓度为0.3mol。则下列叙述正确的是( )
zC(g),
△H<0;达到化学平衡后测得A气体的浓度为0.5mol/L;当恒温下将密闭器的容积扩大一倍并再次达到平衡时,测得A气体的浓度为0.3mol。则下列叙述正确的是( )
A. 平衡向右移动 B. x+y>z
C. B的转化率提高 D. C的体积分数增加
7.有一种名叫L—多巴的药物可用于治疗帕金森综合症,其结构简式为:
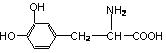
下列关于L—多巴的说法不正确的是( )
A.该有机物中所有碳原子可能处于同一个平面
B.该机物既可以与盐酸反应,又可以与氢氧化钠溶液反应
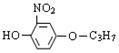
C.该有机物与 互为同分异构体
D.该有机物属于芳香烃类
8.下列关于实验问题处理方法或操作不正确的是( )
A.实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室
B.测定硫酸铜晶体中结晶水含量的实验中,至少需经过4次称量
C.中和热测定中要用稍过量的酸(或碱),以便使碱(或酸)能够完全被中和
D.配制稀硫酸时,可先在烧杯中加一定体积的水,再边搅拌边加入浓硫酸
第II卷(非选择题,共60分)
9.(14分)A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,A与D、C与F分别为同一主族,A、D两元素的原子核内的质子数之和是C、F两元素原子核内质子数之和的一半。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为______________,其分子属于___________(填“极性”、“非极性”)分子。
(2)E是非金属元素,但能表现出一些金属元素的性质,请写出单质E与氧氧化钠溶液反应的离子方程式____ _____________。
(3)一定条件下,A的气体单质与B的气体单质充分反应生成6.8gW气体[已知n (A):n(B)=3:1],可放出18.44kJ热量,则该反应的热化学方程式_________________。
(4)A的单质与C的单质在KOH的浓溶液中可以形成原电池,如果M和N为惰性电极,在电池的M极通入A气体,N极通入C气体,则N极的电极反应式为:_____________________________。
(5)在10升的密闭容器中,通入2mol的FC2气体和3molC的气体单质,一定条件下反应后生成FC3气体,当反应达到平衡时,单质C的浓度为0.21mol/L,则平衡时FC2的转化率为____________。
10.(14分)已知A、C、D、F均是溶液,其中A、C是重要的基础化工原料,C可使酚酞试液变红。B、G、I、J、K是固体,其中B是常见的金属单质,G是常见的非金属单质。E、H是气体,且E是单质。H、J、K、L均是由两种元素组成的化合物,L常温下为液态,物质之间的转化关系如下图所示:
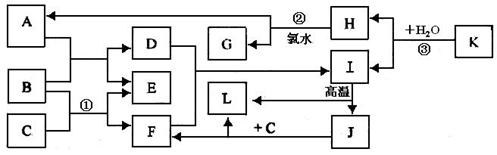 请回答下列问题:
请回答下列问题:
(1)元素B在周期表中的位置是_______________。J的化学式是_____________。
(2)反应①的离子方程式为______________________________。
(3)反应②的化学方程式为_______________________________。
反应③的化学方程式为______________________________。
(4)工业上可通过电解熔融的J来制取B的单质,当有6mol电子发生转移时,可得到___________g单质B。
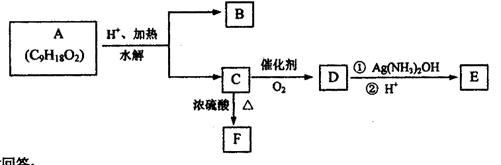
11. (16分)有机物A可用于配制水果香型香精,A—F可发生如下转化。B与C的相对分子质量相等,B分子中含有2个甲基,D分子中烷基上的一氯取代物可有3种;F能使Br2的四氯化碳溶液褪色。
|
试回答:
(1)E中的官能团名称是 ;
|
a.氧化反应 b.加成反应 c.消去反应 d.酯化反应
(3)A的结构简式为 ;C→F的化学方程式为 。
(4)写出水解时能生成正戊酸且分子中含有3个甲基的A的同分异构体结构简式(所有符合条件的) 。
(5)将B和C的混合物5mol放在足量O2中完全燃烧,生成CO2492.8L(标准状况)。
则混合物中B的物质的量为 mol。
12.(16分)某化学兴趣小组需制备22.4LSO2气体(标准状况),他们依据化学方程式Zn + 2H2SO4(浓)![]() ZnSO4 +
SO2↑+ 2H2O计算后,取65.0锌粒与98%的浓硫酸(
ZnSO4 +
SO2↑+ 2H2O计算后,取65.0锌粒与98%的浓硫酸(![]() =1.84g/cm3)110mL充分反应,待锌粒全部溶解后,收集所得气体X。经测定其中含有气体杂质。
=1.84g/cm3)110mL充分反应,待锌粒全部溶解后,收集所得气体X。经测定其中含有气体杂质。
(1)化学兴趣小组所制得的气体X中混有的主要杂质气体可能是_________(填分子式)。产生这种结果的主要原因是(用离子方程式表示)____________________。
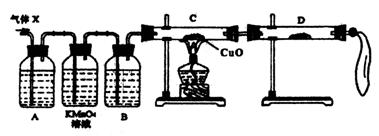
(2)为了检验主要杂质气体的成分,化学兴趣小组的同学设计了如下实验,对气体X取样进行认真探究。
①组装好仪器后,盛放药品前,必要的一个操作是_______________________。
②A中加入的试剂可能是_________________,作用是______________________。
B中加入的试剂可能_________________,作用是______________________。
③证实气体X中混有较多杂质气体,应观察到C中的实验现象是________________,
D中最好选择的试剂____________________。
(3)假定气体在吸收过程中吸收完全,对上述装置略加改进,可以粗略测定气体X中SO2的体积分数。改进时可选用的下列仪器为________________(填代号)。
a.导管 b.水槽 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
参考答案及评分标准
1.B 2.D 3.A 4.D 5.D 6.B 7.D 8.A
9.(本题共14分,第(1)小题1分×2,其它小题每小题3分)
(1) ![]() (1分);极性(1分)
(1分);极性(1分)
(2)Si+2OH-+H2O=SiO32-+2H2↑(3分)(未配平不给分,书写不规范得1分,下同)
(3) N2(g)+3H2(g) ![]() 2NH3(g); △H=-92.2kJ·mol-1(3分)
2NH3(g); △H=-92.2kJ·mol-1(3分)
(4)2H2O+O2+4e-=4OH-(3分)
(5)90%(3分)
10.(本题共14分,第(1)小题1分×2,其它小题每小题3分)
(1)第三周期ⅢA族(1分) Al2O3 (1分) (1分)
(2)2Al+2OH-+2H2O=2AlO2-+3H2↑(3分)
(3)H2S+Cl2=2HCl+S↓ (3分) Al2S3+6H2O=2Al(OH)3↓+3H2S↑(3分)
(4)54g(3分)
11.(16分)
(1)羧基(2分)
(2)a (2分)b (2分)
![]()
![]() (3)CH3CHCOOCH2CH2CHCH3(2分)
(3)CH3CHCOOCH2CH2CHCH3(2分)
CH3 CH3
![]()
![]()
 CH3CHCH2CH2OH
CH3—CH—CH=CH2+H2O(2分)
CH3CHCH2CH2OH
CH3—CH—CH=CH2+H2O(2分)
CH3 CH3
![]() (4)CH3CH2CH2CH2COOCH2CHCH3 (2分)
(4)CH3CH2CH2CH2COOCH2CHCH3 (2分)
CH3
![]() CH3CH2CH2CH2COOCHCH2CH3 (2分)
CH3CH2CH2CH2COOCHCH2CH3 (2分)
CH3
(5)3 (2分)
12.(本题共16分)
(1)H2(1分) Zn+2H+=Zn2++H2↑(2分)
(2)①检查装置的气密性(2分)
②NaOH溶液(其它答案合理也可)(2分) 除去SO2气体(2分)
浓硫酸(1分) 干燥氢气(1分)
③固体由黑色变成红色并有少量水珠生成(2分) 无水硫酸铜(1分)
(3)a、c、e、g(2分)