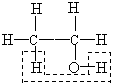08级高三2月理综化学部分试题
化学试题
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23
6.下列各选项中,两个反应所遵循的化学原理最相似的是
A.葡萄糖和甲醛分别与新制的氢氧化铜悬浊液共热,都产生红色沉淀
B.苯酚和乙烯都能使溴水褪色
C.二氧化硫和过氧化氢都能使品红溶液褪色
D.氯气用于水的杀菌消毒和明矾用于净水
7.用NA表示阿伏加德罗常数的值,下列说法正确的是
A.呈中性的稀溶液1 L里含有10—7 NA个H+
B.每升硫酸溶液里含有10—2 NA个H+,该硫酸溶液的pH为2
C.NA个NH4+ 有10 mol质子
D.常温下2.24 L庚烷中有1.6 NA个极性键
8.表示下列变化的化学用语正确的是
A.NaHCO3的水解:HCO3— + H2O![]() H3O+
+ CO32—
H3O+
+ CO32—
B.NaOH的结构式:Na—O—H
C.钢铁吸氧腐蚀的正极反应式:4OH—-4e— = O2↑+ 2H2O
D.1 L 0.5 mo1·L—1 稀硫酸与1 L 1 mol·L—1氢氧化钠溶液反应放出57.3 kJ的热量:
H2SO4 (aq) + 2NaOH (aq) = Na2SO4 (aq) + 2H2O (1);ΔH=-114.6 kJ·mo1—l
9.A、B、C三种短周期元素,原子序数按A、B、C依次增大,A元素原子最外层电子数是次外层电子数的2倍,B元素原子的次外层电子数是最外层电子数的2倍,C元素原子的最外层电子数是内层电子总数的一半。则下列说法中正确的是
A.B元素在自然界的含量最多
B.C元素可以组成不同的单质,它们均易溶于CS2
C.A、B、C元素的常见单质的熔点:A>B>C
D.A、B、C的氧化物都能溶于水形成酸
10.下列有关电解精炼铜的说法不正确的是
A.粗铜作阳极
B.用CuSO4溶液作电解液
C.阴极的电极反应式为:Cu2+ + 2e— = Cu
D.当阳极质量减少a g时,阴极质量一定增加a g
11.在体积为V L的密闭容器中通入a mol NH3和b mol HCl,充分反应后容器内阳离子和阴离子的个数比为
A.1∶1 B.小于1∶1 C.a∶b D.(a+b)∶ b
12.常温下,已知a mol·L—1的某一元强酸HA的稀溶液和b mol·L—1的某一元弱碱BOH的稀溶液等体积混合后溶液pH = 7,则下列叙述不正确的是
A.a < b
B.酸溶液中c (H+ )大于碱溶液c (OH—)
C.反应后溶液中c (B+ ) > c (A—)
D.反应后溶液中c (BOH) + c (B+ ) = b /2 mol·L—1
13.已知可逆反应:2X(g) + Y(g) ![]() m Z(g);ΔH=- a kJ·mo1—l (a>0)。现有甲、乙两个容积相等的容器,向甲容器中充入2 mol X和l molY,达到平衡时放出热量b kJ;向乙容器中充入1 mol X和0.5 molY,达到平衡时放出热量c kJ,且b >2c。则a、b的大小关系及m的值域正确的是
m Z(g);ΔH=- a kJ·mo1—l (a>0)。现有甲、乙两个容积相等的容器,向甲容器中充入2 mol X和l molY,达到平衡时放出热量b kJ;向乙容器中充入1 mol X和0.5 molY,达到平衡时放出热量c kJ,且b >2c。则a、b的大小关系及m的值域正确的是
A.a = b m = 3 B.a > b m≤2
C.a < b m≤2 D.a > b m = 2
26.(16分)某无色溶液A中含有K+、Cl—、OH—、SO32—、SO42—,为检验确认其中所含的各阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH— 的实验方法从略,检验其他阴离子的过程如下图所示。
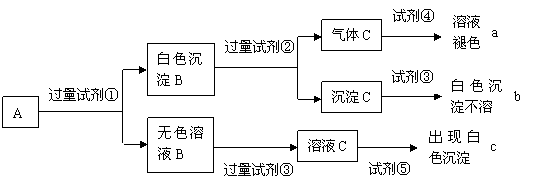
(1)图中试剂①~⑤溶质的化学式分别是:
① ,② ,③ ,④ ,⑤ 。
(2)图中现象a、b、c表明检验出的离子分别是:a 、b 、c 。
(3)白色沉淀B加试剂②反应的离子方程式是:
。
(4)无色溶液B加试剂③的主要目的是 。
(5)白色沉淀B若加试剂③而不加试剂②对实验的影响是
。
(6)无色溶液B加过量试剂③发生反应的离子方程式是:
。
27.(15分)下图是乙醇脱氢反应的实验装置。
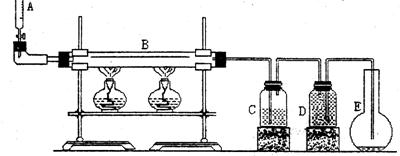
从装置A滴加纯乙醇,通过红热的铜催化剂(在装置B中),生成的气体通过装置C(内盛少量水),一部分气体凝结并溶解于水,剩余气体收集在装置D中(水被排到装置E)。
通过实验证明:
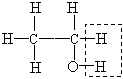
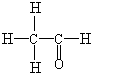
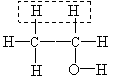
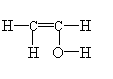
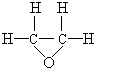
(1)装置D中的气体是纯氢 (2)装置C中溶有沸点为21℃的无色液体X
(3)X不能使溴水褪色 (4)X能生成三氯取代物,不能生成四氯取代物
实验测得1.0 g乙醇经反应后所得氢气的体积为482 mL(标准状况)。
ⅰ.根据上述实验数据,可算出每个乙醇分子脱去的氢原子个数,从而得出液体X的分子式是 。
这一计算的主要计算式为 。
ⅱ.根据有机物的分子结构理论,把乙醇分子在上述反应中几种可能的脱氢方式和脱氢生成物的结构式以及物质名称填入下表空格中(可填满也可不填满)。
| 可能的脱氢方式 | 脱氢生成物的结构式 | 物质名称 |
ⅲ.由上述实验证明,只有 (写结构简式)是液体X。
28.(13分)已知A~F是中学化学中常见物质,其中A、C、E、F为气体,B、D为液体,D的消费量常作为一个国家工业发达水平的一种标志。F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B是含氧质量分数最高的化合物。反应中部分生成物已略去。试回答下列问题:
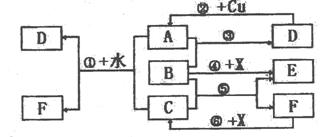
(1)A、C、D三种物质中属于非电解质的是 (填化学式)。
(2)根据图中信息:B、C、D、X氧化性从强到弱的顺序是
。
(3)物质D中含有一种元素Y,Y单质的熔点是112.8℃,则Y单质的晶体类型属于 晶体。Y与碳单质在一定条件下可以生成CY2的化合物,则CY2属于(填“极性”或“非极性”) 分子。
(4)写出反应②的化学方程式: 。
(3)写出反应①、⑥的离子方程式:
① ;
⑥ 。
29.(16分)瑞典皇家科学院将2004年诺贝尔化学奖授予以色列科学家阿龙·切哈诺沃、阿夫拉姆·赫什科和美国科学家欧文·罗斯,三人共享1000万瑞典克朗(约合136万美元)的奖金,以表彰他们发现了泛素调节的蛋白质降解。
用泛素标记的某天然蛋白质降解产物中含有甘氨酸、丙氨酸、A和M四种α—氨基酸,其中A由C、H、N、O四种元素组成,A能与NaOH反应,也能与盐酸反应。在一定条件下,两分子A发生缩合反应生成B和1个水分子,B的相对分子质量为312,当该蛋白质与浓硝酸反应时显黄色。M中各元素的质量分数为C 54.8%,H 5.58%,N 7.11%,其余为O。M的相对分子质量不超过300,分子中不存在甲基,能与FeCl3溶液发生显色反应,l mol M最多能与3 mol NaOH完全反应。
(1)据此推断A的结构简式为 。
(2)有机物M的相对分子质量为 ,其分子式为 ,符合上述条件的有机物M的可能结构有 (填数字)种,写出其中任意一种与NaOH溶液完全反应的化学方程式:
。
(3)已知α—氨基酸能与亚硝酸反应得到α—羟基酸,例如:
![]()
![]()
![]()
![]() O
O
O
O
![]()
![]() R―CH―C―OH + HNO2 → R―CH―C―OH + N2↑+H2O
R―CH―C―OH + HNO2 → R―CH―C―OH + N2↑+H2O
NH2 OH
现有某α—氨基酸盐A,其分子中原子数之比为C∶H∶O∶N = 3∶10∶2∶2,由它开始有如下图所示的反应关系,其中无机产物均已略去,括号中的数字为其相对分子质量。
|
| |||
|
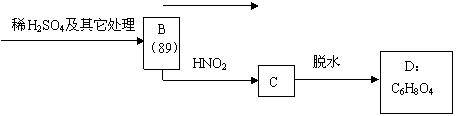
①写出下列有机物的结构简式:
D E
②写出A → B的化学方程式:
化学参考答案:
6. A 7. B 8. D 9. C 10. D 11.A 12. C 13. B
26.(1)Ba(NO3)2、HCl、HNO3、Br2、AgNO3(每空1分)
(2)SO![]() 、SO
、SO![]() 、Cl
、Cl![]() (每空1分)
(每空1分)
(3)BaSO3 + 2H+ = Ba2+ + SO2↑+ H2O(2分)
(4)中和溶液中的OH![]() ,影响对Cl
,影响对Cl![]() 的检验(2分)
的检验(2分)
(5)HNO3氧化BaSO3生成BaSO4,影响对SO![]() 的检验(2分)
的检验(2分)
(6)H+
+ OH![]() = H2O(2分)
= H2O(2分)
27.ⅰ. C2H4O(2分),![]() (2分)
(2分)
ⅱ.(每空1分)
| 可能的脱氢方式 | 脱氢生成物的结构式 | 物质名称 |
|
|
|
乙醛 |
|
|
| 羟基乙烯 (或乙烯醇) |
|
|
| 环氧乙烷 |
ⅲ.CH3CHO(2分)
28.(1)SO2(2分)
(2)MnO2>Cl2>H2O2>H2SO4或X>C>B>D(3分)
|
(4)2H2SO4(浓)+ Cu = CuSO4 +SO2↑+2H2O(2分)
(5)① Cl2 + SO2 + 2H2O
= 4H+ +2Cl![]() +SO
+SO![]()
⑥ MnO2 + 4H+ + 2Cl![]() = Mn2+ + Cl2↑+2H2O(每空2分)
= Mn2+ + Cl2↑+2H2O(每空2分)
|
(2)197,C9H11NO4,6
|
|
|
|
|
|
|
|
|
|
![]()
![]()
![]()
![]() C—O
C—NH
C—O
C—NH
![]()
![]()
![]()
![]() D:CH3—CH CH—CH3
E:CH3—CH
CH—CH3
D:CH3—CH CH—CH3
E:CH3—CH
CH—CH3
|
|
②
|
|
|
|