高三年级化学统一考试试题
化 学 试 题
本试卷分第I卷(选择题)和第II卷(非选择题)两部分. 共100分,考试时间120分钟.
第I卷(选择题 共30分)
注意事项:
1.本试卷分第l卷(选择题)和第U卷(非选择题)两部分,第7卷4]分,第Ⅱ卷59分,全卷满分100分。考试时间90分钟。
2.答第Ⅰ卷前,务必将自己的姓名、考号、考试科目涂写在答题卡上。每题选出答案后,都必须用2B铅笔把答题卡上对应题目的答案标号(A、B、C、D)涂黑,如需改动,必须用橡皮擦于净,再改涂其它答案。
3.答第Ⅱ卷前,务必将密封线内的项目填写清楚。必须用钢笔或圆珠笔直接答在试卷上,密封线内一律不准答题。
相对原子质量:H1 C12 N 14 O 16 Na 23 Mg 24 Al 27 Si28 S32 Cl35.5 K39 Ca40 Mn55 Fe56 Cu64 Br80 Ag108 I127
第Ⅰ卷(必做 共41分)
一、选择题(本题包括17小题,1—10小题每小题2分,11—17小题每小题3分,共41分。每小题只有一个选项最符合题意)
1.下列叙述中,正确的是 ( )
A.棉花、羊毛都属于纤维素 B.生产水泥和普通玻璃原料中都有石灰石
C.饱和硫酸铵溶液可以使蛋白质变性 D.煤的干馏为物理变化
2.聚丙烯酸酯的结构为![]() ,下列有关它的说法中,不正确的是 ( )
,下列有关它的说法中,不正确的是 ( )
A.它可由CH2=CH—COOR经加成聚合反应得到
B.聚丙烯酸酯材料是一种混合物
C.在一定条件下能发生水解反应
D.在一定条件下能发生加成反应
| |
A.HCl的水溶液是强酸,HF的水溶液也是强酸
B.CH4是正四面体结构,SiH4也是正四面体结构
C.O2与Cu反应生成CuO,S与Cu反应生成CuS
D.CaCO3与稀硝酸反应生成CO2,CaSO3与稀硝酸反应生成SO2
4.下列说法中,正确的是 ( )
A.离子化合物中不存在共价键
B.25%时,l L pH=3的盐酸勺1L pH=11的氨水能恰好中和
C.25℃时,用pH试纸测定出某醋酸溶液的pH=3.5
D.25℃时,pH=14的溶液中,Na+、CO2-3 、K+、CIO—可以大量共存
5.随着科学技术的不断进步,研究物质的手段和途径越来越多,H3、O4、C60,H+5等已被发现。下列有关说法中,正确的是 ( )
A.H2与H3属于同索异形体 B.O2与O4属于同位素
C.C60的质量数为720 s/mol D.N+5离子中含有36个电子
6.NA表示阿伏加德罗常数,下列说法中,不正确的是 ( )
A.0.5 mol羟基中含有的电子数为4.5NA
B.30 g二氧化硅中所含原干总数为1.5NA
C.17s氨气溶于水,得到N3·H2O的分子数为NA
D.标准状况下,22.4L甲烷中含有的共价键数为4NA
7.下列物质恰好完全反应后,溶液中pH增大的是 ( )
A.将SO2通人溴水中 B.将SO2通入H2S溶液中
C.将H2S通人CuSO4溶液中 D.将Cl2通入NaOH溶液中
8.十燥剂的于燥性能,可用干燥效率(1m3空气中实际残留水蒸气的质量)来衡量。某些干炼剂的干燥效率数据如厂表:
| 物质 | 干燥效率/s | 物质 | 干燥效率/g |
| MgO | 0.008 | ZnCl2 | 0.8 |
| CaO | 0.2 | ZnBr2 | 1.1 |
分析以上数据,下列有关判断中,不合理的是 ( )
A.MgO的干燥性能比CaO的效果好
B.干燥效率可能与干燥剂的阴、阳离子的半径大小有关
C.MgCl2可能是比CaCl2更好的干燥剂
D.上述干燥剂中阳离子对干燥性能的影响比阴离子小
9.下列表述中,正确的是 ( )
A.H+H—H2是吸热过程
B.生成单质的反应一定是氧化反应
C.凡是能自发进行的反应,一定是△H<0、△S>o
D.在可逆反应中,若正反应速率减小,逆反应速率可能增大也可能减小
10.下列有关反应离子方程式的书写中,正确的是 ( )
A.在NaOH溶液中通人少量的SO2气体:SO2+OH—=![]()
B.Cl2通入水中:Cl2+H2O=2H+十Cl—十ClO—
C.过量铁粉投入稀硝酸中:![]()
![]() D.明矾溶于水:Al3++3H2O Al(OH)3+3H+
D.明矾溶于水:Al3++3H2O Al(OH)3+3H+
11.用惰性电极电解CuSO4溶液,下列说法中,正确的是 ( )
A.阳极发生的电极反应为:![]()
B.阴极发生的电极反应为;![]()
C.若有6.4 8金属Cu析出,则放出的O2为0.05 mol
D.电解过程中,阳极附近溶液的pH增大
12.25℃时,在1.0 L浓度均为0.01 mol.L-1的某一元酸HA与其钠盐组成的混合溶液中,测得c(Na+)>c(A—),则下列描述中,不正确的是 ( )
A.该溶液的PH<7 B.HA的酸性很弱,A—水解程度较大
C.c(A—)+c(HA)=0.002 mol.L-1 D.n(A—)+n(OH—)=0.01 mo1+n(H+)
13.在298K、1.01×105Pa下,12g石墨在24g氧气中燃烧至反应物完全消耗,测得放出
xkJ的热量。已知在该条件下,1mol石墨完全燃烧放出ykJ的热量。则石墨与氧气反
应生成CO的热化学方程式表达正确的是 ( )
A.C(石墨,s)+![]() O2(g)=CO(g) △H(298K)=-ykJ·mol-1
O2(g)=CO(g) △H(298K)=-ykJ·mol-1
B.C(石墨,s)+![]() O2(g)=CO(g) △H(298K)=-xkJ·mol-1
O2(g)=CO(g) △H(298K)=-xkJ·mol-1
C. C(石墨,s)+![]() O2(g)=CO(g)
△H(298K)=-(2x-y)kJ·mol-1
O2(g)=CO(g)
△H(298K)=-(2x-y)kJ·mol-1
 D.2 C(石墨,s)+
D.2 C(石墨,s)+![]() O2(g)=CO(g) △H(298K)=-(2x-y)kJ·mol-1
O2(g)=CO(g) △H(298K)=-(2x-y)kJ·mol-1
14.某同学仿照“喷泉”实验的原理,在实验室中做了一个“喷烟”实验,如图所示。他在甲,乙两个烧瓶中分别充人X、Y两种无色气体,在胶头滴管中盛有含酚酞的NaOH溶液,实验时将胶头滴管内的液体挤入甲烧瓶内,然后打开止水夹,便可看到甲烧瓶中的导管口喷出白色的烟,同时甲烧瓶中的溶液颜色逐渐变浅。若已知X、Y是HCl、NH3、Cl2、O2、CH4、SO2、NO七种气体中的两种,则下列判断中,正确的是( )
| |
C.X是SO2,Y是O2 D.X是NO,Y是O2
|
A.正极电极反应式为:2H++2e—→H2↑
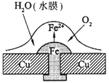
B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中铜并不被腐蚀
D.此过程中电子从Fe移向Cu
16.X、Y、Z、W为四种短周期元素,已知x、Z同主族,Y、W同周期;X的气态氢化物比Z的稳定;Y的阳离子比W的阳离子氧化性强;Y的阳离子比2的阴离子少一个电子层。下列表示中,正确的是 ( )
A.原子序数,X的>Y的>Z的>W的 B.简单离子半径:W的>Y的>Z的>X的
C.原子半径:W的>Y的>Z的>X的 D.原子的得电子能力:X的<Z的
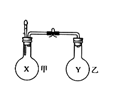
17.将某些化学知识用图像表示,可以收到直观、简明的效果。下列图象所表示的化学知识
中,不正确的是 ( )
[必做部分]
二、(本大题包括5小题,共51分)
18.(6分)为测定某种硫酸铜晶体(CuSO4·xH2O)中x的值,某化学实验小组进行了如下实验:
①称取23.2gCuSO4·xH2O晶体,研细后转移入烧杯中,加蒸馏水使其完全溶解;
②向上述所得溶液中滴人过量NaOH溶液;
③将步骤②所得混合物过滤、洗涤后,再将固体转移至坩埚中,灼烧,直至质量不再变化冷却后,称得固体质量为8.0g
请回答下列问题;
(1)步骤①中研磨固体所用仪器的名称是__________。
(2)步骤③中洗涤沉淀的操作要点是:______________________。
(3)x=______________。
19.(9分)某研性学习小组用下图装置验证二氧化锰对氯酸钾分解的催化作用,实验时均以生成25mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
| 实验序号 | KClO3的质量 | 加入的物质及其质量 | 生成25 mL气体所用时间 |
| Ⅰ | 1.2 g | 无 | t1(min) |
| Ⅱ | 1.2 g | MnO2 0.5 g | t2(min) |
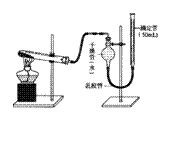 (1)实验装置中滴定管是_____(填“酸式”或“碱式”)
(1)实验装置中滴定管是_____(填“酸式”或“碱式”)
滴定管(50 mL);若要测得实验所需气体体积,滴
定管中起始液面读数(初读数)应控制的刻度范围
是_____。
(2)仪器组装完成后,检验该套装置气密性的操作是
__________________________。
(3)若实验中测得t2<t1,实验小组经过讨论,认为上述
实验还不能完全证明MnO2一定起了催化作用,需
再补做实验。请利用实验n反应后的剩余物和下面提供的合适用品补做实验(简要说明实验步骤,可不填满,也可以补充)。提供的用品有:H2O2溶液、浓盐酸、硝酸、MnO2、NaOH溶液、AgNO3溶液、KClO3、木条、淀粉—KI试纸、蒸馏水及必要的实验仪器。
①__________________________________________:
②___________________________________________;
③__________________________________________。
20.(10分)甲、乙、丙为三种常见短周期元素,它们的原子序数依次增大,已知甲元素原于最外层电子数比乙元素原子的多一个,乙元素原于最外层电子数与其电子层数相等,丙元素原子最外层电子数是乙元素原子最外层电子数的2倍。物质A、B属于钠盐,物质C是一种强酸;又知:A中含乙元素,B中含甲元素,C中含丙元素。各种物质之间的相互转化关系如下图所示(部分产物未给出):
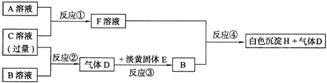
请回答下列问题:
(1)丙元素的原子结构示意图为____________,白色沉淀H的化学式为_______________。
(2)反应①的离子方程式为_________________。
(3)用离子方程式解释B溶液pH>7的原因:__________________。
(4)写出反应③的化学方程式:_________________________。
21.(14分)下表是A、B、C、D四种有机物的有关信息;
| A | B | C | D |
| ①由C、H、O三种元素组成 ②球棍模型为:
⑧能与NH3在一定条件下反应生成丙烯酰胺 (CH2—CH—CONH2) | ①由C、H、O三种元素组成 ②能与Na反应,但不能与NaOH溶液反应 ③能与A反应生成相对分子质量为100的酯 | ①相对分子质量与B相同 ②能被弱氧化剂氢氧化铜氧化 ③能与NaHCO3溶液反应放出CO2气体 | ①能使溴的四氧化碳溶液退色 ②能与水在一定条件下反应生成B |
请回答下列问题:
(1)与D在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通武CnH2n。当n=__________时,开始出现该类有机物的同分异构体。
(2)在一定条件下,D分子之间能生成一种具有广泛用途的高分子化合物,写出该高分子化合物的名称是________。
(3)写出A与NH3在一定条件下反应生成丙烯酰胺的化学方程式,并指出反应类型:______,反应类型:________。
(4)丙烯酰胺有多种同分异构体,试写出3种分子中同时含有醛基(—CHO)和碳碳双
键(![]() )的同分异构体的结构简式:____________、________________、_____________。
)的同分异构体的结构简式:____________、________________、_____________。
(5)写出B与C反应的化学方程式:
22.(12分)将2molSO2和1molO2混合置于容积为2L的密闭容器中,在800 K时,发生如下反应:
![]() 2SO2(g)+O2(g) 2SO3(g) △H=-196056kJ·mol-1
2SO2(g)+O2(g) 2SO3(g) △H=-196056kJ·mol-1
当反应从开始进行到5min时,反应达到平衡状态,测得混合气体总物质的量为2.1 mol。
请回答下列问题:
(1)800K时,该反应的平衡常数为_____,在0~5min时间间隔内SO2的反应速率为___。
(2)若在5min时降低温度,在某一时刻重新达到平衡状态,则新平衡混合物中气体的总物质的量________2.1 mol(填“>”、“<”或“=”),简述你的判断理由:__________。
(3)若相同条件下,向该容器内分别充人xmolSO2、ymolO2和zmolSO3,反应达到平衡时,容器内混合气体总物质的量仍为2.1 mol。则:x、y、z必须满足的关系是__________。(一个用含x、z的式子表示,一个用含y、z的式子表示)
(4)相同条件下,若在上述容器中,充入0.2 mol SO2、0.4 mol O2和4.0molSO3三种气体,下列对该反应状态的描述中,正确的是________(填字母序号)。
A.处于平衡状态
B.不是平衡状态,反应正向进行
C.不是平衡状态,反应逆向进行
[选做部分]
三、(本题包括2小题,请从23、24两小题中任选一题作答,每小题日分。若两小题都做,只按23小题计分)
23.(8分)[化学一有机化学基础]有机化学反应因反应条件不同,可生成不同的有机产物。例如:
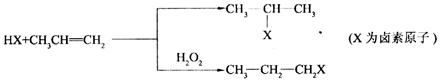
工业上按下列路线合成结构简式为![]() 的物质,该物质是一种香料。
的物质,该物质是一种香料。
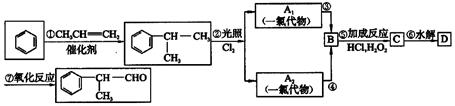
请回答下列问题:
(1)写出A1、A2可能的结构简式:A1_______;A2______________。
(2)反应⑤的化学方程式为__________________。
(3)工业生产中,中间产物经反应③④⑤⑥得D,而不是由A1或A2直接转化为D。其优越性主要是__________。
(4)这种香料有多种同分异构体,写出2种符合下列条件的有机物的结构简式:
a.其水溶液遇FeCl3溶液变紫色;
b.分子中有苯环,且苯环上的一溴代物只有2种。
_____________________,___________________________。
24.(8分)[化学—物质结构与性质]
有A、B、C、D四种元素,其中A元素和U元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2:1。
请回答下列问题:
(1)A元素形成的晶体属于A2密堆积型式,则其晶体内晶胞类型应属于____(填写“六方”、“面心立方”或“体心立方”)。
(2)B—的电子排布式为____,在CB3分子中C元素原子的原子轨道发生的是________杂化。
 (3)C的氢化物的空间构型为_________,其氢化物在同族元素所形成的氢化物中沸点最高的原田是__________。
(3)C的氢化物的空间构型为_________,其氢化物在同族元素所形成的氢化物中沸点最高的原田是__________。
(4)B元素的电负性_______D元素的电负性(填“>”,“<”
或“=”);用一个化学方程式说明B、D两元素形成的
单质的氧化性强弱:____________。
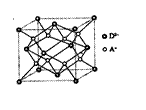
(5)如图所示是R形成的晶体的晶胞,设晶胞的边长为acm。试计算R晶体的密度。(阿伏加德罗常数用NA表示)
参考答案
一、选择题[本题包括17小题,1—10小题每小题2分,11—17小题每小题3分,共41分。每小题只有一个选项符合题意)
1.B 2.D 3. B 4.D 5.A 6.C 7.B 8.D 9.D 10.D 11.C 12 .A 13.C
14.A 15.A 16.C 17.B
二、(本大题包括5小题,共51分)
18.(6分)(1)研钵(2分)
(2)沿玻璃棒向过滤器中加蒸馏水至浸没沉淀,静置滤出液体,重复操作2—3次(2分)
(3)4(2分)
19.(9分)(1)碱式(1分)25.00 mL~50.00 mL(2分)
(2)(3分)①向滴定管中加水至滴定管中液面高于干燥管中的液面,静置,液面不发生变化,说明装置的气密性良好。②从滴定管上口加适量水,给大试管微热,若千燥管中的液面下降,滴定管中的液面上升,撤去热源后,液面又恢复到原状态,说明装置的气密性良好(否则,说明漏气)(其它合理答案,同样给分。)
(3)(3分)
①加热MnO2并用带火星的木条检验,没有氧气放出;
②将实验Ⅱ反应后的剩余物加入足量蒸馏水,充分溶解,过滤、洗涤、干燥、称量得固体0.5g。
③将实验②所得固体和浓盐酸混合加热,并用湿润的淀粉一K1试纸检验生成的气体或将实验②所得固体加入H2O2溶液中,H2O2溶液中生成气体的速率明显加快。
(答出其中两项即得3分,其它合理答案,同样给分)
20.(10分)(1) ![]() (2分) A1(OH)3(2分)
(2分) A1(OH)3(2分)
(2)Al(OH)-4 +4H+=4H2O十Ar3+(2分)
![]() (3)CO
(3)CO![]() +H2O HCO3+OH- (2分)
+H2O HCO3+OH- (2分)
(4)2Na2O2+2CO2=2Na2CO3+O2(2分)
21.(14分)
(1)4 (2分) (2)聚乙烯 (1分)
(3) CH2=CH—COOH+NH2→CH2=CH—CONH2 +H2O (2分) 取代反应(1分)
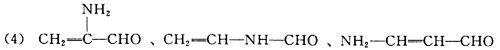
(各2分。只要符合要求即可给分)
![]() (5)HCOOH+C2H2OH HCOOC2H5+H2O
(2分)
(5)HCOOH+C2H2OH HCOOC2H5+H2O
(2分)
22.(12分)(1)1 620 mol·L-1(2分,不写单位扣1分)O.18 mol·L-1·min-1(2分)
(2)<(2分) 正反应是一个气体总物质的量减小的反应,且放热,当降低温度时,平衡向正反应方向移动(故气体的总物质的量减小)(2分)
(3)x+z=2;2y+z=2或![]() (每空1分)
(每空1分)
(4)C(2分)
三、(从23、24两小题中任选一题作答,每小题8分。若两小题都做,只按23小题记分)
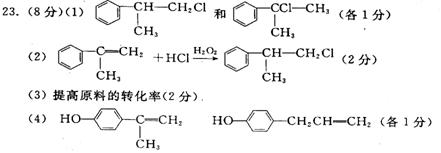
(其它合理答案可得分)
24.(8分)(每空1分)
(1)体心立方
(2)ls22s22p63s23p6,sp3
(3)三角锥形;氨分子间形成氢键,所以氨气比同族其它元素形成的氢化物沸点高
(4)>;H2S+Cl2=2HCl十S↓ (其它合理答案可得分)
(5)![]()