08届高三化学上学期第三次月考试卷
(附参考答案)
化 学
时量:90分钟 满分:108分
可能用到的相对原子质量:N—14 O—16 F—19 Na—23 S—32 Cl—35.5
K—39 Ca—40 Cu—64
一、选择题:(每小题只有一个选项合题意,每小题3分,共51分)
1.在地球上,氦元素主要以![]() He的形式存在。下列说法正确的是 ( B )
He的形式存在。下列说法正确的是 ( B )
A. ![]() He原子核内含有4个质子
He原子核内含有4个质子
B. ![]() He与
He与![]() He互为同位素
He互为同位素
C. ![]() He原子核内含有3个中子
He原子核内含有3个中子
D. ![]() He的最外电子层上电子数为2,所以
He的最外电子层上电子数为2,所以![]() He具有较强的金属性
He具有较强的金属性
2.下列说法不正确的是 ( C )
A.高纯度的硅是制半导体的重要材料
B.接触法制硫酸的主要步骤是造气、接触氧化和三氧化硫的吸收
C.SO2接触氧化时,一般采用高温高压的反应条件
D.水泥、玻璃、陶瓷都是传统的硅酸盐工业产品
【解析】SO2接触氧化时,常压下转化率已很高,采用高压会增加成本。
3.下列各组物质性质的比较中,不正确的是 ( D )
A.热稳定性:SiH4<PH3<NH3<H2O B.熔点:Na>K>Rb>Cs
C.酸性:H2CO3<H3PO4<H2SO4<HclO4 D.半径:K+>Na+>O2->F-
【解析】由非金属性判断依据可推断A、C正确,碱金属为金属晶体,从上往下金属阳离子半径增大,离子与自由电子间作用力减小,熔点递减,故B正确。核外电子排布相同听离子,核电荷数越大,半径越小,因此半径大小顺序为O2->F->Na+。
4.下列有关晶体的说法错误的是 ( C )
A.金刚石的网状结构中,以共价键形成的最小碳环上有6个碳原子
B.氯化铯晶体中,每个Cs+周围紧邻8个Cl—
C.氯化钠晶体中,每个Na+周围距离最近且相等的Na+共有6个
D.石墨晶体中,每一层内碳原子数与碳碳键之比为2:3
【解析】每个Na+周围距离最近且相等的Na+共有12个。
5.下列反应中,调节反应物用量或浓度不会改变反应产物的是 ( B )
A.H2S在氧气中燃烧 B.铁在硫蒸气中燃烧
C.二氧化硫通入石灰水中 D.硫酸中加入锌粉
【解析】H2S在氧气中燃烧可生成S或SO2,SO2与石灰水反应可生成CaSO3或Ca(HSO3)2,锌与稀硫酸反应生成氢气,与浓硫酸反应生成SO2,铁在硫蒸气中燃烧只能生成FeS。
6.有两种短期元素X和Y,可组成化合物XY3,当Y的原子序数为m时,X的原子序数为①m-4
②m+4 ③m+8 ④m-2 ⑤m+6,其中正确的组合是 ( D )
A.只有①②④ B. 只有①②⑤ C. ①②③⑤ D. ①②③④⑤
【解析】符合XY3组成的物质中,X、Y可分别为:(1)B、Al、N、P与F、Cl组合;(2)NH3,PH3;(3)SO3。BF3、AlCl3符合①,AlF3、符合②,SO3符合③,PCl3、NF3符合④,NH3符合⑤。
7.把11.9gH2S和11.2L(标准状况下)O2,在密闭容器中混合,点燃充分反应后,容器内氧化产物的总质量是 ( D )
A.10.8g B.11.2g C.21.6g D.22.4g
【解析】n(H2S):n(O2)=0.35:0.5,反应方程式可表示为:35H2S+50 O2==32.5S+32.5SO2+35H2O
氧化产物为S和SO2,质量共为32×0.025+64×0.325=21.6g。
8.下列天于碳族元素的说法中,错误的是 ( D )
A.它们从上到下非金属性向金属性递变的趋势比卤素明显
B.碳族元素的气态氢化物的稳定性从上到下逐渐减弱
C.碳族元素原子的最外层都有4个电子
D.主要化合价有+2价和+4价,大多数+2价化合物稳定
【解析】碳族元素,除铅外+4价化合物稳定。
9.下列每组物质发生状态变化所克服的粒子间的相互作用属于同类型的是 ( A )
A.碘和干冰升华 B.钠和硫熔化
C.食盐和蔗糖熔化 D.二氧化硅和氧化钠熔化
10.下列溶液中:①石灰水 ②Na2S溶液 ③KMnO4 ④溴水 ⑤酸化的Ba(NO3)2溶液
⑥品红溶液,不能区别SO2和CO2气体的是 ( A )
A.① B.①② C.①②⑤ D.②④⑤
【解析】SO2和CO2气体通入石灰水中,均为先产生白色沉淀后沉淀溶解的现象。
11.下列说法不正确的是 ( C )
A.元素周期表中,除第1和7周期外,第n周期所含非金属元素(包括稀有气体元素)种数均为8-n
B.SiCl4、PCl3、CO2分子中各原子最外层电子均达到八电子稳定结构
C.M层电子为奇数的主族元素所在族的序数与该元素原子的M层电子数不一定相等
D.由IA族和VIA族短周期元素形成的原子个数比为1:1、电子总数为38的化合物,是含有共价键的离子型化合物
【解析】M层电子数为奇数的主族元素原子M层一定是最外层,故该层电子数即为族序数,故C不对,满足D条件的物质为Na2O2,故D正确。
12.向FeCl3、BaCl2的酸性混合溶液中,通入SO2气体有白色沉淀生成,此沉淀是 ( A )
A.BaSO4 B.FeS C.BaSO3 D.S
![]()
![]() 【解析】SO2与氯化钡不反应,当有Fe3+时,SO2与Fe3+反应:2Fe3++SO2+2H2O 2Fe2++SO
【解析】SO2与氯化钡不反应,当有Fe3+时,SO2与Fe3+反应:2Fe3++SO2+2H2O 2Fe2++SO![]() +4H+,SO
+4H+,SO![]() +Ba2+
BaSO4↓。
+Ba2+
BaSO4↓。
13.在水玻璃中通入足量的CO2气体,充分反应后,加热蒸发,再高温灼烧,则最后所得的固体物质为( D )
A.SiO2与NaHCO3 B.SiO2与Na2CO3 C.SiO2 D. Na2SiO3
【解析】CO3与水玻璃反应生成硅酸和NaHCO3,硅酸受热分解生成SiO2,NaHCO3分解生成 Na2CO3,两者高温下可反应:Na2CO3+SiO2 ===Na2SiO3+ CO2,故最终得至固体为Na2SiO3。
14.某单质0.05mol与足量的硫充分反应,质量增加0.8g,则构成这种单质的元素是 (B)
A.铁 B.铜 C.锌 D.铝
【解析】0.8克为S的质量,即参与反应的S为0.025mol,两者按2:1反应,该单质化合价应为+1价。
15.下列实验过程中产生的现象与对应的图形相符合的是 (D)
A.NaHCO3粉末加入HNO3溶液中 B.H2S气体通入氯水中
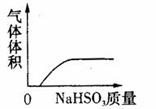
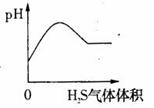
C.NaOH溶液滴入Ba(HCO3)2溶液中 D.CO2气体通入澄清石灰水中
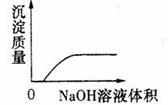
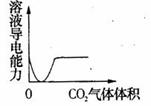
16.下列离子方程式中,书写不正确的是 (B)
![]() A.硫酸亚铁酸性溶液中加入过氧化氢:2Fe2++H2O2+2H+ 2Fe3++2H2O
A.硫酸亚铁酸性溶液中加入过氧化氢:2Fe2++H2O2+2H+ 2Fe3++2H2O
![]() B.硫化亚铁与稀H2SO4反应:2H++S2—
H2S↑
B.硫化亚铁与稀H2SO4反应:2H++S2—
H2S↑
![]() C.二氧仑硅溶于氢化钠溶液:SiO2+2OH—
SiO
C.二氧仑硅溶于氢化钠溶液:SiO2+2OH—
SiO![]() +H2O
+H2O
![]() D.硫化钠溶液中通入氯气:Cl2+S2—
2Cl—+S↓
D.硫化钠溶液中通入氯气:Cl2+S2—
2Cl—+S↓
【解析】FeS为不溶物,写离子方程式时不能拆。
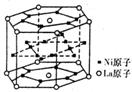 17.氢气是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气。有报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如右图所示。则这种合金的化学式为 (D)
17.氢气是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气。有报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如右图所示。则这种合金的化学式为 (D)
A.LaNi6 B.LaNi3 C.LaNi4 D.LaNi5
【解析】该六棱柱中,La原子位于是12个顶点和上下两个面的面心,个数为12×1/6+2×1/2=3,Ni原子在上、下两个面各6个,侧面6个,内部6个,共12×1/2+6×1/2+6=15个,故比值为1:5。
第I卷答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 |
| 答案 | B | C | D | C | B | D | C | D | A | A | C | A | D | B | D | B | D |
第II卷 非选择题(共57分)
二、非选择题(共57分)
18.(12分)(1)滑石的化学式为Mg3(Si4O10)(OH)2把它改写成氧化物的形式为 3MgO·4SiO2·H2O。
![]() (2)久置的油画,白色部位(PbSO4)常会变黑(PbS),用双氧水揩擦后又恢复原貌,有关反应的化学方程式为 PbS+4H2O2 PbSO4+4H2O
。
(2)久置的油画,白色部位(PbSO4)常会变黑(PbS),用双氧水揩擦后又恢复原貌,有关反应的化学方程式为 PbS+4H2O2 PbSO4+4H2O
。
(3)A、B、C是中学化学中常见的三种气态物质,每个分子中都含有14个电子,其中A的分子属于非极性分子,且只有非极性键;B的分子也是非极性分子,但既有非极性键又有极性键,C的分子属于极性分子,则A的电子式是![]() ,B的结构是
,B的结构是![]() ,
,![]() 的化学式是
的化学式是![]() 。
。
(4)已知氯元素的平均相对原子质量为35.5,由![]() 、
、![]() 和
和![]() 构成的58.5g氯化物晶体中含
构成的58.5g氯化物晶体中含![]()
![]() 的质量是__15__g。
的质量是__15__g。
【解析】(4)已知氯元素相对原子质量可推知,![]() 和
和![]() 的个数比为1:3,
的个数比为1:3,![]()
![]()
19.(6分)(1)往水玻璃中加入盐酸,可生成原硅酸,写出反应的离子方程式
![]() 。
。
(2)原硅酸通过分子间缩水聚合可形成不同的多硅酸(多聚体),如:
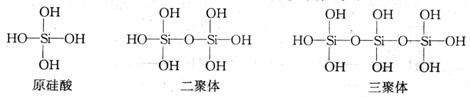
按上述规律,![]() 个原硅酸聚合而成的多硅酸分子的通式是
个原硅酸聚合而成的多硅酸分子的通式是![]() ,此多样硅酸分子中含有4n 个Si-O键。
,此多样硅酸分子中含有4n 个Si-O键。
20.(8分)下图是中学化学中常见的物之间化学反应关系的图示,其中A的焰色反应呈黄色,F为有刺激性气味的气体,E为黄绿色气体,G为强酸性溶液,H为既难溶于水,也难溶于稀酸的白色固体。
试回答:
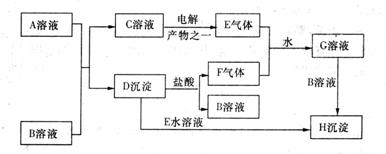
(1)写出化学式:A ![]() B
B ![]()
|
①![]()
②![]()
【解析】E为氯气,则C溶液为![]() 溶液,D沉淀与酸反应生成有还原性和刺激性气味气体,F气体应为
溶液,D沉淀与酸反应生成有还原性和刺激性气味气体,F气体应为![]() ,H为不溶于水和酸的沉淀,可能为氯化银或硫酸钡,本题中因B不可能是硝酸银,故B只能是氯化钡,
,H为不溶于水和酸的沉淀,可能为氯化银或硫酸钡,本题中因B不可能是硝酸银,故B只能是氯化钡,![]() 为硫酸钡,
为硫酸钡,![]() 为
为![]() 。
。
21.(10分)A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期且最外层电子数之和为11,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水,A、D、同主族。
根据以上信息,回答下列问题:
(1)A和D的氢化物中,沸点较低的是![]() (填氢化物的化学式);A和B的离子中,半径较小的是
(填氢化物的化学式);A和B的离子中,半径较小的是![]() (填离子符号);
(填离子符号);
![]() (2)写出B、C的最高价氧化物的水化物相互反应的离子方程式: 。
(2)写出B、C的最高价氧化物的水化物相互反应的离子方程式: 。
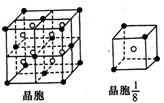
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性能超群的最小重复单元)结构如图所示,阳离子(用其所长“●”表示)于该晶胞的顶点和面心;阴离子(用“○”表示)均位于小正方体中心。该化合物的化学式是 。
![]() (4)已知晶胞1/8的体积为
(4)已知晶胞1/8的体积为![]() ,A和E组成的离子化合物的密度为(结果保留一位小数)
。
,A和E组成的离子化合物的密度为(结果保留一位小数)
。
【解析】由题干可知A、B、C、D分别为F、Na、Al、Cl、HF因分子间存在氢键,故沸点较高,由(3)中图可看出阴、阳离子个数比为2:1,已知阴离子为F—,则阳离子应为+2价,故E为Ca。
22.(12分)某化学兴趣小组为探究铜跟浓硫酸的反应,用下图装置进行有关实验。请回答下列问题:
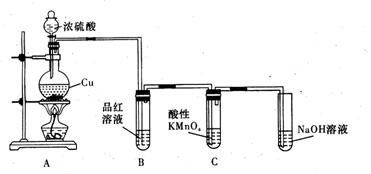 | |||
(1)装置A中发生的化学反应的化学方程式为。
![]() (2)装置B和C都会出现褪色的现象,但原因却不同。B中现象的原因是由于
(2)装置B和C都会出现褪色的现象,但原因却不同。B中现象的原因是由于![]() 具 漂白 性,C中反应的离子方程式为。
具 漂白 性,C中反应的离子方程式为。
(3)为了证明![]() 的氧化性,可将其通入
的氧化性,可将其通入![]() 中。
中。
(4)实验中用一定量铜片和浓硫酸在加热条件充分反应后,最终铜片仍有剩余。根据所学的知识,溶液中一定还有硫酸剩余,请你设计一个简单实验验证(写出具体操作和预期的现象):
取样,冷却后,向其中加入锌粒,若有气泡产生,则说明硫酸没有反应完全(其它合理答案也给分) 。若实验中用![]() 铜片和30mL 18mol/L的浓硫酸反应,假定反应前后溶液的体积不变,剩余硫酸的浓度为
铜片和30mL 18mol/L的浓硫酸反应,假定反应前后溶液的体积不变,剩余硫酸的浓度为![]() ,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾
mol。(用含
,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾
mol。(用含![]() 的代数式表示)
的代数式表示)
![]() 【解析】(3)
【解析】(3)![]() 可氧化
可氧化![]() ,生成S,可将
,生成S,可将![]() 通入氢硫酸中,观察淡黄色沉淀。
通入氢硫酸中,观察淡黄色沉淀。
(4)反应中因浓硫酸变稀,故不能反应完,要证明溶液中有酸剩余,可用锌粒或碳酸盐或指示剂等。再加硝酸钾,要使铜全部溶解,根据电子守恒计算。
![]() 参与氧化还原反应的硫酸为
参与氧化还原反应的硫酸为![]() 设加入
设加入![]()
![]() 23.(9分)已知:
23.(9分)已知:![]() ,向含有
,向含有![]() 的混合溶液中,慢慢地加入足量的稀硫酸,使其充分反应后,得到沉淀
的混合溶液中,慢慢地加入足量的稀硫酸,使其充分反应后,得到沉淀![]() 和标准状况下的气体
和标准状况下的气体![]() 。
。
![]() (1)计算推测当 的取值范围内不同时,
(1)计算推测当 的取值范围内不同时,![]() 的值(用含
的值(用含![]() 的式子表示),并推测所得气体的成分。
的式子表示),并推测所得气体的成分。
|
|
|
| 气体成分 |
|
|
|
|
|
|
| 2 | 0 | 无 |
| >2 | 4 |
|
|
(2)若![]() 写出
写出![]() 关系式
关系式![]() 。
。
【解析】(1)![]() ~
~ ![]() ~
~ ![]()
![]()
![]()
![]() 当 ,
当 ,![]() 与
与![]() 正好完全反应,无气体生成,
正好完全反应,无气体生成,![]() ;
;
![]() 当 >2时,
当 >2时,![]() 过量,与
过量,与![]() 反应的
反应的![]()
![]() 当 <2时,
当 <2时,![]() 过量,与
过量,与![]() 反应的
反应的![]() 为
为![]() ,
,
(2),由![]() 能生成
能生成![]() 生成的S为
生成的S为![]() ,
,
![]()
![]()
由上式如果![]() 完全反应,生成
完全反应,生成![]() ,实际只生成
,实际只生成![]() ,可知
,可知![]() 有剩余,
有剩余,![]() 反应完全,则有
反应完全,则有![]() 。
。