 08届高三化学上学期第二次质量检测试题
08届高三化学上学期第二次质量检测试题
化学试卷 命题人:袁健
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Ca 40 Fe 56 Cu 64
第Ⅰ卷(选择题,共48分)
一、单项选择题(每小题3分,共48分。每小题只有一个选项符合题意。)
1.设NA代表阿伏加德罗常数,下列说法正确的是
A.5.6 g铁与足量盐酸反应转移的电子数为0.3NA
B.100 mL 2.0 mol/L的盐酸与醋酸溶液中氢离子均为0.2NA
C.标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2 NA
D.常温常压下,20 g重水(D2O)中含有的电子数为10NA
2.关于胶体和溶液的叙述中正确的是
A.胶体能透过半透膜,而溶液不能。
B.胶体加入某些盐可产生沉淀,而溶液不能
C.胶体粒子直径比溶液中离子直径大。
D.胶体能够发生丁达尔现象,溶液也能发生丁达尔现象
3.下列叙述正确的是
A.在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原
B.有单质参加的反应一定是氧化还原反应
C.有单质参加的化合反应一定是氧化还原反应
D.失电子难的原子,容易获得的电子
4.在配制一定物质的量浓度的盐酸溶液时,下列错误操作可使所配制溶液浓度偏高的是
A.用量筒量取浓盐酸时俯视读数 B.溶解搅拌时有液体飞溅
C.定容时俯视容量瓶瓶颈刻度线 D.摇匀后见液面下降,再加水至刻度线
5.一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是
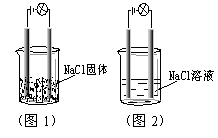 A.NaCl是非电解质
A.NaCl是非电解质
B.NaCl溶液是电解质
C.NaCl在水溶液中电离出了可以自由移动的离子
D.NaCl溶液中水电离出大量的离子
6.下列条件下,两瓶气体所含原子数一定相等的是
A.同质量、不同密度的N2和CO B.同温度、同体积的H2和N2
C.同体积、不同密度的C2H4和C3H6 D.同压强、同体积的N2O和CO2
7.下列离子方程式中正确的是
A.硫酸镁溶液和氢氧化钡溶液反应 SO42-+Ba2+ ==BaSO4↓
B.铜片加入稀硝酸中:Cu +2NO3- + 4H+== Cu2+ + 2NO2↑ + 2H2O
C.FeBr2溶液中加入过量的氯水 2Fe2++2Br-+2Cl2 ==Br2+4Cl-+2Fe3+
D.等体积等物质的量浓度的NaHCO3和Ba(OH)2两溶液混合:
HCO3- + Ba2+ + OH-== BaCO3↓ + H2O
8.氢化钙可以作为生氢剂(其中CaH2中氢元素为-1价),反应方程式如下:CaH2+2H2O=Ca(OH)2+2H2↑,其中水的作用是
A.既不是氧化剂也不是还原剂 B.是氧化剂
C.是还原剂 D.既是氧化剂又是还原剂
9. 在标准状况下,A L NH3溶于B mL水中,得到密度为ρg/cm3的R L氨水,则此氨水的物质的量浓度是
(A)![]() (B)
(B)![]()
(C)![]() (D)
(D)![]()
10.有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的c(Na+)/mol·L-1为
A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a
11.下列有关溶液性质的叙述,正确的是
A.室温时饱和的二氧化碳水溶液,冷却到0℃时会放出一些二氧化碳气体
B.强电解质在水中溶解度一定大于弱电解质
C.相同温度下,把水面上的空气换成相同压力的纯氧,100g水中溶入氧气的质量增加
D.将40℃的饱和硫酸铜溶液升温至50℃,或者温度仍保持在40℃并加入少量无水硫酸铜,在这两种情况下溶液中溶质的质量分数均保持不变。
12.某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KClO3的混合液,经测定ClO-和ClO3-个数比为1:2,则Cl2与KOH溶液反应时,被还原的氯与被氧化的氯的物质的量之比为( )
A.21:5 B.4:1 C.3:l D.11:3
![]() 13.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是:
13.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是:
A.KClO3在反应中得到电子 B.ClO2是氧化产物
C.H2C2O4在反应中被还原 D.1mol KClO3参加反应有2 mol电子转移
14.在海水中提取溴的反应原理是5NaBr+NaBrO+3H2SO4=3Br2 +3Na2SO4+ 3H2O下列反应的原理与上述反应最相似的是 :
A. 2NaBr+Cl2=2NaCl+Br2
B.2FeCl3+H2S=2FeCl2+S+2HCl
C. 2H2S+SO2=3S+2H2O
D.AlCl3+3NaAlO3+6H2O=4Al(OH)3+3NaCl
15. 下列各组离子能在指定溶液中,大量共存的是 :
①无色溶液中:K+,Cu2+,Na+,MnO4—,SO42—
②使pH=11的溶液中:CO32—,Na+,AlO2—,NO3—
③加入Al能放出H2的溶液中:Cl—,HCO3—,NO3—,NH4+
④加入Mg能放出H2的溶液中: NH4+,Cl—,K+,SO42—
⑤使石蕊变红的溶液中:Fe3+,MnO4—,NO3—,Na+,SO42—
⑥酸性溶液中:Fe2+,Al3+,NO3—,I—,Cl—
A ①②⑤ B ①③⑥ C ②④⑤ D ①②④
16.下列离子反应方程式正确的是
A.澄清石灰水来吸收氯气:Cl2+OH-=Cl-+ClO-+H+
B.将金属Na加入冷水中:2Na+2H2O=2Na++2OH-+H2↑
C.向稀硝酸中加入少量铁粉:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
D.在碳酸氢钙溶液中加入少量苛性钾溶液:
Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
 08届高三化学上学期第二次质量检测试题
08届高三化学上学期第二次质量检测试题
第Ⅱ卷(非选择题,共48分)
请同学们把1~16答案填入下表:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
三、填空题(62分)
17.(8分)下列说法中,正确的是(填序号)_____________
A AgCl+NaBr=AgBr+NaCl能在水中进行,是因为AgBr比AgCl更难溶于水
B 用渗析法分离淀粉中混有的氯化银杂质 C 可以用分液漏斗将甘油和水的混合液体分离 D 用碱式滴定管量取20.00毫升高锰酸钾溶液
E 配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止 F 在氢氧化铁胶体中加入少量硫酸会产生沉淀
G硝酸银溶液通常保存在棕色的试剂瓶中,是因为硝酸银见光易分解
18.(8分)工业甲醇的质量分数可以用下列方法测定:
①在稀H2SO4中甲醇被Cr2O72—氧化成CO2和H2O,反应式为:
CH3OH+Cr2O72—+8H+=CO2↑+2Cr3++6H2O;
②过量的Cr2O72—可用Fe2+与之完全反应:
_____Cr2O72—+_____Fe2++_____H+ ——_____Cr3++______Fe3++______H2O
现有0.12 g工业甲醇,在H2SO4溶液中与25 mL 0.2 mol·L-1K2Cr2O7溶液反应,多余的K2Cr2O7再用1 mol·L—1FeSO4与其反应,结果用去FeSO4溶液9.6 mL。
⑴配平第②步中离子方程式。 ⑵工业甲醇的质量分数为 。
19.(8分)用![]() 的硫酸配制
的硫酸配制![]() 硫酸,若实验仪器有:
硫酸,若实验仪器有:
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.20mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
(1)实验时应选用仪器的先后顺序是(填入编号)_________________________。
(2)在容量瓶的使用方法中,下列操作不正确的是(填写编号)___________________。
A.使用容量瓶前检查它是否漏水B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加
6+入蒸馏水到接近标线2cm~3cm处,用滴管滴加蒸馏水到标线
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近容量瓶刻度标线1cm~2cm处,用滴管滴加蒸馏水到刻度线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次
20.(8分)有一无色透明溶液,欲确定是否含有下列离子:Na+、Mg2+、Al3+、Fe2+、Ba2+、NO![]() 、SO
、SO![]() 、Cl-、I-、HCO
、Cl-、I-、HCO![]() ,取该溶液实验如下:
,取该溶液实验如下:
| 实验步骤 | 实验现象 |
| ①取少量该溶液,加几滴甲基橙 | 溶液变红色 |
| ②取少量该溶液,浓缩,加Cu片和浓H2SO4,加热 | 有无色气体产生,后在空气中又变成红棕色 |
| ③取少量该溶液,加BaCl2溶液 | 有白色沉淀生成 |
| ④取③中上层清液,加AgNO3溶液 | 有白色沉淀生成,且不溶于HNO3 |
| ⑤取少量该溶液,加NaOH溶液 | 有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
(1)溶液中肯定存在的离子是________________________。
(2)溶液中肯定不存在的离子是________________________。
(3)为进一步确定其他离子,应该补充的实验是________ _ ________
。
21.(6分)将5.1 g镁铝合金溶于600 mL 0.5 mol·L-1H![]() SO
SO![]() 溶液中,完全溶解后再加入
溶液中,完全溶解后再加入
1.0 mol·L-1的NaOH溶液,得到沉淀的质量为13.6 g,继续滴加NaOH溶液时则沉淀会减少。
(1)当加入
▲ mLNaOH溶液时,可使溶解在硫酸中的Mg![]() 和Al
和Al![]() 恰好完全沉淀。
恰好完全沉淀。
(2)计算合金溶于硫酸时所产生的氢气在标准状况下的体积。(列出算式)
22.(12分)由乙烯和其他无机原料合成环状化合物其合成过程如下(水及其他无机产物均已省略):
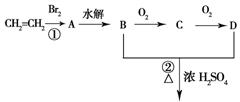
![]()
请分析后回答下列问题:
(1)反应的类型分别是①___________、②________________;
(2)D物质中的官能团为___________________________;
(3)C物质的结构简式___________________,物质X与A互为同分异构体,则X
的结构简式为_________________,X的名称为_______________________________;
(4)B、D在一定条件下除能生成环状化合物E外,还可反应生成一种高分子化合物,试写出B、D反应生成该高分子化合物的方程式
23.(12分)臭氧(O3)能与KI溶液反应, 生成氧气等。在反应后的溶液中滴入酚酞变为红色。若滴入淀粉则变为蓝色。为测定环境中空气的臭氧含量, 将0℃、1.01×105Pa的空气33.6m3通过KI溶液, 使反应完全, 在所得溶液中用0.0100mol·L-1的Na2S2O3溶液60.0mL恰好滴定达终点, 反应为:
![]()
(1)臭氧通入KI溶液中的化学方程式是 ,每消耗1molO3,转移__________ mol e-
(2)计算大气中臭氧的体积分数。(写出计算过程)
第Ⅱ卷(非选择题,共64分)
请同学们把1~16答案填入下表:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | D | C | C | C | C | A | D | B |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | A | A | D | D | A | C | C | B |
17. (6分每空2分). AEFG(
18.(11分)⑴1、6、14、2、6、7 (2分)
⑵由反应②可知,反应①剩余的n(Cr2O72—)=![]() n(Fe2+)=0.0016 mol (3分)
n(Fe2+)=0.0016 mol (3分)
反应①消耗的n(Cr2O72—)=0.0050 mol-0.0016 mol=0.0034 mol
则n(CH3OH)=0.0034 mol (3分)
w(CH3OH)=![]() ×100%=90.7%
(3分)
×100%=90.7%
(3分)
19.(1)G、E、C、H、F或E、G、C、H、F (3分) (2)B、C、D(3分)
20.(8分)(1)Mg2+、Al3+、NO![]() 、SO
、SO![]() (2分)
(2分)
(2)Fe2+、Ba2+、I-、HCO![]() (2分)
(2分)
(3)焰色反应,取少量原溶液,加入Ba(NO3)2溶液后,取上层清液加入AgNO3溶液和稀HNO3(4分)
21.600 5.6L
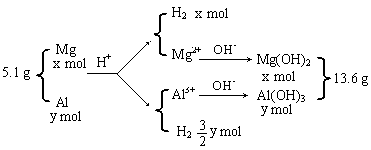
![]()
![]() 列式: 24x+27y=5.1 解得: x=0.1
列式: 24x+27y=5.1 解得: x=0.1
58x+78y=13.6 y=0.1 (3分)
氢气的体积为:(0.1+![]() ×0.1)×22.4=5.6(L)(1分) 其它合理解法参照给分。
×0.1)×22.4=5.6(L)(1分) 其它合理解法参照给分。
22.加成 酯化 羧基 OHC-CHO 1.2-二溴乙烷
23、(8分)
(1)2KI + O3 + H2O = 2KOH + O2 + I2 (2分) 2 (2分)
(2)(4分)解: n(Na2S2O3) = 0.0100mol·L-1×60.0×10-3L = 6.00×10-4mol(1分)
设: 33.6m3空气中O3的物质的量为x。
关系式:
2Na2S2O3 ~ O3 (1分)
2mol 1mol
6.00×10-4mol x
x = 3.00×10-4mol (1分)
空气中O3的体积分数 = ![]() = 2.00×10-5%(2分)
= 2.00×10-5%(2分)