08届高三化学上学期调研测试
化 学
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共120分,考试时间100分钟。
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27
Cl:35.5 K:39 Ca:40 Fe:56 Cu:64 Br:80 I:127 Ba:137
第Ⅰ卷(选择题 共56分)
一、选择题(本题包括8小题,每小题3分,共24分,每小题只有一个正确选项符合题意。)
1.下列说法正确的是
A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
C.Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到
D.活性炭、SO2和HClO都具有漂白作用,且漂白的化学原理相同
2.氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是
A.氧元素的氢化物只有H2O一种
B.NH3分子的结构式为:![]()
C.HCl的电子式为:
D.同主族元素的氢化物沸点均随着分子量增大而升高
3.关于某溶液所含离子检验的方法和结论正确的是
A.加入NaOH溶液,有白色沉淀生成,则原溶液一定有Al3+
B.加入AgNO3溶液有白色沉淀生成,加稀盐酸沉淀不消失,则原溶液一定有Cl-
C.加入盐酸产生能使澄清石灰水变浑浊的气体,则原溶液中可能有CO32-或SO32-
D.加入NaOH溶液并加热,产生使湿润的蓝色石蕊试纸变红的气体,则原溶液中一定含NH4+
4.为检验CH3CH2Br中的Br元素,有下列实验操作可供选择:
①加热煮沸 ②加入适量AgNO3溶液 ③取少量CH3CH2Br ④加入适量稀硝酸酸化 ⑤加入适量NaOH溶液 ⑥冷却。最佳操作的先后顺序是
A.③④② B.③⑤①⑥②
C.③⑤①⑥②④ D.③⑤①⑥④②
5.将CO2持续通入下列几种饱和溶液:①Na2CO3;②Na2SiO3;③NaAlO2;④Ca(ClO)2;⑤CaCl2;⑥NH3和NaCl;⑦Ca(OH)2,最终能得到沉淀的是
A.①②③⑥ B.④⑤⑦ C.②④⑦ D.②③④⑤
6.有关基本实验有:
①用FeCl3溶液鉴别乙醇溶液和苯酚溶液
②用溴水检验汽油中是否含有不饱和脂肪烃
③将浓硫酸沿玻璃棒缓缓注入盛水的量筒中,边加边搅拌,以使产生的热量迅速散失
④用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸
⑤仅用蒸馏水鉴别蔗糖、硫酸铜粉末、碳酸钙粉末
⑥配制一定物质的量浓度的溶液,需要的玻璃仪器只有容量瓶和烧杯
⑦用玻璃棒蘸取溶液滴在pH试纸中央,测试该溶液的pH
⑧在250mL烧杯中,加入216mL水和24gNaOH固体,配制10%NaOH溶液。
下列实验或操作不合理的是
A.①③⑤⑥ B.③④⑥⑧ C.②④⑤⑧ D.①③④⑦
7.下列各组离子在指定溶液中能大量共存的是
①无色溶液中:K+、Cu2+、Na+、MnO4-、SO42-
②使pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、NO3-、NH4+
④在由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、I-
⑤能使pH试纸变为蓝色的溶液:Na+、C1-、S2-、SO32-
⑥酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl-
A.①②⑤ B.①③⑥ C.②④⑤ D.①②④
8.核磁共振造影增强剂用于疾病的诊断,还可以作为药物载体用于疾病的治疗。中科院化学研究所在肿瘤鉴别诊断用磁共振造影剂研究方面取得重要进展。为磁性纳米晶体材料在生物医学领域的应用提供了更广泛的前景。制备纳米四氧化三铁过程如下:
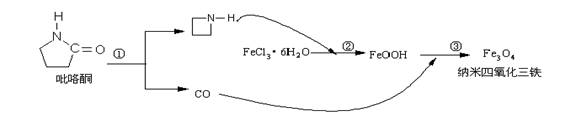
下列有关叙述不合理的是:
A.纳米四氧化三铁具有磁性作为药物载体用于疾病的治疗
B.反应③的化学方程式是:6FeOOH +CO = 2Fe3O4 +3H2O + CO2
C.在反应②环丙胺的作用可能是促进氯化铁水解
D.纳米四氧化三铁分散在适当溶剂中,它与溶液分散质直径相当
二、选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个,该小题就为0分)
9.微观粒子是化学研究的主要对象。若阿伏加德罗常数为6.02×1023mol—1,下列对粒子数判断正确的是
A.6.2g氧化钠和7.8g过氧化钠混合物中所含有的离子数为0.7×6.02×1023
![]()
![]() B.2.8g
[CH2—CH2 ]n 中含有的碳原子数为0.2×6.02×1023
B.2.8g
[CH2—CH2 ]n 中含有的碳原子数为0.2×6.02×1023
C.5.6 g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023
D.标准状况下,22.4LCH4和CH3Cl的混合物所含有的分子数目为6.02×1023
10.下表为各物质中所含有的少量杂质,以及除去这些杂质应选用的试剂或操作方法。
正确的一组为
| 序号 | 物质 | 杂质 | 除杂质应选用的试剂或操作方法 |
| ① | KNO3溶液 | KOH | 加入FeCl3溶液,并过滤 |
| ② | FeSO4溶液 | CuSO4 | 加入过量铁粉,并过滤 |
| ③ | H2 | CO2 | 通过盛有NaOH溶液的洗气瓶,再通过盛有浓硫酸的洗气瓶 |
| ④ | NaNO3 | CaCO3 | 溶解、过滤、蒸发 |
A.①②③④ B.③④ C.②③④ D.①②③
11.茉莉醛具有浓郁的茉莉花香,其结构简式如下所示: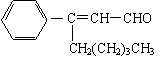
关于茉莉醛的下列叙述不正确的是
A.茉莉醛与苯甲醛互为同系物
B.在加热和催化剂作用下,能被氢气还原生成一种芳香醇
C.一定条件下,能被银氨溶液、新制氢氧化铜等多种氧化剂氧化
D.不能与氢溴酸发生加成反应
12.下列反应的离子方程式书写不正确的是
A.4mol/L的NaAlO2溶液和7mol/L的HCl等体积互相均匀混合:
4AlO2―+7H++H2O![]() 3Al(OH)3↓+Al3+
3Al(OH)3↓+Al3+
B.在Mn2+的溶液中加入HNO3,再加入PbO2,得紫红色溶液:
5PbO2+2Mn2++4H+![]() 5Pb2++2MnO4-+2H2O
5Pb2++2MnO4-+2H2O
C.将0.1mol/L盐酸数滴缓缓滴入0.1mol/L25mLNa2CO3溶液中,并不断搅拌:
2H++CO32-![]() CO2↑+H2O
CO2↑+H2O
D.硫酸氢钠溶液与足量氢氧化钡溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O
13.氯酸是一种强酸,室温下,浓度超过40%时就会发生分解,反应可表示为:
a HClO3 = bO2↑+ c Cl2↑+ d HClO4 + e H2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是
A.由反应可确定:氧化性HClO4>HClO3
B.变蓝的淀粉碘化钾试纸褪色是因为可能发生了:
5C12 + I2 + 6H2O = 12H+ + 10Cl- + 2IO3-
C.若氯酸分解所得混合气体,lmol混合气体质量为52.5g,则反应方程式可表示
26HClO3 = 15O2↑+ 8C12↑+ 10HClO4 + 8H2O
D.若化学计量数a=8,b=3,则该反应转移电子数为20e—
14.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、
Ba2+、CO32-、SO42-,分别取三份各100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是
A.K+一定存在 B.Cl-可能存在
C.100mL溶液中含0.01mol CO32- D. Ba2+一定不存在,Mg2+可能存在
15.相对分子质量为M的气态化合物V L(已换算成标准状况)溶于m g水中,得到溶液的质量分数为ω%,物质的量浓度为c mol/L,密度为ρ g·cm-3,则下列说法正确的是
A.相对分子质量M可表示为:![]()
B.物质的量浓度C可表示为:![]()
C.溶液的质量分数ω%可表示为:![]()
D.溶液密度ρ可表示为:![]()
16.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同。下列事实不能说明上述观点的是
A.苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应
B.乙烯能发生加成反应,乙烷不能发生加成反应
C.甲苯能使酸性高锰酸钾溶液褪色,乙烷、苯不能使酸性高锰酸钾溶液褪色
D.苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应
第Ⅱ卷(非选择题 共64分)
 三、(本题包括2小题,共22分。)
三、(本题包括2小题,共22分。)
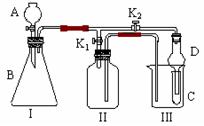
17.(10分)某兴趣小组同学共同设计了如图所示的实
验装置。该装置既可用于制取气体,又可用于验证物
质的性质。
(1)打开K1关闭K2,可制取某些气体。
甲同学认为装置I可用于制取H2、NH3、O2,但装置II只能收集H2、NH3,不能收集O2。其理由是 ▲ 。
(2)乙同学认为在不改动装置II仪器的前提下,对装置II进行适当改进,也可收集O2。
你认为他的改进方法是 ▲ 。
(3)打开K2关闭K1,能比较一些物质的性质。
丙同学设计实验比较氧化性:KMnO4>Cl2>Br2。将A中的浓盐酸加入B中一段时间后,观察到C中的现象是 ▲ ;仪器D在该装置中的作用是 ▲ 。
(4)打开K2关闭K1,丁同学用石灰石、醋酸、苯酚钠等药品设计了另一实验。他的实验目的是 ▲ 。
18.(12分)某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答: ▲ (填“合理”或“不合理”)
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是 ▲ ,反应的离子方程式为 ▲ 。
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是 ▲ (填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。
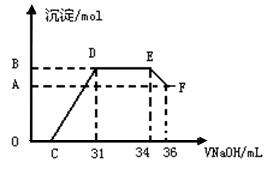 试回答下列问题:
试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为 ▲ 。
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为 ▲ ;上述现象说明溶液中___ ▲ _结合OH-的能力比
▲ 强(填离子符号)。
(3)B与A的差值为 ▲ mol。
(4)B点对应的沉淀的物质的量为 ▲ mol,C点对应的氢氧化钠溶液的体积为 ▲ mL
四、(本题包括2小题,共16分。)
19.(8分)碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:
6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2
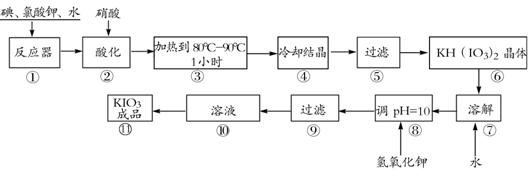
(1)步骤①反应器发生的反应中,转移电子总数为 ▲ ;
(2)步骤②中,用硝酸而不用HI,其原因可能是 ▲ ;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为 ▲ ;
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是 ▲ 。
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
20.(8分)下图是一些常见元素的单质或化合物之间的转化关系。溶液中的水以及部分反应物或生成物未标出。A、E是空气中的两种主要成分,C是由两种元素组成的新型材料,且和SiC具有相同的价电子数和原子数,J是一种能引起温室效应的气体,K是两性化合物。反应③、④、⑤用于工业中生产H。
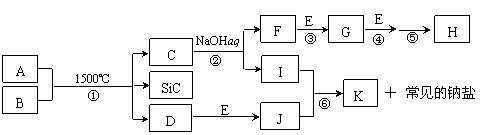 |
回答下列问题:
⑴ 写出下列物质的化学式:F ▲ ,I ▲ ;
⑵ 写出反应③的化学方程式: ▲ ;
⑶ 写出反应⑥的离子方程式: ▲ ;
⑷ B和SiC的纳米级复合粉末是新一代大规模集成电路理想的散热材料。反应①是科学家研究开发制备该纳米级复合粉末的最新途径。已知B由Si及另外两种元素组成,且Si与另外两种元素的物质的量之比均为1∶4,写出反应①的化学方程式: ▲ 。
 五、(本题包括1小题,共10分)
五、(本题包括1小题,共10分)
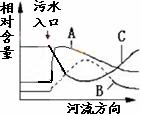
21.(10分)水体污染问题是目前人们十分关注的环境问题之一,下图是某河流受到城市生活污水(主要含有机物)的轻度污染,以及水体自身净化部分示意图。请回答有关问题:
(1)图中绘出的三种曲线分别代表氮、磷等无机盐总量,水中氧气溶解量(DO),有机物溶解量,其中表示水中DO变化曲线的是 ▲ (选填A、B、C)
(2)目前推广使用无磷洗衣粉,并提倡科学合理施用化肥,其目的是防止水体
▲ (填与环境相关的术语)。
(3)某研究性学习课题小组拟调查测定本地区水质污染情况,如果你是课题小组成员,现要取三份不同地区的水样,你选择的三个地点是:
① ▲ ② ▲ ③ ▲
![]() (4)氨在水体中化学降解时,是水体中两种不同的硝化细菌分两步,将其逐步氧化的,过程如下:
。
(4)氨在水体中化学降解时,是水体中两种不同的硝化细菌分两步,将其逐步氧化的,过程如下:
。
某同学在该地工业园区取得水样,准备检测其中无机氮的含量,查阅工具书后,决定先检测水样中的铵或氨的浓度,反应原理为2K2[HgI4]+NH4Cl+4KOH==(OHg2NH2)I(红色)+KCl+7KI+3H2O,用比色法(比较颜色的深浅的测定方法)测定。
①比色法能测定其中NH3—NH4+浓度的大小,其判断的依据是 ▲ 。
②若测得的含量异常偏高,再用其他方法测得NO2—和NO3—含量也偏高。可能的原因是 ▲ 。
A、可能是硝酸工厂大量排出的含硝酸的废水
B、合成氨厂,刚排放的溶有氨的废水
C、造纸厂排出的有机废水和合成氨厂排出的溶有氨的废水
六、(本题包括2小题,共16分。)
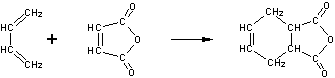
22.(8分)下面是有名的Diels-Alder反应的一个实例:
以某链烃A为起始原料合成化合物G的路径如下(图中Mr表示相对分子质量):
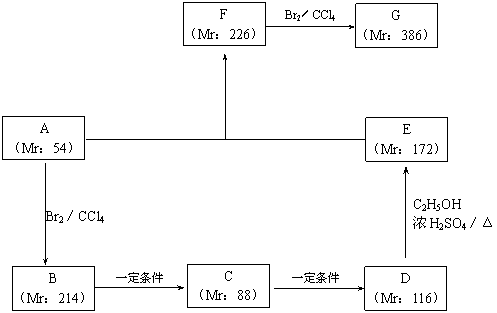
(1)指出反应类型:B→C : ▲ ,F→G : ▲ 。
(2)写出下列物质的结构简式:A : ▲ ,F : ▲ 。
(3)写出下列反应的化学方程式:B → C : ▲ ;D → E : ▲ 。
23.(8分)己二酸[HOOC(CH2)4COOH]是制造尼龙66、聚氨基甲酸酯弹性纤维、润滑剂、增塑剂等的重要中间体,工业生产上需求很大。己二酸的传统生产方法是从石油或煤中提取的苯为原料,经下列反应合成的:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 石油、煤
苯 环己烷
环己酮和环己醇
己二酸
石油、煤
苯 环己烷
环己酮和环己醇
己二酸
(1)上述流程中x的化学式为 ▲ ;
属于氧化反应的除了④外还有 ▲ (填序号)。
(2)这种合成己二酸的方法曾被认为是现代合成有机化学的最伟大的成就之一。然而从绿色化学的要求看,这一工艺存在严重缺陷,它是:原料来源(石油、煤)是不可再生的;氧化过程中使用了具有腐蚀性的浓HNO3;以及_ ▲ 。
(3)现代化学家已开发出了生产己二酸的生物技术路线:由淀粉(或纤维素)制取的葡萄糖[CH2OH(CHOH)4CHO]为原料,利用DNA重组技术改进的细菌,将葡萄糖氧化为己二烯二酸(HOOC-CH=CH-CH=CH-COOH),然后在催化剂的作用下加氢制备己二酸,请你完成该合成路线的化学方程式。
① ▲ ;
![]() ②2CH2OH(CHOH)4CHO+O2
②2CH2OH(CHOH)4CHO+O2
2HOOC-CH=CH-CH=CH-COOH+6H2O
③ ▲ 。
08届高三调研测试化学参考答案
1.B 2.B 3.C 4.D 5.A 6.B 7.C 8.D
9.BD 10.C 11.AD 12.C 13.BD 14.AB 15.AD 16.B
17.(共10分)
(1)氧气的密度比空气大(2分);
(2)将装置II中装滿水(其它合理答案参照给分) (2分);
(3)溶液呈橙色等(其它合理答案参照给分)(2分);防止倒吸(2分);
(4)比较醋酸、碳酸和苯酚的酸性:CH3COOH >H2CO3>C6H5OH等(2分)
(其它合理答案参照给分)。
18.(共12分)
Ⅰ(1)合理 (1分)
(2)NaOH溶液(1分);2Al+2OH-+2H2O=2AlO2-+3H2↑(2分)。
(3)B(1分)
Ⅱ(1)H++OH-=H2O(1分)
(2)NH4++OH-=NH3·H2O(1分);Al3+、Fe3+、H+(1分);NH4+(1分)
(3)0.008 (1分)
(4)0.032(1分); 7(1分)。
19.(8分)
(1)60(2分)
(2)HI具有还原性,能将已生成的碘酸氢钾还原(2分)
(3)Cl2能将KIO3氧化成KIO4(2分)
(4)蒸发结晶(2分)
20.(共8分)
⑴ NH3 (1分) NaAlO2 (1分)
⑵ (2分)
⑶![]() CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32-(2分)
CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32-(2分)
或CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
⑷ Al4SiC4+2N2![]() 4AlN+SiC+3C(2分)
4AlN+SiC+3C(2分)
21.(共10分)
(1)C(2分);
(2)防止水体富营养化(水华、赤潮等均可)(2分);
(3)化工厂周围河流,城市周围河流,农村河道等(只要具有代表性,不重复即可,各1分,共3分)。
(4)①其颜色深浅与含氮量(或浓度)成正比(1分);② B、C(2分)。
22.(8分)
(1) B→C :取代反应(或水解反应),F→G :加成反应(各1分)。
(2)
A : CH2=CH-CH=CH2 ,F : ![]() (各1分)。
(各1分)。
(3)
B → C :CH2Br-CH=CH-CH2Br+H2O![]()
HOCH2-CH=CH-CH2OH+2HBr(2分);
D
→ E :HOOC-CH=CH-COOH+2C2H5OH![]()
C2H5OOC-CH=CH-COOC2H5+2H2O (2分)。
23.(8分)
(1)H2(1分) ③(1分)
(2)氧化过程中产生对环境有污染的气体(2分)
![]()
![]() (3)①(C6H10O5)n+nH2O
nCH2OH(CHOH)4CHO
(3)①(C6H10O5)n+nH2O
nCH2OH(CHOH)4CHO
(2分,不写反应条件不扣分,但化学式写错则全部扣分,未配平扣1分,下同)
③HOOC-CH=CH-CH=CH-COOH+2H2![]() HOOC(CH2)4COOH(2分)
HOOC(CH2)4COOH(2分)