08届高三化学卤素复习测试
一、选择题(下列各题只有1个选项符合题意。48分)
1.“绿色化学”的主要内容之一是指从技术、经济上设计可行的化学反应,使原子充分利用,不产生污染物。下列化学反应符合“绿色化学”的是 ( )
A.制CuSO4:Cu + 2H2SO4(浓) = CuSO4 + SO2↑+ 2H2O
B.制CuSO4:2Cu + O2 = 2CuO; CuO + H2SO4(稀) = CuSO4 + H2O
C.制Cu(NO3)2:Cu + 4HNO3(浓) = Cu(NO3)2 +2NO2↑+ 2H2O
D.制Cu(NO3)2:3Cu + 8HNO3(稀) = 3Cu(NO3)2 +2NO↑+ 4H2O
2.氯磺酸(ClSO3H)是一元强酸,它能与甲酸发生反应:HCOOH+ClSO3H→CO+HCl+H2SO4,下列说法正确的是 ( )
A.反应后溶液的酸性增强 B.ClSO3H被还原
C.HCOOH是还原剂 D.该反应是氧化还原反应
3.最近科学研究表明,用氯气杀灭自来水中的病菌并非良好方法,氯胺(![]() )在中性或酸性条件下是一种更好的强消毒剂,氯胺的消毒原理之一是 ( )
)在中性或酸性条件下是一种更好的强消毒剂,氯胺的消毒原理之一是 ( )
A.![]() B.
B.![]()
![]()
![]()
C.![]() D.
D.![]()
![]()
![]()
4.下列物质加入溴水,经振荡,因发生化学反应而使溴水褪色的是 ( )
①Na2S ②NaOH ③乙酸 ④镁粉 ⑤裂化汽油 ⑥甲苯
A.①②③⑤ B.②④⑤⑥ C.①②④⑤ D.②③④⑥
5.在一定条件下,RO3n—和氟气发生如下反应:RO3n—+F2+2OH— RO4—+2F—+H2O,从而可知在RO3n—中,元素R的化合价是 ( )
A.+4 B.+5 C.+6 D.+7
6.化合物甲是由氟元素和氧元素形成的一种不稳定的物质,10mL甲气体可分解成15mL O2和10mL F2(气体都在同温同压下测定)。下列关于化合物甲的说法正确的是 ( )
A.该化合物的分子式为O2F2 B.其电子式可表示为F:O:O:O:F
C.甲具有很强的氧化性 D.甲中氧元素的化合价为-
7、实验室用浓盐酸与二氧化锰反应制取氯气,下列有关说法中正确的是( )(气体体积在标准状况下测定)
A.若提供0.4 mol HCl,MnO2不足量,则可制得氯气2.24 L
B.若提供0.4 mol HCl,MnO2过量,则可制得氯气2.24 L
C.若有0.4 mol HCl参与反应,则可制得氯气2.24 L
D.若有0.4 mol HCl被氧化,则可制得氯气2.24 L
8、下列关于氯水的叙述,正确的是( )
A.新制氯水中只含Cl2和H2O分子 B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡逸出,该气体是Cl2 D.氯水放置数天后PH值将变大
9、某一无色溶液,若向其中加入足量饱和氯水,溶液呈橙黄色;再向橙黄色溶液中滴加BaCl2溶液,产生白色沉淀;若向原溶液中加入铝粉,有气体放出。该溶液可能大量存在的一组离子是( )
A.K+、H+、NO3-、Na+
B.H+、Br-、SO![]() 、Na+
、Na+
C.SO![]() 、Br-、OH-、Fe3+ D.H+、Br-、SO
、Br-、OH-、Fe3+ D.H+、Br-、SO![]() 、K+
、K+
10、下列有关氯元素单质及化合物的性质的说法正确的是( )
A.液氯是纯净物,而氯水是电解质,漂白粉是混合物
B.氯气可用作消毒剂和漂白剂,是因为氯分子具有强氧化性
C.随着化合价的升高,氯的含氧酸酸性和氧化性均逐渐增强
D.氯化铝受热易升华,加压下加热得到熔融氯化铝不导电,故氯化铝是共价化合物
11、泽维尔用飞秒(时间单位:1飞秒=10-15秒)激光技术研究了氰化碘(ICN)的分解反应 ICN→I+CN,发现该变化可在200飞秒内完成。已知(CN)2和卤素的性质相似。以下有关ICN的叙述中正确的是( )
A.ICN不能和NaOH溶液反应 B.ICN是一种共价化合物
C.将ICN加入到氯水中可生成I2 D. ICN的晶体是离子晶体
12.有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂溶解在亚硫酰氯(SOCl2)中形成,电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S,已知亚硫酰氯和AlCl3·6H2O混合共热蒸干,可制得无水AlCl3,则下列叙述正确的是
A 电解质溶液中混入水,对电池反应无影响
B 金属锂作电池的负极,石墨作电池的正极
C 电池工作过程中,SOCl2 被还原为Li2SO3
D 电池工作过程中,负极消耗锂与正极区析出的S的质量之比为7:8
 二、填空题
二、填空题
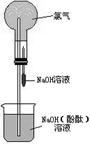
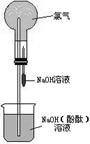
13、(10分)某研究性学习小组在做氯气的喷泉实验时(装置如图),发现含有酚酞的NaOH溶液喷入烧瓶后,溶液的红色褪去。甲、乙两位同学对此现象分别做了如下推测:
甲:因为氯气与NaOH溶液反应,使溶液碱性减弱甚至呈酸性.所以溶液红色褪去。乙:因为氯气溶于水并与水反应生成HClO.由于HClO的氧化漂白作用而使溶液褪色。
(1) 验证甲同学的推测是否正确的方法是:
;
验证乙同学的推测是否正确的方法是:
;
(2)如果将NaOH溶液改成酸性KMnO4溶液,把Cl2换成SO2气体,试问用图示所给装置完成喷泉实验是否合理?________________(填“合理”或“不合理”).如果认为不合理,请说明你的理由 .
(3)类似“褪色喷泉实验”还有多种“变色的喷泉实验”,请按实验要求,分别设计1个“变色喷泉实验”并填写下列表格:
| 编号 | 实验要求 | 烧杯中的溶液 | 滴管中的液体 | 烧瓶中的气体 |
| ① | 无色变红色喷泉 | H2O | ||
| ② | 红色变无色喷泉 | SO2 |
14.(16分)亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO与Cl2在通常条件下反应得到。亚硝酰氯(ClNO)有关性质如下:
| 分子式 ClNO | 别名 氯化亚硝酰 | 溶解性 溶于浓硫酸 |
| 熔点 -64.5℃ | 沸点 -5.5℃ | 性状 红褐色液体或有毒气体,具有刺激恶臭,遇潮湿空气分解成氮的氧化物与氯化氢 |
某研究性学习小组根据亚硝酰氯(ClNO)性质拟在通风橱中制取亚硝酰氯,设计了如下实验装置。如图所示。实验开始前K1、K3均已关闭,但K2却打开着。、
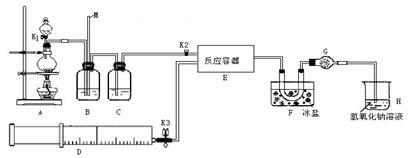
试回答下列问题:
(1) 如何检查A、B、C所组成的实验装置气密性? 。
(2)若D中装有纯净的NO气体,请写出实验室里A装置产生气体的离子方程式 ;B中应选用最佳试剂为 ,B的作用为:① ;② 。
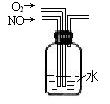
(3)F中U型管的作用: ;实验现象是 ;干燥管G作用: 。
(4) 某同学认为氢氧化钠溶液只能吸收氯气和ClNO,但不能吸收NO。所以装置H不能有效除去有毒气体,写出你改进措施: 。
15.(16分)在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
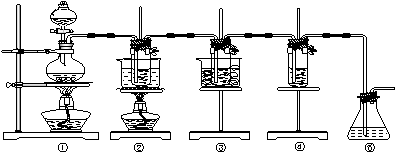

图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过_____________(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_______(填写下列编号字母)的净化装置。
(A)碱石灰 (B)饱和食盐水 (C)浓硫酸 (D)饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是:_______________________________ _________________________________________________________________________。
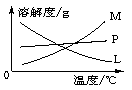
反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是_______(填写编号字母);从②的试管中分离出该晶体的方法是__________(填写实验操作名称)。
(3)本实验中制取次氯酸钠的离子方程式是______________________________________。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为_______色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | _______________________________ |
| 然后溶液从无色逐渐变为_______色 | _______________________________ |
三、计算题(10分)
16、少量的碘化物可用以下方法进行测定,其步骤如下:
①在中性或弱酸性介质中先用过量的Br2将试样中I-氧化成IO3-;
②煮沸①所得溶液以除去过量的Br2,然后在酸性条件下加入过量的KI溶液,将IO3-还原为I2;
③在②中加淀粉作指示剂,用Na2S2O3标准溶液滴定(2Na2S2O3+I2=2NaI+Na2S4O6)。
通过上述步骤可测得碘化物中I-的含量。 要求:
⑴写出步骤①②中发生反应的离子方程式:
①
②
⑵若样品中有1mol I-,则最后耗用Na2S2O3的物质的量是多少?
⑶若在测定时,准确取含KI的样品溶液25.00mL,终点时耗用0.100mol/L Na2S2O3 20.06mL,试计算试液中KI的含量(g/L)。
卤 素
参考答案
一、选择题1-12 BABCB CCBBD BD
 二、填空题
二、填空题
13.(1)取烧瓶中的无色溶液加入足量的NaOH溶液,如果溶液恢复红色,则可证明甲同学的推测是正确的;如果加入足量的NaOH溶液不能恢复红色,则说明乙同学的推测是正确的。
(2)不合理; KMnO4溶液可与橡胶塞反应,也不能盛放在倒置的胶头滴管中
| 编号 | (其他合理答案照此给分) | |||
| ① | 酚酞试液 | NH3 | ||
| ② | NaOH(酚酞) | NaOH溶液 | ||
(3)
14. (16分)(1)关闭K2,B装置中加入适量的水浸没导气管下口,用酒精灯微热烧瓶或双手掌紧握烧瓶外壁,若B装置中的M导管内水柱上升,并稳定不下降,说明气密性良好(2分)
(2)MnO2 + 4 H+ + 2 Cl-= Mn2+ +Cl2 + 2 H20 (2分)
饱和食盐水 除去氯气中的氯化氢 安全瓶作用(防止装置阻塞引起实验事故)(3分)
(3)冷凝收集亚硝酰氯(ClNO) 有红褐色液体生成 防止水蒸气进入U型管使ClNO分解(3分)
(4)在G和H之间插入如下图装置(2分)
15[答案](1)分液漏斗;B。 (2)碱溶液(或反应物)的浓度不同,反应温度不同; M; 过滤。
(3)Cl2+2OH- = ClO-+Cl-+H2O。 (4)
| 红 | |
| 氯气与水反应生成HClO将石蕊氧化为无色物质 | |
| 黄绿 | 继续通入的氯气溶于水使溶液呈黄绿色 |
三、计算题(10分)
16、⑴①3Br2+I-+3H2O=IO3-+6Br—+6H+ ②6H++IO3-+5I-=3I2+3H2O
⑵6mol ⑶2.22g/L