高三年级化学第一学期期末考试
化 学 试 题
本卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分100分。考试时间90分种。
可能用到的相对原子质量:H—1 C—12 N—14 O—16 S—32 Cl—35.5 Na—23
第Ⅰ卷
注意事项:
1.答第Ⅰ卷前,考生必将自己的姓名、考号、考试科目、试卷类型(A)涂写在答题卡上。考试结束时,将试题和答题卡一并交回。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号,不能答在试题卷上。
3.本卷包括15小题,每小题3分,共45分。每小题只有一个选项符合题意。
一、选择题(本大题共40小题,每小题1.5分,共计60分。在每小题列出的4个选项只有一项是最符合题目要求的)
1.下列叙述正确的是 ( )
①工业上合成非氧 化物陶瓷氮化硅(Si3N4)需要在高温、空气气氛中进行
②钢铁制品锈蚀主要是因为钢铁中含有碳而发生原电池反应,因此生铁炼钢时要尽可能完全除去生铁中的碳
③建设三峡大坝需要使大量水泥,水泥是硅酸盐材料
④夏天人们佩戴由添加氧化亚铜的二氧化硅玻璃制作的变色眼镜来保护眼睛
⑤太阳能电池可采用硅材料制作,其应用利于环保、节能
A.①②③ B.②④ C.③④⑤ D.③⑤
2.下列说法中正确的是 ( )
①元素的相对原子质量是该元素原子的质量与一个12C原子质量的![]() 的比值
的比值
②质子数相同的微粒一定属于同一种元素
③分子是保持物质性质的一种微粒
④原子是物质变化中的最小微粒
⑤同一种元素组成的单质是纯净物
A.均不正确 B.②⑤正确 C.③④正确 D.①②正确
3.下列离子在溶液中可以大量共存,且向溶液中加入铝粉能产生氢气的是 ( )
A.K+、Cl-、Na+、SO![]() B.Na+、OH-、Cl-、Ba2+
B.Na+、OH-、Cl-、Ba2+
C.H+、Cl-、Fe2+、NO![]() D.Cu2+、OH-、CO
D.Cu2+、OH-、CO![]() 、Na+
、Na+
4.NA表示阿伏加德罗常数的值,下列叙述中正确的是 ( )
A.1L 1mol·L-1醋酸溶液中离子总数为2NA
B.标准状况下,22.4LH2中含中子数为2NA
C.46gNO2和N2O4混合气体中含有的原子数为3NA
D.1mol-OH中所含电子数为10NA
5.下列叙述错误的是 ( )
A.第ⅦA族的砹化银见光容易分解,难溶于水
B.第ⅥA族的H2O、H2S、H2Se随着相对分子质量的增大,沸点逐渐升高
C.第ⅣA族的H2CO3比H2SiO3酸性强,故将CO2通入Na2SiO3溶液中有H2SiO3析出
D.第ⅢA族的氢氧化铊[Tl(OH)3]不一定呈两性
6.某温度下,100g饱和氯化钠溶液中含有氯化钠26.5g。若向此溶液中添加3.5g固体氯化钠和6.5g水,则所得溶液的溶质质量分数是 ( )
A.30% B.![]()
C.26.5% D.![]()
7.常温时,下列四种液体pH最小的是 ( )
A.![]() 的醋酸与
的醋酸与![]() 的NaOH溶液等体积的混合液
的NaOH溶液等体积的混合液
B.![]() 的醋酸与
的醋酸与![]() 的NaOH溶液等体积的混合液
的NaOH溶液等体积的混合液
C.![]() 的醋酸溶液
的醋酸溶液
D.pH=2的盐酸与pH=12的NaOH溶液等体积的混合液
8.分子式为C5H7Cl的有机物,其结构不可能是 ( )
A.只含有一个双键的直链有机物 B.含有两个双键的直链有机物
C.含一个双键的环状有机物 D.含一个叁键的直链有机物
9.对于某些离子的检验及结论一定正确的是 ( )
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO![]()
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO![]()
C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH![]()
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
10.叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是 ( )
A.HN3水溶液中微粒浓度大小顺序:![]()
B.HN3与NH3作用生成的叠氮酸铵是共价化合物
C.NaN3水溶液中离子浓度大小顺序:![]()
| |
11.1mol下列固体物质①Na2O ②NaOH ③Na2O2 ④Na2SO3长期放置在空气中,固体质量增加的关系(不考虑潮解因素)正确的是 ( )
A.①=②>③>④ B.①>③>④>②
C.②>①=③>④ D.④>②>③>①
|
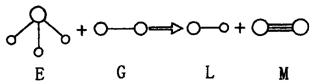
A.G是最活泼的非金属单质 B.L可用于刻蚀玻璃
|
13.有机物 在不同条件下至少可能发生下列7种不同类型的有机
反应:①加成反应 ②取代反应 ③消去反应 ④氧化反应 ⑤酯化反应 ⑥加聚反应 ⑦缩聚反应。上述反应中可以体现醇羟基性质的有 ( )
A.①④⑥⑦ B.③④⑤ C.②③④⑤⑦ D.①②③④⑤
14.某实验室仅有如下仪器或用具:烧杯、铁架台、铁圈、三角架、普通漏斗、石棉网、酒精灯、玻璃棒、量筒、蒸发皿、圆底烧瓶、滤纸、火柴。从缺乏仪器或用具的角度看,不能进行的实验操作项目是 ( )
A.过滤 B.蒸发 C.萃取 D.溶解
15.一定温度下,mg下列物质在足量的氧气中充分燃烧后,产物与足量的Na2O2固体充分反应,固体质量增加了ng,且n>m符合要求的物质是 ( )
A.HCOOCH3 B.CH3CHO C.HOOC-COOH D.C6H12O6
第Ⅱ卷(非选择题,共55分)
注意事项:
1.用钢笔或圆珠笔将答案直接答在试题卷上。
2.答卷前,先将密封线内的项目填写清楚。
|
试填写下列空白:
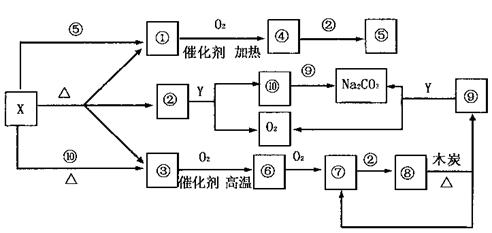
(1)物质X可能为 或 :物质Y为 。
(2)写出③转化为⑥的化学方程式 。
|
回答下列问题:
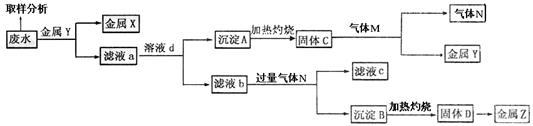
(1)固体C的化学式为 ,滤液b中通入过量气体N发生反应的离子方程式为
,固体D转化为金属Z的化学方程式为 。
(2)取样分析废水Ag+、Fe3+、Al3+的含量,目的是
a.控制溶液中Ag+、Fe3+、Al3+含量比
b.确定下一步加入金属Y的量
c.确定滤液a中加入溶液d的量
d.确定沉淀A转化为固体C所需的温度
 18.(18分)某化学研究小组为证明CO具有还原性,首先查阅相关的资料,获取下列信息:
18.(18分)某化学研究小组为证明CO具有还原性,首先查阅相关的资料,获取下列信息:
| |
|
请回答下列问题:
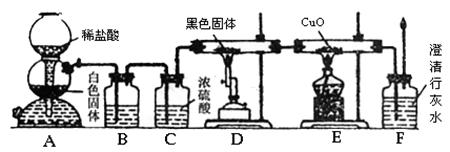
(1)装置A中反应的离子方程是 。
(2)装置B最适宜的试剂是 ;必须用装置C吸收气体中水蒸气的理由是
。
(3)按照如图装置进行实验时,首先进行的操作是 ,并要排净整套装置中的空气,则排净装置中空气的必要性是
; 。
(4)根据该实验中的 现象,可证明CO具有还原性,有关反应的化学方程式是 。
(5)若要根据装置F中石灰水变浑浊的现象确认CO具有还原性,应在上图装置
|
|
19.(8分)830K时,在密闭容器中发生下列可逆反应CO+H2O(g) CO2+H2 △H<0。
试回答下列问题:
(1)若起始时![]() ,达到平衡时CO的转化率为60%则平衡常数K=
,此时水蒸气的转化率为
。
,达到平衡时CO的转化率为60%则平衡常数K=
,此时水蒸气的转化率为
。
(2)在相同温度下,若起始时![]() ,反应进行一段时间后,测得H2的浓度为
,反应进行一段时间后,测得H2的浓度为![]() ,则此时该反应是否达到平衡状态
(填“是”与“否”),此时
,则此时该反应是否达到平衡状态
(填“是”与“否”),此时![]()
![]() (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(3)若降低温度,该反应的K值将 ,该反应的化学反应速率将 (均填“增大”“减小”或“不变”)。
20.(13分)A、B、C、D、E、F是周期表前三周期的元素,原子序数依次增大;B、C、D同周期且相邻,D、F同主族且相邻;A与C可形成两种化合物A2C和A2C2;1mol E的单质与足量盐酸反应或与足量NaOH溶液反应均生成1.5mol单质A。回答下列问题:
(1)我国首创以E(单质)—(空气,海水)—石墨(C)电池为能源的新型海水标志灯。该灯以海水为电解质溶液,靠空气中的氧气使E(单质)不断氧化而产生电流。只要把灯放入海水中数分钟,就会发出耀眼的白光,其能量比干电池高20—50倍。该电池的正极反应式是 。
(2)将过量气体AF通入AgNO3溶液中得到白色沉淀,将此白色沉淀分成4等份并分别溶于下列物质中:①10mL水 ②10mL 0.1mol·L-1的NaCl溶液 ③10mL 0.10.1mol·L-1的MgCl2溶液 ④10mL 0.1mol·L-1的KI溶液。则所得溶液中剩余白色固体质量由大到小的顺序为(填序写) 。
(3)已知:![]()
![]()
![]()
![]()
![]()
![]()
试写出BA3与C2反应生成BC2和A2C(g)的热化学方程式
。
(4)3molA的单质与1molB的单质在一个体积恒定的密闭容器中反应,生成化合物M,达到平衡时,M的体积分数为m。若将a mol A的单质、bmol B的单质、c mol M同时置于上述容器中,在相同温度下反应,达到平衡时,M的体积分数仍为m,则a、b、c必须满足的关系是 。
参 考 答 案
第Ⅰ卷
(每小题3分,共45分。每小题只有一个选项符合题意)
1.D 2.A 3.B 4.C 5.B 6.C 7.C 8.A 9.C 10.B 11.B 12.D
13.C 14.C 15.B
第Ⅱ卷(共55分)
16.(8分)
(1)NH4HSO3或(NH4)2SO3;Na2O2(写化学式或名称均给分)
|
(2)4NH3+5O2 4NO+6H2O
(每空2分,共8分)
17.(8分)
|
(2)bc(每空2分,共8分)
18.(18分)
(1)CaCO3+2H+=Ca2++CO2↑+H2O(2分)
(2)饱和NaHCO3溶液(1分);防止水蒸气与碳反应生成的H2对实验现象产生干扰(2分)
|
(4)E装置中黑色CuO变成红色(2分);CuO+CO Cu+CO2(2分)。
(5)D、E(2分)④(2分)
19.(8分)
(1)1;40%(每空2分,共4分)
(2)否(1分);>(1分)
(3)增大;减小(每空1分,共2分)
20.(13分)
(1)O2+2H2O+4e-→4OH-(2分)
(2)③>②>①>④(4分)
(3)4NH3(g)+702(g)=4NO2(g)+6H2O(g) △H=-1131.2kJ·mol-1(3分)
(4)2a+3c=6,2b+c=2(每个表达式2分,共4分)