高三年级化学第一学期质量监控考试试卷
(时间120分钟,满分150分)
考生注意:请将第I卷选择题答案填入第II卷的答案表格中。
可能用到的相对原子质量:
H—1 C—12 N—14 O—16 Cl—35.5 Na—23 Al—27 Fe—56
第Ⅰ卷(共66分)
一、选择题(本题共10分),每小题2分,只有一个正确选项。
1、下列物质:①大理石 ②生石膏 ③铁锈 ④蛋壳,分别滴加食醋时能产生气体的是
A. ①④ B. ①② C. ①②④ D.②③④
2、下列有关化学用语正确的是
A.氮原子的原子结构示意图:1s22s22p3 B.烧碱的化学式:NaOH
C.铵根离子的电子式:NH4+ D.甲酸的结构简式:CH2O2
3、下列说法错误的是
A.酯化、硝化都是化学变化
B.干馏、分馏都是物理变化
C.纯碱不是碱,干冰不是冰
D.水煤气、裂解气都是混合物
4、下列仪器名称书写规范的是
A.锥型瓶 B.水糟 C.研钵 D.瓷坩锅
5、食品卫生与身体健康密切相关。下列做法会导致食品污染的是:①在沥青公路上翻晒粮食;②香肠中加过量亚硝酸钠以保持肉类新鲜;③用生活用煤直接烧烤鸡、鸭;④出售含“瘦肉精”(一种含激素的饲料)的猪肉;⑤用福尔马林保鲜鱼肉等食品
A.①②③ B.③④⑤ C.①②④⑤ D.全部
二、选择题(本题共36分),每小题3分,只有一个正确选项。
6、NA代表阿伏加德罗常数,下列说法正确的是
A.9g水所含有的电子数为5NA
B.标准状况下22.4 L H2中含中子数为2NA
C.7.1g氯气与足量NaOH溶液反应电子转移数为0.2NA
D.某条件下将1molN2和3molH2 在密闭容器中充分反应,生成NH3分子数为2NA
7、食盐晶体微粒间存在的相互作用是
A.分子间力 B.共价键 C.离子键 D.金属键
8、下列各图所示装置的气密性检查中,漏气的是
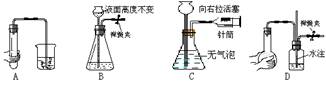
9、下列实验操作正确的是
A.用10mL量筒量取8.58mL蒸馏水
B.用碱石灰吸收氨气中的水蒸气
C.用酒精做萃取剂萃取碘水中的碘
D.将氢氧化钠固体放在滤纸上称量
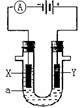 10、如右图所示,X、Y都是石墨电极,a是饱和食盐水,实验开始时,同时在U型管的两边各滴入几滴酚酞试液,下列叙述正确的是
10、如右图所示,X、Y都是石墨电极,a是饱和食盐水,实验开始时,同时在U型管的两边各滴入几滴酚酞试液,下列叙述正确的是
A.电解时电能将转变为化学能
B.Y是阳极,该电极附近有无色气体产生
C.X是负极,该电极附近先观察到溶液变红色
D.电解一段时间收集产生的气体,Y电极得到气体体积稍大
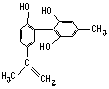 11、坚决反对运动员服用兴奋剂,是我国支持“人文奥运”的重要体现。某种兴奋剂的结构简式如右图所示,有关该物质及其溶液的说法不正确的是
11、坚决反对运动员服用兴奋剂,是我国支持“人文奥运”的重要体现。某种兴奋剂的结构简式如右图所示,有关该物质及其溶液的说法不正确的是
A.该分子中所有氢原子不可能在同一个平面上
B.1 mol该物质与H2反应时,最多消耗7 molH2
C.加入FeCl3溶液呈紫色,因为该物质属于酚类物质
D.滴入酸性高锰酸钾溶液,紫色褪去,可证明结构中存在碳碳双键
12、2005年1月14日,成功登陆“土卫六”的“惠更斯”号探测器发回了350张照片和大量数据。分析指出,土卫六“酷似地球经常下雨”,不过“雨”的成份是液态甲烷。下列关于土卫六的说法不正确的是
A.土卫六上存在有机物 B.土卫六地表温度极高
C.其地貌形成与液态甲烷冲刷有关 D.土卫六上形成了甲烷的气液循环系统
13、下列离子方程式正确的是
A.小苏打溶液与稀盐酸混合 CO32-+2H+→CO2↑+H2O
B.大理石溶解于醋酸溶液中 CaCO3+2H+→Ca2++CO2↑+H2O
C.铝片跟氢氧化钠溶液反应 Al+2OH-→AlO2-+H2↑
D.氯气通入氢氧化钠溶液中 Cl2+2OH-→Cl-+ClO-+H2O
14、将饱和FeCl3溶液分别滴入下述液体中,易形成胶体的是
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
15、某制药厂尾气中含有少量SO2气体,一般用NaOH溶液或氨水吸收,以防污染环境。若分别用相同物质的量浓度的NaOH溶液和氨水处理相同体积的这种尾气,所需两种溶液的体积关系是
A.NaOH溶液体积等于氨水体积 B.NaOH溶液体积大于氨水体积
C.NaOH溶液体积小于氨水体积 D.无法判断
16、纯净的氯化钠不易潮解,但粗盐很容易潮解,这主要是因为其中含有杂质MgCl2的缘故。为制取纯净的氯化钠晶体,有人设计了一个实验:将买来的粗盐放入纯氯化钠的饱和溶液一段时间,过滤、洗涤,即可得到纯净的氯化钠晶体。下列说法正确的是
A.粗盐的晶体微粒较大一些,有利于提纯
B.设计实验的根据是MgCl2比NaCl易溶于水
C.设计实验的根据是NaCl的溶解平衡
D.在整个过程中NaCl饱和溶液浓度会变大(温度不变)
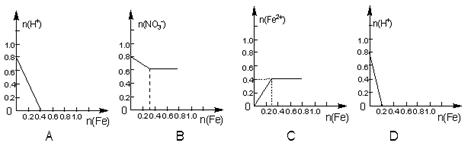 17、将22.4g铁粉缓缓加入到含有HNO3
0.8mol的稀硝酸中(还原产物为NO),下列图像正确的是
17、将22.4g铁粉缓缓加入到含有HNO3
0.8mol的稀硝酸中(还原产物为NO),下列图像正确的是
三、选择题(本题共20分),每小题4分,每小题有一个或两个正确选项。只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给 2 分,选错一个该小题不得分。
18、在溴水中存在如下平衡:![]() ,若要使溴水的颜色变浅,可采取的措施是
,若要使溴水的颜色变浅,可采取的措施是
A.加压 B.加入HCOONa晶体
C.通入SO2气体 D.通入HCl气体
19、0.1mol/L KHSO4和0.1mol/L Na2S溶液等体积混合后,溶液能使pH试纸变蓝,下列离子浓度关系正确的是
A.c(SO42-)>c(HS-)>c(OH-)>c(H+)
B.c(Na+)>c(K+)>c(H+)>(OH-)
C.c(Na+)=c(S2-)+c(H2S)+c(HS-)+c(SO42-)
D.c(Na+)+c(K+)+c(H+)=c(SO42-)+c(S2-)+c(HS-)+c(OH-)
20、下列过程必须使用稀硫酸,而不能用浓硫酸的是
A.跟锌反应制氢气 B.跟苯、浓硝酸混合制取硝基苯
C.溶解铜、银合金 D.跟乙酸、乙醇混合制乙酸乙酯
21、氢能是一种应用前景非常诱人的新型能源,但目前仍处在研究、试验阶段,还未得到广泛应用,其原因可能是
A.氢气燃烧对环境影响的评价问题尚无定论
B.氢气制备耗能巨大,廉价制氢技术尚未成熟
C.氢气贮存、运输等安全技术尚未很好的解决
D.氢气燃烧产物虽无污染,但其放出热量较低
22、常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通CO2 气体,只能生成HX和NaHCO3;往NaY溶液中通入CO2则生成HY和Na2CO3。有关叙述正确的是
A.酸性由强至弱:HX>HY>H2CO3
B.结合H+的能力:Y―>CO32―>X―>HCO3―
C.溶液物质的量浓度相同时碱性:NaX>Na2CO3>NaY>NaHCO3
D.NaX溶液中通入足量CO2后的离子浓度:
c(X―)>c(Na+)>c(HCO3―)>c(OH―)
 高三年级质量监控
高三年级质量监控
化学试卷
| 题号 | 一 | 二 | 三 | 四 | 五 | 六 | 七 | 总分 |
| 得分 |
|
|
|
|
|
|
|
|
考生注意:请将第I卷第一、二、三选择题的正确答案填入下表中:
| 题号 | 1 | 2 | 3 | 4 | 5 | |||||||
| 答案 | ||||||||||||
| 题号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 |
| 答案 | ||||||||||||
| 题号 | 18 | 19 | 20 | 21 | 22 | |||||||
| 答案 |
 第Ⅱ卷(共84分)
第Ⅱ卷(共84分)
四、(本题共24分)
考生注意:23题为分叉题,分A、B两题,考生可任选一题。若两题均做,一律按A题计分。A题适合使用二期课改新教材的考生解答,B题适合使用一期课改教材的考生解答。
23(A)、(8分)下表是元素周期表的一部分:
| 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 三 | ⑦ | ⑧ | ⑨ | ⑩ | |||
(1)表中元素⑨的氢化物的化学式为 ,此氢化物的还原性比元素⑥的氢化物的还原性 (填“强”或“弱”)。
(2)表中某元素原子的最外层p电子数比s电子数少1,则该元素的元素符号是 。
(3)表中给出元素单质可以形成原子晶体的是 (填序号)。
(4)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的离子方程式:
。
23(B)、(8分)下表是元素周期表的一部分,表中所列字母分别代表一种化学元素:
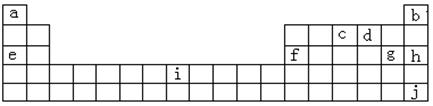
(1)b、h、j的单质熔点由高到低的顺序_____________(填字母)。
(2)以上元素形成的金属单质中,熔点最低的是_________(填元素符号)。
(3)f元素单质是在生活、生产中用量很大的金属之一,试写出工业上制备f元素单质的化学方程式_________________________________________________。
(4)c元素的单质用途_____________________________________________、________________________________________(填二条)。
24、(8分)含氮废水进入水体对环境造成的污染越来越严重,某课外活动小组先测定废水中含NO3-为3×10-4mol/L,而后用金属铝将NO3-还原为N2,从而消除污染。
(1)配平下列有关离子方程式:
____NO3-+ ____Al+ ____H2O → ____N2↑+ ____Al(OH)3↓+ ____OH-
(2)上述反应中,还原剂是_________,被还原的元素是_________,每生成2mol N2,将有_________ mol电子发生转移。
(3)有上述废水100m3,若要完全消除污染,则所消耗金属铝的质量为_________g。
25、(8分)在一定条件下,反应N2(g) +3H2(g) ![]() 2NH3(g)达到平衡:
2NH3(g)达到平衡:
(1)该反应的平衡常数表达式为_______________________;
(2)其它条件不变,减小压强平衡向________反应方向移动(填“正”或“逆”);
(3)可以判断此反应达到化学平衡状态的是____________(填字母编号);
A.等温等容下体系的压强不变 B.等温等容混合气体的密度不变
C.混合气体平均相对分子质量不变 D.等温等压下混合气体的体积不变
(4)当温度与压强不变时,增大N2的物质的量,则逆反应速率_______(填“变大”“变小”或“不变”)。平衡常数________(填“变大”“变小”或“不变”)。
考生注意:26题为分叉题,分A、B两题,考生可任选一题。若两题均做,一律按A题计分。A题适合使用二期课改新教材的考生解答,B题适合使用一期课改教材的考生解答。
 五、(本题共24分)
五、(本题共24分)
26(A)、(12分)某校学生为探究苯与溴发生反应的原理,改进了课本中该反应的装置(如下图所示,左图为原来课本装置,右图为改进后的装置)。

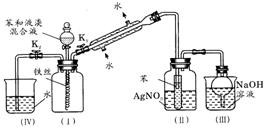
根据相关知识回答下列问题:
(1)实验开始时,关闭K2,开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。过一会儿,在(Ⅱ)中小试管内可能观察到的现象是__________________________;小试管外可能观察到的现象是__________________________________________;小试管中苯的作用是_________________________________。
(2)改进后的装置中能防止倒吸的装置有_________________。(填装置序号)
(3)反应结束后,如何使(Ⅳ)中的水倒吸入(Ⅰ)中?请简述操作过程:
_____________________________________________________________________。
(4)与改进前的装置相比较,改进后的装置能否证明苯和溴发生了取代反应?________(填“能”或“不能”),其理由是:__________________________________________。
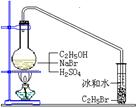 26(B)、(12分)在实验室中制备溴乙烷(C2H5Br)通常采用以下方法:在烧瓶中加NaBr(约2–3g),适量水,加少量乙醇,再加两倍于乙醇的浓硫酸(1:1),塞上带有长导管的塞子,长导管的另一端插入装有冰水混合物的试管中,用酒精灯隔石棉网对反应物加热。已知溴乙烷的沸点为38.4℃,其密度比水大,常温下为不溶于水的油状液体。请回答下列问题:
26(B)、(12分)在实验室中制备溴乙烷(C2H5Br)通常采用以下方法:在烧瓶中加NaBr(约2–3g),适量水,加少量乙醇,再加两倍于乙醇的浓硫酸(1:1),塞上带有长导管的塞子,长导管的另一端插入装有冰水混合物的试管中,用酒精灯隔石棉网对反应物加热。已知溴乙烷的沸点为38.4℃,其密度比水大,常温下为不溶于水的油状液体。请回答下列问题:
(1)现有98%的浓硫酸、蒸馏水、100mL烧杯、20mL量筒、玻璃棒等,写出配制20mL 1:1浓硫酸的操作过程:_________________________________________________________________________
_________________________________________________________________________。
(2)此反应中使用1:1的浓硫酸,与使用98%的浓硫酸相比其优点有(写二条):
①______________________________;②_________________________________。
(3)写出该方法制备C2H5Br的化学方程式:
__________________________________________________________________________。
(4)使用98%浓硫酸,发生副反应的化学方程式为________________________________。
(5)溴乙烷用冰水混合物收集的依据是_______________________________________
__________________________________________________________________________。
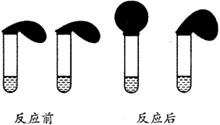 27、(12分)某教材中有这样一个实验:在两支试管中分别加入3mL某浓度的稀盐酸(足量),将两个各装有0.3g NaHCO3和
Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3和Na2CO3同时倒入试管中,观察到现象如右图:
27、(12分)某教材中有这样一个实验:在两支试管中分别加入3mL某浓度的稀盐酸(足量),将两个各装有0.3g NaHCO3和
Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3和Na2CO3同时倒入试管中,观察到现象如右图:
(1)盛______________(填化学式)的试管中气球变得更大, 大小气球(不计气球的弹力和气体温度影响) 体积之比约为(填最简单整数比)____________。
(2)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3粉末的试管变热。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。甲同学写出了如下热化学方程式(其中“aq”代表水合或无限稀释的含义): HCO3-(aq)+ H+(aq) →H2O(l)+ CO2(g) +Q1; Q1<0
CO32-(aq)+ 2H+(aq) → H2O(l) + CO2(g) +Q2; Q2 >0
甲同学所作结论的方法是否正确?___________(填“正确”或“不正确”)。
(3)为研究该反应是吸热还是放热反应,某研究小组以《NaHCO3、Na2CO3 和盐酸反应过程中热效应的研究》为研究课题,进行了如下实验(每次实验各做三次,取平均值):
| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高 或最低温度 |
| ① | 35mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
| ② | 35mL水 | 3.2 Na2CO3固体 | 20℃ | 24.3℃ |
| ③ | 35mL稀盐酸 | 含2.5g NaHCO3的饱和溶液32.5mL | 20℃ | 19℃ |
| ④ | 35mL稀盐酸 | 含3.2g Na2CO3的饱和溶液23.1mL+10ml水 | 20℃ | 24.2℃ |
| ⑤ | 35mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 16.2℃ |
| ⑥ | 35mL稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
请你帮助填写相关内容:
该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为______________和_______________;
(4)通过上述实验可以得出_____________(填字母编号)。
A、NaHCO3的溶解是吸热过程 B、NaHCO3的饱和溶液和盐酸的反应是吸热反应
C、Na2CO3的溶解是放热过程 D、Na2CO3的饱和溶液和盐酸的反应是吸热反应
(5)结论:影响NaHCO3固体与稀盐酸反应的反应热因素有________________________
____________________________________________________。
 六、(本题共20分)
六、(本题共20分)
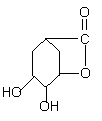
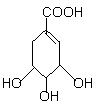
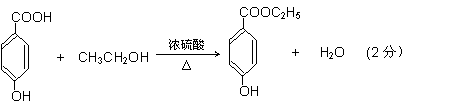
28、(10分)面临致命性H5N1型禽流感在人群中暴发的危险,目前由瑞士罗氏制药公司生产的口服流感药“达菲”是迄今对禽流感病毒最有效的药物,而莽草酸(C7H10O5)是合成“达菲”(抗禽流感药物)的重要中间体,以下是莽草酸为原料合成有机物B和D的路线:
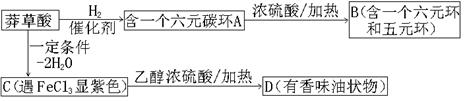
莽草酸分子结构模型如图:
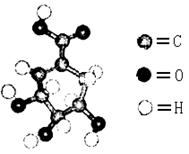
(1)莽草酸结构中含有的官能团的为_________、_________、_________(填名称)。
(2)莽草酸的结构简式为_____________,B的结构简式为_______________。
(3)C→D的化学方程式____________________________________________________。
(4)欲证明莽草酸是一种羧酸,下列实验方案最可靠的是___________(填方案名称),其理由是_____________________________________________________________。
方案甲:取少量莽草酸配成溶液,向溶液中滴加甲基橙看是否变红色。
方案乙:取少量莽草酸配成溶液,向溶液中滴加金属钠看是否有气体产生。
方案丙:向莽草酸中加入一定量的95%乙醇、浓硫酸并加热,看是否能产生油状有香味的物质。
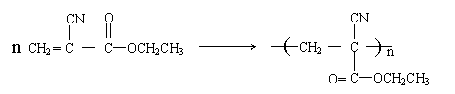
29、(10分)有机粘合剂是生活和生产中一类重要的材料。粘合过程一般是液态的小分子粘合剂经化学反应转化为大分子或高分子而固化。
(1)“502胶”是一种快干胶,其主要成分为α—氰基丙烯酸乙酯(![]() )。在空气中微量水的催化下发生加聚反应,迅速固化而将物品粘牢。请写出“502胶”发生粘合作用的化学方程式:
)。在空气中微量水的催化下发生加聚反应,迅速固化而将物品粘牢。请写出“502胶”发生粘合作用的化学方程式:
。
| |
。
(3)白乳胶是常用的粘合剂,其主要成分为醋酸乙烯酯(CH3COOCH=CH2),它有多种同分异构体,如![]() 。已知含有
。已知含有![]() 结构的物质不能稳定存在。请另外任写两种含-CH=CH-结构的
结构的物质不能稳定存在。请另外任写两种含-CH=CH-结构的
链状同分异构体的结构简式:
、
。(4)已知醇醛反应![]() 可以发生。聚乙烯醇
可以发生。聚乙烯醇![]() 可用做普通胶水,它的羟基可全部与丁醛缩合脱水,得到含六原子环的强力粘合剂聚乙烯缩丁醛。请写出制取聚乙烯缩丁醛的化学方程式:
可用做普通胶水,它的羟基可全部与丁醛缩合脱水,得到含六原子环的强力粘合剂聚乙烯缩丁醛。请写出制取聚乙烯缩丁醛的化学方程式:
。
七、(本题共16分)(计算结果要求均保留三位有效数字)
30、(6分)纳豆(分子中含碳4个以下)是一种减肥食品,从其中分离出一种由C、H、O三种元素组成的有机物A。为确定该有机物的结构,现进行如下各实验:①6.00gA在一定条件下完全分解,生成3.36L一氧化碳(标准状况下)和1.80g水;②中和0.240g物质A消耗0.200mol/L NaOH溶液20.0mL
试确定:(1)A的摩尔质量;
(2)A的结构简式.
31、(10分)已知NaOH与Na2CO3的混合溶液用稀盐酸滴定到酚酞变色时,发生了下列二个反应①NaOH+HCl→NaCl+H2O ②Na2CO3+HCl→NaHCO3+NaCl
(1)25.0mL 0.100mol/L NaOH溶液吸收标准状况下11.2mLCO2,反应后所得溶液的溶质种类及其物质的量?
 (2)取(1)反应后所得溶液10.0mL用0.100mol/L
盐酸滴定至酚酞终点。需该浓度的盐酸多少毫升?
(2)取(1)反应后所得溶液10.0mL用0.100mol/L
盐酸滴定至酚酞终点。需该浓度的盐酸多少毫升?
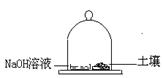 (3)称取25.0g土壤试样置于玻璃钟罩的密闭空间内,同时也放入盛有100mLNaOH溶液的圆盘以吸收CO2,48h后取25.0mLNaOH溶液,用15.7mL 0.100mol/L盐酸滴定至酚酞终点。同样的实验不放土壤(空白实验)放入盛有同浓度100mLNaOH溶液的圆盘以吸收CO2,48h后取25.0mLNaOH溶液需上述盐酸25.4mL,计算在细菌作用下土壤释放 CO2的速度,以mg CO2/[g(土壤)•h]表示。
(3)称取25.0g土壤试样置于玻璃钟罩的密闭空间内,同时也放入盛有100mLNaOH溶液的圆盘以吸收CO2,48h后取25.0mLNaOH溶液,用15.7mL 0.100mol/L盐酸滴定至酚酞终点。同样的实验不放土壤(空白实验)放入盛有同浓度100mLNaOH溶液的圆盘以吸收CO2,48h后取25.0mLNaOH溶液需上述盐酸25.4mL,计算在细菌作用下土壤释放 CO2的速度,以mg CO2/[g(土壤)•h]表示。
| 题号 | 1 | 2 | 3 | 4 | 5 | |||||||
| 答案 | A | B | B | C | D | |||||||
| 题号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 |
| 答案 | A | C | C | B | A | D | B | D | B | A | C | D |
| 题号 | 18 | 19 | 20 | 21 | 22 | |||||||
| 答案 | BC | AC | A | BC | B |
第一学期高三年级质量监控
化学试题参考答案与评分意见
一、二、三题(1-5题每小题2分;6-17题每小题3分;18-22题每小题4分,共66分)
四、(本题共24分,每题8分)
23(A)(共8分)
(1)H2S ,强。(各1分)(2)B、Al (各1分)(3)④⑤ (2分)(只填④也同样给分)。
(4)Be(OH)2+2OH-→ BeO22- + 2H2O (2分)
![]() 23(B)(共8分)
23(B)(共8分)
(1)j h b(1分)(2)Na(1分)(3) (3分)
(4)氮气是合成氨、制硝酸的重要原料;由于其性质稳定常被用作保护气;在高科技领域中常用液氮制造低温环境。(写出一条得1分,写出两条得3分)
24、(共8分)
(1)6、10、18→3、10、6 (2分)(2)Al (1分) ,N(1分),20mol(2分) (3)1350 (2分)
25、(共8分)
(1)![]() (2分) (2)逆 (1分) (3)A、C、D(2分)
(2分) (2)逆 (1分) (3)A、C、D(2分)
(4)变小(2分),不变(1分)
五、(共24分)
26(A)(12分)
(1)有气泡,溶液颜色变深(或变棕黄)(2分);小试管口有白雾出现,溶液中有浅黄色沉淀生成(2分);吸收溴蒸气(1分)。
(2)II和III (2分)(3)开启K2, 关闭K1和分液漏斗活塞,用冷湿毛巾紧捂装置(Ⅰ)的广口瓶。(2分)
(4)能(1分),小试管中的苯能将挥发出的溴蒸气吸收掉,从而证明了浅黄色沉淀是由溴化氢作用形成的而不是溴蒸气作用形成。有溴化氢生成即证明了苯和溴发生了取代反应。(2分)。
26(B)(12分)
(1)用20mL量筒量取10mL水加入100mL烧杯中,再用量筒量取10ml浓硫酸,将浓硫酸沿器壁慢慢地注入水里,并不断用玻璃棒搅拌(或搅动)。(3分)
(2)①减少副反应发生 ②有利于溶解产生的HBr (答1条1分,两条3分)
(3)C2H5OH+NaBr+H2SO4(浓)→ NaHSO4+C2H5Br+H2O 分开写也可得分 (2分)
![]()
(4) (其它合理的副反应同样给分,如生成Br2、乙醚等)(2分)
(5)溴乙烷的沸点为38.4℃,其密度比水大,常温下为不溶于水的油状液体。(2分)
27、(共12分)
(1)①NaHCO3(1分),53:42 (2分);(2)不正确(2分)(3)天平、温度计(各1分)
(4)A、B、C(3分);(5)NaHCO3的溶解过程及NaHCO3溶液和盐酸反应的吸、放热过程(2分).
 六、(本题共20分)
六、(本题共20分)
28、(10分)
(1)(2分)羟基、羧基、碳碳双键. (2)(各2分)
(3)
(4) 方案甲(1分) 莽草酸是弱酸,同时含有羟基,所以甲、乙不可以。 (1分)
 29、(10分)
29、(10分)
(1) (2分)
(2)2CH2=CHCOOH + HOCH2CH2OH → CH2=CHCOOCH2CH2OOCCH=CH2 + 2H2O(2分)
![]() (3)HOCH2CH=CHCHO、CH3OCH=CHCHO(CH3CH=CHCOOH、 CH2=CHOCH2CHO HOCH2CCH=CH2 、CH2=CHCH(OH)CHO 、 CH2=CHOOCH=CH2 )(1个1分,两个3分)
(3)HOCH2CH=CHCHO、CH3OCH=CHCHO(CH3CH=CHCOOH、 CH2=CHOCH2CHO HOCH2CCH=CH2 、CH2=CHCH(OH)CHO 、 CH2=CHOOCH=CH2 )(1个1分,两个3分)
O
(4)(3分)
![]()
![]()
|
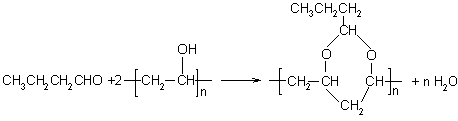
七、(共16分)
30、(6分)(1)120g/mol (3分); (2)(HOOC)2CHOH (3分)
31、(10分)(1)NaOH和Na2CO3 ;分别为0.00150mol和0.000500 mol (各2分);
(2)8.00 ml(2分)
(3)〔0.100×(25.4-15.7)×44×4〕/〔25.0×48〕=0.142 mg CO2/[g(土壤)•h] (4分)
(其它正确答案同样给分)