高三年级化学第二学期周周练习题7
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Mg-24 S-32 K-39 Ca-40 Fe-56 Cu-64
可能用到的相对原子质量:H:1 C:12 O:16 Na:23 Al:27 Cl:35.5 Fe:56 N:14
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1. 科学家最近研究发现,生活在海洋中的单细胞浮游生物能收集阳光并将其转变为食物,在此过程中它们可以从大气中摄取二氧化碳并释放出大量氧气。下列相关说法不正确的是:
A.该过程与植物的光合作用类似,可称为“海洋中的光合作用”
B.该过程中没有化学变化
C.如果能揭示其中的奥秘,就能够找到解决温室效应的新方法
D.如果能弄清此变化过程,将有助于人类更好地利用太阳能,缓解能源危机
2.20世纪80年代后,人们发现和证实了碳的另一类单质,它们是由一系列偶数个碳原子组成的分子,其中C60(足球烯,分子中含有30个双键)最具代表性。下图所示为n个C60连接而成的物质X。下列有关说法不正确的是
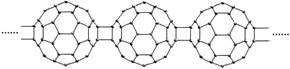
A.X难溶于水 B.一定条件下X可与H2发生加成反应
C.X是一种高分子有机化合物 D.X的摩尔质量为720ng/mol
3.某无色溶液中,若加入溴水,溴水褪色,若加入NH4HCO3,固体溶解并产生刺激性气味的气体,则该溶液中可能大量存在的离子组是
A.Na+、K+、Cl-、OH- B. H+、Na+、SO42-、NO3—
 C.K+、Ca2+、OH—、SO32— D.
Na+、Mg2+、S2—、ClO—
C.K+、Ca2+、OH—、SO32— D.
Na+、Mg2+、S2—、ClO—
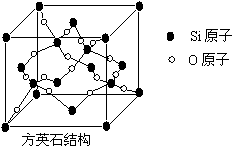
4.二氧化硅有晶体和无定形两种形态,晶态二氧化硅主要存在于石英矿中。除石英外,SiO2还有鳞石英和方英石等多种变体。方英石结构和金刚石相似,其结构单元如右图:
下列有关说法正确的是
A.方英石晶体中存在着SiO2结构单元
B.1molSi原子形成2molSi-O键
C.上图所示的结构单元中实际占有8个Si原子
D.方英石晶体中,Si-O键之间的夹角为90°
5.锂离子电池的正极材料是锂过渡金属氧化物(例如LiCoO2)混以一定量的导电添加物(例如C)构成的混合导体,负极材料是可插入锂的碳负极。两极的电极反应式:
负极:LixC6→ C6+x Li++e-
![]() 正极:Li0.5CoO2+0.5Li++0.5e-→LiCoO2。
正极:Li0.5CoO2+0.5Li++0.5e-→LiCoO2。
 充、放电时电池中的变化简单表示为: LiCoO2
充、放电时电池中的变化简单表示为: LiCoO2![]() xLi++e-
xLi++e-![]() LixC6,其中表示充电过程的是
LixC6,其中表示充电过程的是
A.a-阳极变化、c-阴极变化 B.a-阳极变化、d-阴极变化
C.b-阳极变化、c-阴极变化 D.b-阳极变化、d-阴极变化
6.阿伏加德罗常数约为6.02×1023mol-1,下列叙述中正确的是
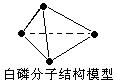
A.31g 白磷分子(P4)中含有P—P键个数为6×6.02×1023
B.48gO2和48gO3所含氧原子数均为3×6.02×1023
C.1.0L 1mol/L氨水中,NH3·H2O的分子数为6.02×1023
D.20g 重水(D2O)中含有的中子数为8×6.02×1023
7.40℃时,等质量的两份饱和石灰水,一份冷却至1℃,另一份加少量CaO并保持温度仍为40℃,这两种情况都不改变的是
A.Ca(OH)2的溶解度 B.溶液的质量
C.溶质的质量分数 D.溶液中Ca2+数目
8.下列有关热化学方程式的叙述正确的是
A.已知2H2(g)+O2(g)![]() 2H2O(g);△H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ
2H2O(g);△H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ
B.已知C(石墨,s)![]() C(金刚石,s);△H>0,则石墨金刚石比稳定
C(金刚石,s);△H>0,则石墨金刚石比稳定
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)![]() NaCl(aq)+H2O(l);△H=
-28.7kJ/mol
NaCl(aq)+H2O(l);△H=
-28.7kJ/mol
D.己知2C(s)+2O2(g)=2CO2(g);△H1 。 2C(s)+O2(g)=2CO(g);△H2
则△H1>△H2
二、选择题(本题包括8小题,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9.下列叙述正确的是
A.0.01mol/LCH3COOH与pH=12的NaOH溶液混合,若有c(CH3COO-)>c(Na+),则混合液一定呈碱性
B.常温下,将等体积0.01mol/LHCl与pH=12的氨水混合,则混合液的pH=7,
C.0.1mol/L的某二元弱酸盐Na2A溶液中,c(Na+)=2c(H2A)+2c(HA‑)+2c(A2-)
D.将5 mL 0.02mol/L的H2SO4与5 mL 0.02mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH=2
10.足量的铝粉分别和等体积pH=12的氢氧化钠溶液以及pH=2的某酸溶液反应,放出氢气的体积分别为V1、V2,则在相同状况下,V1、V2的关系可能是
A. V1<V2 B. V1=3V2 C. V1>V2 D.上述三种情况都有可能
11.在一密闭容器中有如下反应:a X(g)+b Y(g)![]() n W(g);ΔH ,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
n W(g);ΔH ,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
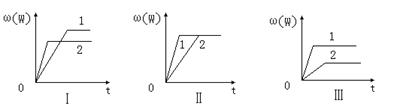
其中,ω(W)表示W在反应混合物中的百分含量,t表示反应时间。当其它条件不变时,下列分析正确的是
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1,a+b>n
B.图Ⅱ可能是在同温同压下催化剂对反应的影响,且1使用的催化剂效果好
C.图Ⅱ可能是不同压强对反应的影响,且P1>P2,n<a+b
D.图Ⅲ可能是不同温度对反应的影响,且T1>T2,ΔH<0
12.常温下,物质的量浓度均为0.1mol·L-1的两溶液HA、BOH。其中HA溶液的pH>1,BOH溶液中![]() =1012,则下列有关说法正确的是
=1012,则下列有关说法正确的是
A.HA溶液中水的电离程度大于BOH溶液中水的电离程度
B.将HA、BOH溶液稀释相同的倍数,pH值变化前者大于后者
C.若两溶液混合时:V(BOH)≥V(HA) ,则必有混合液中c(B+)>c(A-)
D.将HA、BOH混合所得pH=7的溶液中必有c(B+)=c(HA)+c(A-)
13. 实验是化学研究的基础,关于下列各实验装置图的叙述中,不正确的是
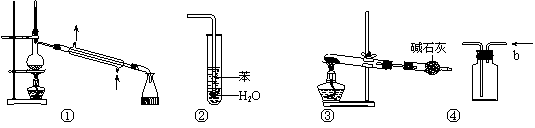 |
A.装置①常用于分离互溶的液体混合物
B.装置②可用于吸收HCl气体,并防止倒吸
C.以NH4Cl为原料,装置③可用于实验室制备少量NH3
D.装置④b口进气可收集H2、NH3等气体
14. 下列除去括号内杂质的有关操作方法不正确的是
①苯(苯酚):加人NaOH溶液,分液 ②乙醇(乙酸):加KOH溶液,分液 ③甲醛溶液(甲酸):加NaOH溶液,蒸馏 ④肥皂液(甘油):加食盐搅拌、盐析、过滤 ⑤乙酸乙酯(乙酸):加入乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯 ⑥淀粉溶液(葡萄糖):渗析 ⑦提取溶解在水中的少量碘:加入CCl4,分液,取出有机层再分离⑧乙烷(乙烯):酸性KMnO4溶液,洗气
A、①②④⑤⑧ B、②③④⑤⑧ C、②⑤⑧ D、④⑤⑥⑦⑧
15. 某含有Na+的澄清溶液中,可能还存在NH4+、Fe2+、I-、Br-、CO32-、SO32-六种离子中的几种。将该溶液进行如下实验:①滴加足量的新制氯水,有气泡生成,溶液变黄色;②向“①”中所得溶液中加入BaCl2溶液,无沉淀生成;③向“①”中所得溶液中加入淀粉溶液,不显蓝色。依据上述实验事实推断该溶液
A.一定存在Fe2+、Br-、CO32- B.一定呈碱性
C.一定不存在I-、SO32- D.可能存在NH4+
16. 某有机物X(C4H6O5)广泛存在于许多水果中,尤以苹果、葡萄、西瓜、山楂内为多,经测试,该化合物具有如下性质:
①l mol X与足量的金属钠反应产生1.5 mol H2
②X与醇(ROH)或羧酸(RCOOH)在浓H2SO4和加热条件下均可反应生成有香味的产物
③X在一定条件下的分子内脱水产物(不是环状化合物)可和溴水发生加成反应
根据上述信息,下列对X的结构的判断正确的是
A.X分子中肯定有碳碳双键
B.X分子中可能有三个羟基和一个-COOR官能团
C.X分子中可能有三个羧基
D.X分子中可能有一个羟基二个羧基
第Ⅱ卷(非选择题,共86分)
三、(本题包括2小题,共18分)
17.(8分) 回答下列问题:
(1)某无色溶液中加入一定量盐酸出现了白色浑浊, 试推测可能的离子(至少写出4种)___________、____________、_____________、_____________ 。
(2)某溶液含有较多的Na2SO4和少量Fe2(SO4)3。若用该溶液制取芒硝,可供选择的操作有:①加适量H2SO4溶液,②加金属Na,③结晶,④加过量NaOH溶液,⑤加强热脱结晶水,⑥过滤。正确的操作步骤是( )
A.②⑥③ B.④⑥①③ C.④⑥③⑤ D.②⑥①③⑤
(3)实验室用溴和苯反应制取溴苯,得到粗溴苯后,要用如下操作精制:①蒸馏,②水洗,③用干燥剂干燥,④10 % NaOH溶液洗,⑤水洗。正确的操作顺序是( )
A.①②③④⑤ B.②④⑤③① C.④②③①⑤ D.②④①⑤③
18.(10分)研究某一化学反应的实验装置如下图所示:
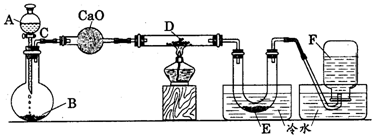 |
A~F属于下列物质中的六种物质:浓硫酸、浓盐酸、浓氨水、稀硫酸、稀盐酸、稀氟水、水、锌粒、铜片、食盐、高锰酸钾、氯化钙、氧化钙、四氧化三铁、氧化铁、氧化铜、氢气、二氧化碳、二氧化氮、一氧化碳、氯气、氯化氢、氨气、氮气、氧气。
实验现象;
(1)D物质由黑色变为红色
(2)无水硫酸铜粉末放入无色透明的E中得到蓝色溶液
(3)点燃的镁条伸入无色无味的F中.镁条表面生成一种灰黄色固体物质。将该发黄色物质放入水中,有气体放出,该气体具有刺激性气味。并能使润湿的红色石蕊试纸变蓝。通过分析回答:
l、写出A~F的物质名称:
A ,B ,C ,D ,E ,F 。
2、写出有关的化学方程式:
C与D ;F与Mg的反应产物与水 。
四、(本题包括2小题,共28分)
19. (18分)(1)A、B、C、D均为4种常见的短周期元素,常温下A、B可形成两种常见的液态化合物,其最简式分别为BA和B2A;B与D可形成分子X,也可形成阳离子Y,X、Y在水溶液中酸、碱性正好相反;C+的焰色反应呈黄色。
①C元素在周期表中的位置是 ;液态X类似B2A,也能微弱电离且产生电子数相同的两种离子,则液态X电离方程式为 。
②M、N是由A、B、C、D四种元素中任意三种元素组成的不同类型的强电解质,M的水溶液呈碱性,N的水溶液呈酸性,且M溶液中水的电离程度小于N溶液中水的电离程度。 则M、N分别为(填化学式) 、 ;若将0.1mol·L-1M和0.2mol·L-1N两溶液等体积混合所得溶液中离子浓度的大小顺序为 。
(2)计算下面两小题时,均缺少必要数据,试指出所缺数据的名称,分别用a、b、c等表示该数据(注明单位)。
①向20mL AlCl3溶液中逐滴加入NaOH溶液至Al3+恰好完全沉淀,所得沉淀质量为3.9g,计算该NaOH溶液的物质的量浓度。
缺少的数据是 ;c(NaOH)= 。
②向20 mL AlCl3溶液中滴加NaOH溶液,生成白色沉淀2.6g,若要计算NaOH溶液的物质的量浓度,缺少的数据是 、 ;
c(NaOH)= 、 。
(3).熔融盐燃料电池具有高的发电效率,因而受到重视。可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与二氧化碳为正极助燃气,制得在650℃下工作的燃料电池。已知此电池的负极反应式为:2CO+2CO32--4e-===4CO2
则正极反应式为_______________ ___________________,
20. (10分)下列框图中气体④⑨均具有刺激性气味,回答下列问题:
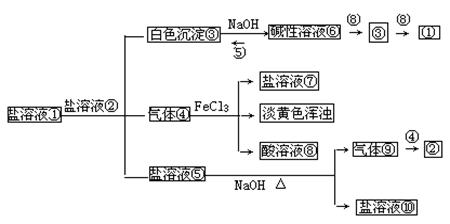 |
(1)①是 ;正盐②是 。(填化学式)
(2)④通入FeCl3溶液中的离子方程式 。
(3)⑤滴入⑥中产生白色沉淀③的原因是 。
(4)若将NaHCO3溶液滴入⑥中能否产生③? (填能或不能)。
五、(本题包括1小题,共13分)
21.新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)HClO不稳定,见光易分解生成HCl和O2。请设计实验证明有O2生成 _________________________________ 。
(2)氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请你设计实验,得出正确结论。
| 提出问题 | 收集资料 | 提出假设 | 验证假设 | 得出结论 |
| 氯水中何种物质能使湿润的红色布条褪色? | ①氯气有强氧化性 ②氯气与冷水反应生成盐酸和次氯酸 ③次氯酸有强氧化性 | ①_____________ ____________。 ②_____________ ____________。 ③____________ _____________。 ④ H2O使布条褪色 | 实验①:把红色干布条放入充满氯气的集气瓶中,布条不褪色; 实验②:__________ __ __ _ 。 实验③:把红色布条放在水里,布条不褪色。 |
G_____ _____ __ __ |
(3)平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。
H2CO3
![]() HCO3- + H+ Ka1(H2CO3)
= c(HCO3-)·c(H+)/c(H2CO3)
= 4.45×10-7
HCO3- + H+ Ka1(H2CO3)
= c(HCO3-)·c(H+)/c(H2CO3)
= 4.45×10-7
HCO3-![]() CO32- + H+ Ka2(H2CO3)
= c(CO32-) ·c(H+)/
c(HCO3-) =
5.61×10-11
CO32- + H+ Ka2(H2CO3)
= c(CO32-) ·c(H+)/
c(HCO3-) =
5.61×10-11
HClO ![]() H+ +
ClO- Ka(HClO) = 2.95×10-8
H+ +
ClO- Ka(HClO) = 2.95×10-8
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
①将少量的氯气通入到过量的碳酸钠溶液中____________________ _________;
②氯气和碳酸钠按照1︰1的比例恰好反应____________________________ __;
③将过量的氯气通入到少量的碳酸钠溶液___________________________ ____。
六、(本题包括2小题,共20分)
22. (8分)有机物甲的结构简式如下,它可通过不同的化学反应分别制得结构简式为乙~庚的物质。请回答下列问题:
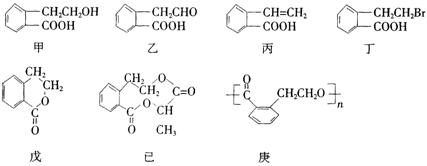
(1)指出反应的类型:
甲→丙:________________,甲→丁:______________________
(2)在甲~庚七种物质中,互为同分异构体的是__________(填代号,多选扣分,下同);
可看作酯类的是_________________。
(3)已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有原子有可能都在同一平面内的物质是_____________。
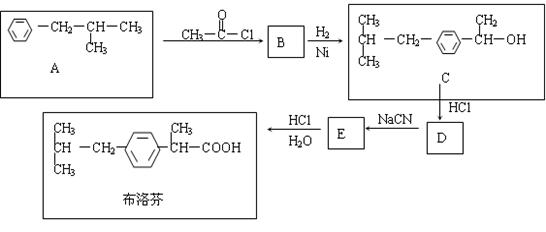 23.(12分)芬必得是一种高效的消炎药物,其主要成分为布洛芬,它有多种合成路线,下面是一种合成方法。
23.(12分)芬必得是一种高效的消炎药物,其主要成分为布洛芬,它有多种合成路线,下面是一种合成方法。
已知:卤代烃有如下反应:R-Cl+NaCN![]() R-C
R-C![]() N+
N+![]() 回答下列问题,
回答下列问题,
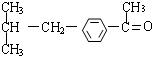
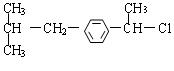
(1)写出有机物B、D的结构简式:
B ;D 。
(2)写出反应A![]() B和B
B和B![]() C的反应类型
、
(可供选择的反应类型有:取代,加成,消去,加聚,缩聚)
C的反应类型
、
(可供选择的反应类型有:取代,加成,消去,加聚,缩聚)
(3)有机物C和苯酚的关系是 (选填字母)
A、互为同分异构体 B、互为同系物
C、均属于芳香醇类 D、均属于芳香族化合物
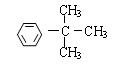
(4)与A具有相同的分子式,且苯环上只有一个取代基的有机物共有四种,写出除A外的其余三种的结构简式。
; ; 。
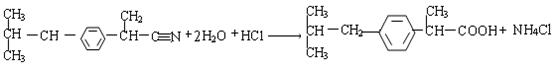
(5)写出E![]() 布洛芬反应的化学方程式(要求配平,有机物要用结构简式表示)
布洛芬反应的化学方程式(要求配平,有机物要用结构简式表示)
七、(本题包括2小题,共16分)
24.(8分)固体A是由C、H、O、K四种元素组成的复合物。实验测得1molA中含有1mol某二元酸、1mol该酸的酸式盐和2mol结晶水。取50.80g固体A配成1000mL溶液。取25mL上述溶液,可以恰好与0.5mol/L30.00mLNaOH溶液反应并生成正盐;另取25mL上述溶液,加入适量的稀硫酸,刚好使40.00mL0.1000mol/LKMnO4溶液褪色并生成CO2,将反应后的溶液稀释至90.00mL此时溶液中c(K+)为0.1000mol/L,且溶液中只含有K+、H+、Mn2+、SO42-及极少量的OH-。将生成的CO2全部收集并干燥后通过碱石灰,碱石灰增重0.8800g。
请回答下列问题:
(1)写出固体A的化学式 ;
(2)写出A与KMnO4溶液反应的化学方程式
。
24. (8分)右图装置中,容器甲内充入0.1 mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由B向左移动,当移至C处时容器体积缩小至最小,为原体积的![]() ,随着CO2的继续通入,活塞又逐渐向右移动。
,随着CO2的继续通入,活塞又逐渐向右移动。
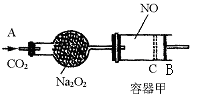
⑴①已知当活塞移至C处时,干燥管中物质的质量增加了2.24 g.此时,通入标准状况下的CO2气体的体积是多少?容器甲中NO2转化为N2O4的转化率是多少?
②活塞移至C处后,继续通入![]() ,此时活塞恰好回至B处.则a值必小于0.01,其理由是________________
________。
,此时活塞恰好回至B处.则a值必小于0.01,其理由是________________
________。
⑵若改变干燥管中Na2O2的量,要通过调节甲容器的温度及通入CO2的量,使活塞发生从B到C,又从C到B的移动,则Na2O2的质量最小值应大于多少克?
高三年级第二学期周周练7
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
17.(8分) (1) __________、____________、_____________、_____________ 。
(2) ( ) ; (3) ( )
18.l、 A ,B ,C ,
D ,E ,F 。
2、写出有关的化学方程式:
C与D ;F与Mg的反应产物与水 。
19. (18分)(1) ① ; 。
② 、 ; 。
(2) ① 缺少的数据是 ;c(NaOH)= 。
② 缺少的数据是 、 ;
c(NaOH)= 、 。
(3). 则正极反应式为_______________ ___________________,
20.(1)①是 ;正盐②是 。(填化学式)
(2) 。
(3) 。
(4) 。
21.(1)_____________________ _____ 。
(2)提出假设 ①________ ____ _____。
②____________ ___________。
③______ ______。
验证假设 实验②:__________ __ 。
得出结论G_____ _____ 。
(3)① ____________________ _________;
② ___________________________ _;
③ __________________________ __ _。
22. (8分)(1) 甲→丙:________________,甲→丁:______________________
(2) _____ _____ ;_____ ___________。
(3) _____________。
23.(1) B ;D 。
(2) 、 。
(3) (
(4)
; ; 。
(5)
。
24.(8分)
(1)写出固体A的化学式 ;
(2)写出A与KMnO4溶液反应的化学方程式
。
25. (8分)⑴①
② _______________ ________。
⑵
宿迁青华中学2007届高三年级第二学期周周练7
17、(1)Ag+、Ag(NH3)2+、SiO32-、AlO2- 、C6H5O-(2)B(3)B
18、1、A、浓氨水;B、氧化钙;C、氨气;D、氧化铜;E、水;F、氮气。
2、3CuO+2NH3==N2+3H2O+3Cu
N2+3Mg==Mg3N2
19、(1)①第三周期ⅠA族,2NH3![]() NH4++NH2-,
NH4++NH2-,
②NaOH、NH4NO3,NO3- > NH4+ > Na+ > OH- > H+
(2)①NaOH溶液的体积aL,c(NaOH)=0.15/amol/L
AlCl3溶液的物质的量浓度bmol/L,NaOH溶液的体积cL
c(NaOH)=0.1/c mol/L,c(NaOH)= (0.08b-2.6/78)/cmol/L
(3)2 CO2+ O2 + 4e-===2CO32-
20.(1)AlCl3 (NH4)2S
(2)H2S+2Fe3+==2Fe2++S↓+2H+
(3)NH4Cl溶液和NaAlO2 溶液发生双水解反应而生成Al(OH)3沉淀。
(4) 因HCO3-的酸性强于Al(OH)3,故发生强酸制弱酸的反应而生成Al(OH)3沉淀。
21.(1)将盛满氯水的无色矿泉水瓶倒置在水槽中,光照一段时间后,瓶底有无色气体生成。将瓶子倒转过来,用带火星的木条在瓶口检验气体,若木条复燃,证明HClO分解生成的气体为氧气。
(2)提出假设:①氯气使布条褪色 ② HClO使布条褪色 ③盐酸使布条褪色
验证假设:②把红色布条伸入稀盐酸中,红色布条不褪色
结论:次氯酸使布条褪色
(3)①![]()
②![]()
③![]()
22、(1) 消去, 卤代(取代) (2) 丙、戊, 戊、己、庚。(3) 丙
23.(1)
(2)取代 加成
(3) D
(4)
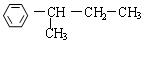
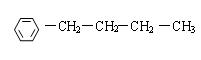
(5)
24、(8分)(1)KHC2O4·H2C2O4·2H2O
(2)10 KHC2O4·H2C2O4·2H2O+8KMnO4+17H2SO4=9K2SO4+8MnSO4+40CO2↑+52H2O
25、⑴①![]() 体积1.792 L;25%
体积1.792 L;25%
②当活塞由C向B移动时,因体积扩大使平衡:![]()
![]()
![]() 向体积扩大方向移动以至混合气体物质的量增大. (2)1.56 g
向体积扩大方向移动以至混合气体物质的量增大. (2)1.56 g