高三年级化学第二学期练习一
可能用到的相对原子质量:
H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5 Fe 56 Cu 64 Ag 108
第Ⅰ卷(选择题 共48分)
一、选择题(每小题6分,共48分。每小题只有一个选项符合要求)
1.保护环境是公民的责任和义务。下列说法正确的是 ( )
A.大量使用含磷洗涤剂会带来白色污染
B.减少使用氟氯代烷的目的是为了减少酸雨
C.大量开采地下水,以满足社会对水的需求
D.北京城区限制冬季燃煤供暖,是因为燃烧化石燃料会产生二氧化硫
2.某溶液中含有HCO3-、CO32-、SO32-、Na+、NO3- 五种离子。若向其中加入Na2O2充分反应后(溶液体积变化忽略不计),溶液中离子浓度保持不变的是 ( )
A.NO3- B.CO32-、NO3-
C.SO32-、NO3- D.CO32-、NO3-、Na+
3.下列用来表示物质变化的化学用语中,正确的是 ( )
A.钢铁腐蚀时可能发生的正极反应 4OH--4e-=2H2O+O2↑
B.表示中和热的离子方程式 H++OH-=H2O; △H=-57.3 kJ/mol
C.明矾水解反应的离子方程式 Al3++3H2O =Al(OH)3+3H+
D.硫酸铵浓溶液与氢氧化钠浓溶液混合的离子方程式 NH4++OH-=NH3↑+H2O
4.在一定条件下,下列粒子的还原性顺序为:Cl-<Br-<Fe2+<I-<SO2,由此判断以下各反应在溶液中不能发生的是 ( )
A.2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
B.I2+SO2+2H2O=4H++SO42-+2I-
C.2Fe2++Cl2=2Fe3++2Cl–
D.2Br-+4H++SO42-=SO2+Br2+2H2O
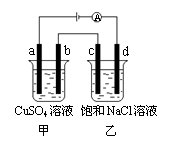 5.如图所示,a、b、c、d均为石墨电极,通电进行电解。下列说法正确的是 ( )
5.如图所示,a、b、c、d均为石墨电极,通电进行电解。下列说法正确的是 ( )
A.乙烧杯中d的电极反应为 2Cl--2e-=Cl2↑
B.a、c两极产生气体的物质的量相等
C.甲、乙两烧杯中溶液的pH均保持不变
|
2NaCl +2H2O ![]() 2NaOH + H2↑+Cl2↑
2NaOH + H2↑+Cl2↑
6.用NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.0.2 mol过氧化氢完全分解转移的电子数目为0.4NA
B.300 mL 2 mol/L蔗糖溶液中所含分子数为0.6 NA
C.在常温常压下,17 g硫化氢所含质子数目为8 NA
D.在标准状况下,2.24 L二氧化硫与氧气的混合气体中所含氧原子数为0.2 NA
7.在密闭容器中,对于可逆反应A+3B![]() 2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
( )
2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
( )
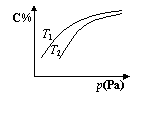 A.若正反应方向△H <0,则T1> T 2
A.若正反应方向△H <0,则T1> T 2
B.压强增大时,混合气体的平均相对分子质量减小
C.A一定为气体
D.B一定为气体
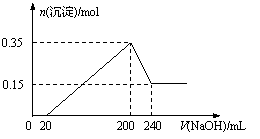 8.将一定质量的Mg和Al的混合物投入500 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法正确的是 ( )
8.将一定质量的Mg和Al的混合物投入500 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法正确的是 ( )
A.Mg和Al的总质量为8 g
B.硫酸的物质的量浓度为5 mol/L
C.NaOH溶液的物质的量浓度为5 mol/L
D.生成的H2在标准状况下的体积为11.2 L
第Ⅱ卷(非选择题 共60分)
二、填空题
9.(18分)几种短周期元素的原子半径及某些化合价见下表:
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | –1 | –2 | +4、–4 | +4、–2 | +5、–3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.102 | 0.110 | 0.143 | 0.160 | 0.186 |
分析上表中有关数据,并结合已学过的知识,回答以下问题。涉及上述元素的答案,请用元素符号表示。
(1)E元素在周期表中位于 周期, 族;
(2)A、H、J对应的离子半径由大到小的顺序是(填写离子符号) ;
(3)A与J所形成化合物的晶体类型是 ,用电子式表示其形成过程 ;
(4)B与H所形成的化合物与J的最高价氧化物的水化物X的溶液发生反应的离子方程式为 ;D与B形成的某种化合物Y不仅能与X反应,还能与I的单质反应,则Y与I的单质反应的化学方程式为 。
10.(12分)在下列物质的转化关系(某些物质已经略去)中,常温下A、C、D为无色气体;H是一种常见金属;Y可与苯酚溶液发生显色反应。
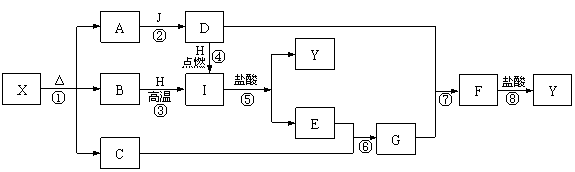
请回答以下问题:
(1)H元素在周期表中位于 族,原子的最外层电子数是 ;
(2)反应①③④⑤⑥中,属于氧化还原反应的有(填反应序号) ;
(3)按要求写出下列反应的方程式:
②的化学方程式 ;
⑦的化学方程式 ;
⑧的离子方程式 。
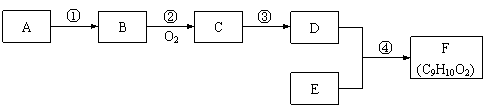
11.(14分)有机物F(C9H10O2)是一种有茉莉花香的无色油状液体,纯品用于配制花香香精和皂用香精,可用下图所示的方法合成有机物F。其中A为气态烃,在标准状况下,
1.4 g气体A的体积为1.12 L;E是只含C、H、O的化合物,且分子结构中没有甲基。
 |
请回答下列问题:
(1)化合物C含有官能团的名称为 ,化合物E的结构简式为 ;
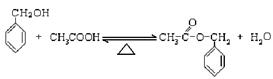
(2)写出反应①的化学方程式 ,其反应类型为 ;
(3)写出反应④的化学方程式 ;
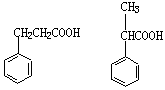
(4)化合物F有多种同分异构体,请写出与D同类且苯环上只有一个取代基的同分异构体的结构简式 、 。
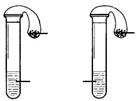
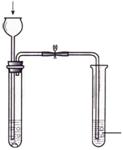
12.(16分)某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。


|
| |

![]()
![]()
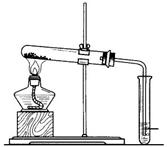
(1)只根据图I、II所示实验,能够达到实验目的是(填装置序号) ;
(2)图III、IV所示实验均能鉴别这两种物质,其反应的化学方程式为
;与实验III相比,实验IV的优点是(填选项序号) ;
A.IV比III复杂 B.IV比III安全
C.IV比III操作简便
D.IV可以做到用一套装置同时进行两个对比实验,而III不行
(3)若用实验IV验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是 ;
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应。
①当石灰水过量时,其离子方程式为 ;
②当碳酸氢钠与氢氧化钙物质的量之比为2 :1时,所得溶液中溶质的化学式为 ,请设计实验检验所得溶液中溶质的阴离子。
。
参考答案
一、 选择题:1D 2A 3D 4D 5D 6D 7D 8C
二、填空题
9.(18分)(1)3 ⅥA(关于族的其他表示方式不得分)(2分)
(2) F-、Na+、Al3+(若有“>”得分)(2分)
(3)离子晶体(只写“离子”不得分)(2分)
|
(4) Al2O3 +2OH-=2AlO2-+H2O (4分) 2Mg + CO2 ![]() 2MgO + C(4分)
2MgO + C(4分)
10.(12分)(1)VIII(关于族的其他表示方式不得分) (2分) 2 (2分)
(2)③④(2分)
(3)②的化学方程式 2Na2O2 + 2CO2 = 2Na2CO3 + O2(2分)
⑦的化学方程式 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3(2分)
⑧的离子方程式 Fe(OH)3 + 3H+ = Fe3+ + 3H2O(2分)
11.(14分)
|
![]() (2)CH2=CH2 + H2O CH3—CH2OH (2分) 加成反应(2分)
(2)CH2=CH2 + H2O CH3—CH2OH (2分) 加成反应(2分)
(此反应条件还可是“催化剂、加热、加压”)
|
(3) (2分)
|
(4)
12.(16分)(1)II (2分)
(2)2NaHCO3 ![]() Na2CO3+H2O + CO2↑ (2分) D (2分)
Na2CO3+H2O + CO2↑ (2分) D (2分)
(3)NaHCO3 (2分)
(4)①Ca2++OH- + HCO3- = CaCO3↓ + H2O (2分)
②Na2CO3(2分)
取少量上层清液于试管中,加入适量氯化钙溶液,振荡,若有白色沉淀生成,则证明溶液中含有CO32-(四个要点“操作、试剂、现象、结论”缺一即不得分)(4分)