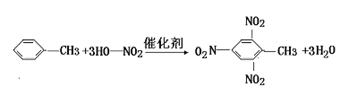
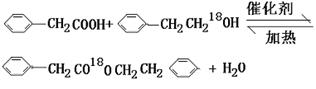
高三年级化学第二学期练习三
可能用到的相对原子质量:
H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5 Fe 56 Cu 64 Ba 137
第Ⅰ卷(选择题 共48分)
一、选择题(每小题6分,共48分。每小题只有一个选项符合要求)
1.最新研究表明生命可能起源于火山爆发,因为火山爆发产生的气体中含有1%的羰基硫
|
A.羰基硫属于非极性分子 B.羰基硫的电子式为
C.羰基硫的沸点比CO2低 D.羰基硫分子中三个原子处于同一直线上
|
A.碱石灰与浓氨水制NH3 B.铝片与NaOH溶液制H2
C.电石与饱和食盐水制乙炔(C2H2)
D.Na2SO3固体与75%的H2SO4制SO2
3.下列叙述中正确的是 ( )
A.离子化合物中可能含有非极性共价键
B.共价化合物中可能含有离子键 C.晶体中一定都存在化学键
D.结构类似的共价化合物,相对分子质量越大,其熔沸点一定越高
4.有机物甲分子式为C11H14O2,在酸性条件下水解生成乙和丙,丙遇FeCl3溶液显紫色,丙的相对分子质量比乙大20,甲的结构有 ( )
A.3种 B.4种 C.6种 D.8种
5.下列离子方程式书写正确的是 ( )
A.在澄清的石灰水中通入过量的CO2 CO2+OH-=HCO![]()
B.FeSO4溶液中(已酸化)滴加双氧水 Fe2++2H2O2+4H+=Fe3++4H2O
C.Al粉与NaOH溶液反应 Al+2OH-=AlO![]() +H2↑
+H2↑
|
|
A.Z、W均匀为气体,X、Y有一种是气体
B.Z、W中有一种是气体,X、Y皆为非气体
C.X、Y、Z、W皆为气体
D.X、Y均为气体,W、Z中有一种是气体
7.下列热化学方程式中△H的绝对值能表示可燃物燃烧热的是 ( )
A.H2(g)+1/2O2(g)=H2O(g);△H=-241.8KJ/mol
B.CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-802.3KJ/mol
C. 2H2(g)+O2(g)=2H2O(l);△H=-571.6KJ/mol
D. CO(g)+1/2O2(g)=CO2(g);△H=-283KJ/mol
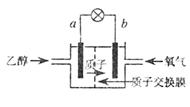
|
A.a极为电池的负极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应:4H++O2+4e-=2H2O
D.设每个电子所带电量为q库仑,则1mol乙醇被氧化产生6NAq库仑的电量
第Ⅱ卷(选择题 共60分)
二、填空题
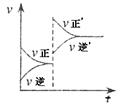
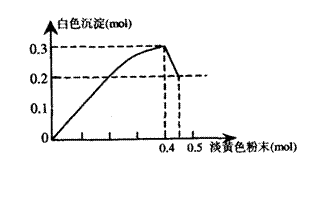 9.(14分)有一透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末状固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀。当加入0.4mol淡黄色粉末时,产生气体0.3mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀 的量如图上所示:
9.(14分)有一透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末状固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀。当加入0.4mol淡黄色粉末时,产生气体0.3mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀 的量如图上所示:
根据题意回答下列问题:
(1)淡黄色粉末为 (填名称)
(2)溶液中肯定有 离子,肯定没有 离子。
(3)溶液中离子的物质的量之比为 。
(4)写出下列方程式:
①淡黄色粉末与水反应的化学方程式: 。
②刺激性气味的所体产生的离子方程式: 。
③沉淀部分减少时的离子方程式: 。
10.(14分)简要回答下列问题:
(1)春夏季下雨时常伴有“电闪雷鸣”现象,因“闪电”而发生的化学反应有(举两例,用化学方程式表示):
①
②
(2)酸雨的pH小于5.6,放置一段时间后pH还会减小。其原因是(用化学方程式表示):
(3)铁的纯度越高越不易生锈;钢铁表面上若附着有电解质更易生锈。铁锈的化学成分是:Fe2O3·nH2O。请写出钢铁生锈时有关反应的化学方程式(包括电极反应及其总反应):
电极反应式:负极 ; 正极 。
原电池总反应式:
生成铁锈反应:
![]()
11.(18分)已知H2C2O4 CO↑+CO2↑+H2O,利用以下装置测定铁的氧化物的组成,依据下图回答:
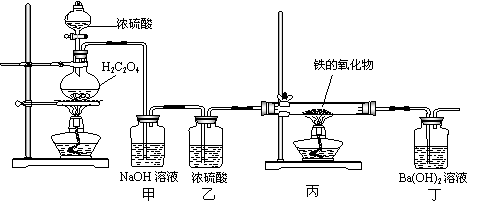
(1)此套装置是否完整,若需改进,写出补充方案:_________________________________
(2)如果丁装置的沉淀需作定量分析用,则应在甲乙之间增加何装置?并说明理由:________________________________________________________________________。
(3)若丙中氧化物的化学式为FexOy,则丙中反应的化学方程式为
;
设丙中Fe的氧化物为3.92g,且反应完全,丁中生成沉淀质量为13.79g,试确定该氧化物中x∶y= 。请你根据铁的氧化物种类,分析该二元混合物的可能组成:
| 组成(写化学式) | 物质的量之比 |
|
|
![]() Ⅱ.R—CH==CH2+H2O
RCH2CH2OH
Ⅱ.R—CH==CH2+H2O
RCH2CH2OH
|
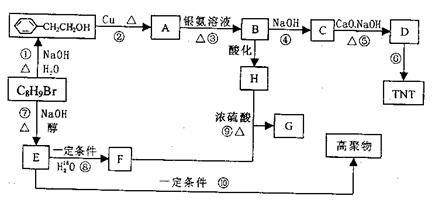
请回答下列问题:
(1)写出C8H9Br的结构简式: 。
(2)上述反应中属于消去反应的有(填编号) 反应。
(3)写出反应⑥、⑨的化学方程式:
反应⑥:
反应⑨:
(4)写出H可能有的3种同分异构体(要求:a.苯环上只有一个取代基,b.3种异构体不同类别):
; ;
1D 2B 3A 4C 5A 6D 7D 8D
9.(14分)(1)过氧化钠 (2分)(2)Mg2+,Al3+,NH4+;Cu2+,Fe3+ (2分)
(3)n(Mg2+) ∶n(Al3+)∶n(NH4+)=2∶1∶1(4分)
(4)①2Na2O2+2H2O 4NaOH+O2↑(2分) ②NH4++OH- NH3↑+H2O(2分)
③Al(OH)3+OH- AlO2-+2H2O(2分)
10.
|
|
(1)①3O2======2O3 ②N2+O2======2NO (每个2分,共4分)
(2)2H2SO3+O2=====2H2SO4 (2分)
(3)负极:2Fe-4e-=2Fe2+ 正极:O2+4e-+2H2O=4OH-(每个2分,共4分)
原电池总反应:2Fe+O2+2H2O=2Fe(OH)2 (2分)
生成铁锈反应:
4Fe(OH)2+O2+2H2O=4Fe(OH)3;2Fe(OH)3=Fe2O3·nH2O+(3-n)H2O
(每个1分,共2分)
11.(18分)⑴在丁装置右边导管接尖嘴玻璃管,并点燃(其它合理答案也给分)(2分)
⑵在甲乙之间增加盛有澄清石灰水的洗气瓶以检验甲中CO2是否除尽(2分)
⑶FexOy+yCO![]() xFe+yCO2 (2分) 5∶7(4分)
xFe+yCO2 (2分) 5∶7(4分)
| 组成(写化学式) | 物质的量之比 | (8分) |
| Fe3O4、Fe2O3 | 1:1 | |
|
| 1:2 |
|
(1) (2分)
(2)⑦(2分)
(3)反应⑥:
|
反应⑨:
(方程式每个2分,共4分)
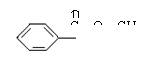
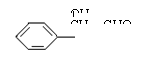
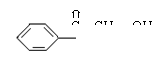 (4)
(4)
(其他正确均可。每个2分,共6分)
 FeO、Fe2O3
FeO、Fe2O3