高三年级化学第二次诊断性测试
化 学 试 题
(共100分,90分钟)
相关的相对原子质量:H—1 O—16 N—17 Na—23 S—32 K—39 Fe—56 Cu—64
第Ⅰ卷(48 分)
一、选择题(每小题只有一个正确答案,请将正确答案的序号填涂在答题卡上,共16小题,每小题3分,共48分。)
1.下列物质中,其水溶液能导电、溶于水时化学键被破坏,且该物质属于非电解质的是( )
A.![]() B.
B.![]() C.
C. ![]() D.
D.![]() (葡萄糖)
(葡萄糖)
2.同位素、同素异形体、同系物、同分异构体,这些关系都不存在的是 ( )
①淀粉和纤维素 ②红磷和白磷 ③乙醇和甲醚 ④苯酚和苯甲醇
A. ① B. ② C. ①④ D. ③④
3.在稀硫酸中加入铜粉,铜粉不溶,再加入下列物质: ① FeCl3 ② Fe2O3 ③ Cu(NO3)2
④ KNO3,铜粉可以溶解的是 ( )
A.只有①或② B.只有②或④
C.只有①或②或③ D.都可以
4. 设NA为阿伏加德罗常数,下列叙述中正确的是 ( )
A. 1L 1mol·L-1醋酸溶液中离子总数为2NA
B. 0.1molK2O2与水反应时,转移的电子数为0.2NA
C. 46g NO2和N2O4混合气体中含有原子数为3NA
D.含有5.3gNa2CO3的溶液中,有0.05NA 个CO32-离子
5.下列各组离子中,因发生氧化还原反应而不能大量共存的是 ( )
A.K+ 、H+、Fe2+、MnO4- B.HCO3-、SO42-、Al(OH)4-、NO3-
C.Al3+、Na+、SO42-、CO32- D.Fe3+、H+、SO42-、ClO-
6.下列离子方程式书写正确的是 ( )
| |
B.碳酸钡溶于醋酸溶液BaCO3+2H+=Ba2++CO2↑+H2O
C.次氯酸钙溶液中通入过量二氧化碳 Ca2+ + 2ClO-+H2O+CO2 = CaCO3↓+2HClO
D.硝酸亚铁溶液中加入盐酸 3Fe2+ + 4H+ + NO3- = 3Fe3+ + 2H2O + NO↑
7.将0.2mol/LCH3COOK与0.1 mol/L盐酸等体积混合后,溶液显酸性,溶液中下列微粒的物质的量浓度关系不正确的是 ( )
A.[H+]+[K+] = [CH3COO-]+[Cl-]+[OH-]
B.[CH3COO-]+[ CH3COOH] =0.2mol/L
C.[CH3COO-]> [ CH3COOH]
D.[K+]> [CH3COO-]>[Cl-]>[ CH3COOH] >[H+]
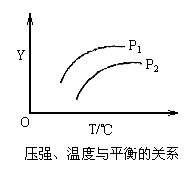
8.如图所示,不同温度和压强下,在固定容积的密闭容器中对可逆反应:
![]()
![]()
![]() ;Δ H>0
;Δ H>0
|
A.气体混合物的平均相对分子质量
B.气体混合物的总物质的量浓度
C.L在气体混合物的体积分数
D.气体混合物的密度
9.X、Y、Z均为短周期元素。已知X元素的某种原子核内无中子,Y元素的原子核外最外层电子数是其次外层电子数的2倍,Z元素是地壳中含量最丰富的元素。有下列含该三种元素的化学式:①X2Y2Z2 ②X2YZ3 ③X2YZ2 ④X2Y2Z4 ⑤X3YZ4 ⑥XYZ3,其中可能存在对应分子的是 ( )
A.② B.②④ C.②⑤⑥ D.①②③④
10.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3 + H2C2O4
+ H2SO4 ![]() 2 ClO2↑+
K2SO4 + 2CO2↑ + 2H2O
2 ClO2↑+
K2SO4 + 2CO2↑ + 2H2O
下列说法正确的是 ( )
A.KClO3在反应中发生氧化反应 B.ClO2是氧化产物
C.H2C2O4在反应中被氧化 D.1 mol KClO3参加反应有2 mol电子转移
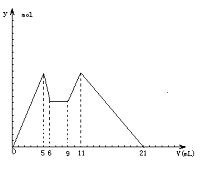
|
后又滴加盐酸,所得沉淀y(mol)与试剂体积V(mL)之
间的关系。以下结论不正确的是 ( )
A.NaOH和盐酸的分界点是6mL处
B.原混合液中c(Al3+):c(Mg2+):c(Cl-)=1:1:5
C.c(NaOH):c(HCl)=2:1
D.从7到9,都发生离子反应H++OH-=H2O
12.对甲基苯甲酸的同分异构体中,属于酯类、且含有甲
基的芳香族化合物有( )种。
A.2 B.3 C.4 D.5
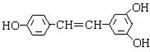
13.白藜芦醇 广泛存在于食物(例如桑葚、花生、尤其是葡萄)中,它可能具有抗癌性。能够跟1 mol 该化合物起反应的Br2(水)或H2的最大用量分别是 ( )
A.1 mol 1 mol B.6 mol 7 mol
C.3.5 mol 6 mol D.3.5 mol 7 mol
14.一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通乙烷和氧气,其电极反应式为C2H6 + 18OH--14e-= 2CO32-+ 12H2O,O2+2H2O+ 4e-=4OH-,有关此电池的推断正确的是 ( )
A.电解质溶液中CO32-向正极移动
B.放电一段时间后,KOH的物质的量浓度不变
C.通乙烷的电极为负极
D.参加反应的O2和C2H6的物质的量之比为7:1
15.某CuO粉末与适量的硫酸(ρ=1.7g·cm-3)在微热下充分反应,冷却后恰好全部形成CuSO4·5H2O(设反应过程中无水份损失),硫酸溶液的物质的量浓度为 ( )
A.0.2 mol·L-1 B. 1mol·L-1 C.4.8 mol·L-1 D.10 mol·L-1
| |
A.3 B.4 C.5 D.6
第Ⅱ卷(52分)
二、填空题
17.(3分)下列实验操作正确的是
A.向一支洁净的试管中加人2mL3%硝酸银溶液,再向试管中滴加氨水至产生的沉淀恰好溶解为止,加入乙醛溶液,水浴加热,片刻后将在试管内壁形成银镜。
B.实验室制取乙烯时,必须将温度计的水银球插入反应液中。
C.取2mL4mol/LNaOH溶液于试管中,加入2mL2mol/LCuSO4溶液,再加入某种有机试剂,加热,可根据是否产生红色沉淀判断该有机物中是否含有醛基。
D.分离苯和苯酚的混合液,可向混合物中加人适量浓溴水,过滤、分液,即可实现。
E.用碱式滴定管量取12.00mLNaOH溶液
F.无水乙醇与冰醋酸共热制取乙酸乙酯
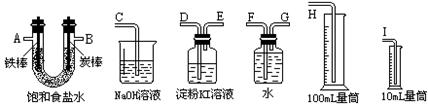
|
(1)试从上图中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是:A接____,____接______,B接_____,____接______;
(2)炭棒接直流电源的________极;
(3)能说明氯气具有氧化性的实验现象是__________________________________ _;
(4)假定装入的饱和食盐水为50mL(电解前后溶液体积变化可忽略),当测得的氢气为5.6mL(标准状况)时停止通电。摇匀U形管内的溶液后溶液的pH约为__________。
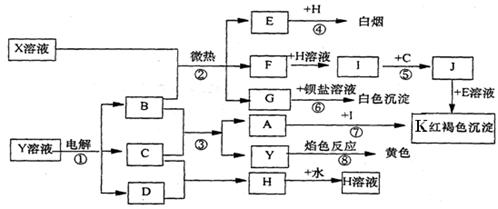
|
试回答:
(1)写出下列物质的化学式。F __________ H____________
(2)反应⑦中A溶液显示的性质是___________(填序号)
A.氧化性 B.还原性 C.酸性
(3)若X是一种能溶于水的复盐,则组成它的阴阳离子是_______________。
(4)写出下列反应的离子方程式。
反应①________________________________________________________;
反应③________________________________________________________;
反应⑤_______________________________________________________。
20.(13分)烃A可以从煤干馏得到,也是一种石油化工产品,工业上可用来制造一种常用炸药M。从烃A可以合成化合物F,它是用于制备治疗“非典”的药物“盐酸祛炎痛”的中间产物,其合成路线为:
|
已知:①RNH2
+ R’CH2Cl ![]() RNHCH2R’ + HCl (R和R’代表烃基)
RNHCH2R’ + HCl (R和R’代表烃基)
![]() ② 苯的同系物能被酸性高锰酸钾溶液氧化,如
② 苯的同系物能被酸性高锰酸钾溶液氧化,如
![]() ③
(弱氧化性,易氧化)
③
(弱氧化性,易氧化)
![]() ④
与浓硫酸、浓硝酸混合在不同温度下会得到不同产物
④
与浓硫酸、浓硝酸混合在不同温度下会得到不同产物
⑤
![]() 与浓硫酸、浓硝酸混合反应能生成间硝基苯甲酸。
与浓硫酸、浓硝酸混合反应能生成间硝基苯甲酸。
回答下列问题:
(1)C的结构简式是_____________________。
(2)D+E→F的化学方程式_________________________________。
(3)E在一定条件下可聚合成热固性很好的功能高分子,写出合成此高聚物的化学方程式____________________________________________________________________。
(4)反应①~⑤中,属于取代反应的是(填反应序号)____________________。
(5)已知在20℃时,0.1mol炸药M爆炸时可以放出Q kJ的热量,则炸药M在20℃时分解反应的热化学方程式为_____________________________________________。(没有氧气参与反应,且氢元素和氮元素在产物中分别以水和氮气的形式存在)
21.(15分)有两只容积相等的密闭容器A和B,A容器保持恒容,B容器有一个可移动的活塞能使容器内保持恒压。起始时,向A容器充入2mol SO3和1mol O2, 向B容器充入2mol SO2与2molO2,保持400℃的条件下发生如下反应:
2SO2(g)+O2(g)≒ 2SO3(g);ΔH<0,并各自达平衡。填写下列空格:
(1)写出该反应的化学平衡常数表达式Kc= ,降低温度,该反应Kc值 ,(填增大、减小或不变,下同),化学反应速率 。
(2)达到平衡后,若向两容器中通入少量且相等的氩气,A容器化学平衡__________(填 “正向移动”、“逆向移动”、“不移动”或“无法确定”,下同),B容器的化学平衡_________________。
(3)达到平衡后,若向两容器中通入等量的原反应气体,达到新平衡时,A容器SO3的体积分数_______,B容器SO3的体积分数______。(填“增大”、“减少”或“不变”)
(4)达到平衡后,向容器B中再充入少量O2,SO2的转化率将________(填“增大”、“减小”、“不变”或“无法判断”)。
(5)达到平衡后,A容器中SO2的体积分数_______ B容器中SO2的体积分数(填“大于”、“小于”或“等于”)。
(6)若开始时在容器A中充入1mol SO2,同时充入 ,所到平衡与原平衡完全相同。
参考答案
1.B 2.C 3.D 4.C 5.A 6.D 7.B 8.A 9.D 10.C 11.A 12.D 13.B 14.C 15.D 16.B
17.A、B、E
18.⑴ A接G,F,I;B接D,E,C ⑵ 正 ⑶ 淀粉KI溶液变蓝 ⑷ 12
19.(1)Fe(OH)2 HCl (2)A (3)NH4+、Fe2+、SO42- (3)略
20.(1)
![]()
(2)![]()
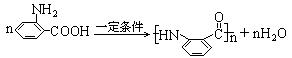 |
(3)
(4) ①②⑤
(5)C7H5N3O6(s)= 3.5C(s) +3.5CO(g)+2.5H2O(l)+1.5N2(g);ΔH=-10Q kJ/mol
21.(1)略;增大;减小(2)不移动;向逆方向移动(3)增大;不变(4)增大(5)大于(6)1.5mol O2 和 1mol SO3