高三年级化学第二次调研测试试题
化 学
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5
Fe 56 Cu 64 Br 80
一、单项选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.
![]()
![]() 美国科学家设想“绿化”火星并使其成为第二个地球:火星上造超级温室气体。美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体” 全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是
美国科学家设想“绿化”火星并使其成为第二个地球:火星上造超级温室气体。美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体” 全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是
A.分子中三个碳原子可能处于同一直线上 B.全氟丙烷的电子式为:
C.相同压强下,沸点:C3F8<C3H8 D.全氟丙烷难溶于水
2. 化学与科技、社会、生产密切结合,下列做法合理合法的是
A.淀粉餐具被认为是最有发展前景的一次性餐具,可有利于保护环境
B.养鸭厂添加苏丹红制“红心鸭蛋”,可使鸭蛋色泽鲜艳、美观
C.化妆品中添加含铬物质制美白润肤“SK-Ⅲ”,可使女性青春永驻
D.汽水中添加林丹、毒死蜱和七氯等杀虫剂制“可口可乐、百事可乐”,增强口感和余味
3. 下列对实验仪器名称的标注或实验操作,正确的是
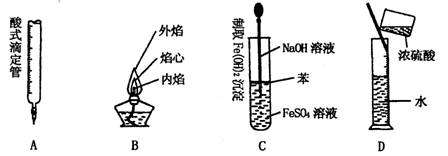
4. 六硫化四磷分子的结构研究表明,该分子中没有不饱和键,且各原子的最外层均已达到了8个电子的结构。在一个六硫化四磷分子中含有的共价键个数是
A.7个 B.12个 C.19个 D.不能确定
5. 分类方法在化学学科的发展中起到了非常重要的作用。下列分类标准不合理的是
①根据酸分子中含有的H原子个数将酸分为一元酸、二元酸等
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
④根据反应中的热效应将化学反应分为放热反应和吸热反应
A. ②④ B.①②④ C. ②③④ D.①③
6. 阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是
A.1 L 1 mol/L 的FeCl3 溶液中含有三价铁离子数目为 6.02×1023
B.1mol C10H22分子中共用电子对总数约为31×6.02×1023
C.48gO2和48gO3所含分子数为3×6.02×1023
D.标准状态下的辛烷22.4L完全燃烧产生CO2分子数为8×6.02×1023
7. 已知反应:①101kPa时,2C(s)+O2(g)=2CO(g);△H=-221kJ/mol
②稀溶液,H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mo
下列结论正确的是
A.碳的燃烧热大于110.5kJ/mol
B.①的反应热为221kJ/mol
C.稀硫酸与稀Ba(OH)2溶液反应的中和热为57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
8.
某有机物的结构简式为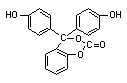 ,1 mol此有机物与足量NaOH溶液充分反应,消耗NaOH的物质的量为
,1 mol此有机物与足量NaOH溶液充分反应,消耗NaOH的物质的量为
A.2 mol B.3 mol C.5 mol D.6 mol
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
9. 甲、乙、丙都是短周期元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M层电子数之和与L层的电子数相同。下列判断不正确的是
A.乙元素的族序数比甲元素的族序数大
B.甲、丙元素最高价氧化物对应水化物的酸性强弱顺序为:甲 < 丙
C.原子半径由大到小的顺序为丙>甲>乙
D.含乙元素的化合物数目比含甲、丙元素的化合物数目多
10. 下列各组离子,在指定的环境中一定能大量共存的是
A.在pH为7的溶液中:Ag+、K+、SO42—、Cl—
B.在能使pH试纸变深蓝色的溶液中:Na+、S2—、NO3—、CO32—
C.在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42—、NO3—
D.在由水电离出的c(OH—)=10—13mol·L—1的溶液中:Na+、Ba2+、Cl—、I—
11. 有两种有机物由C、H、O中的两种或三种元素组成,等物质的量的该两种物质完全燃烧时,消耗相等物质的量的氧气,则该两种有机物的相对分子质量的差值不可能为
A. 62 B. 18 C. 13 D.0
12. 相互反应时,无论何种试剂过量离子方程式都正确的是
![]() A.盐酸与NaAlO2溶液:AlO2—+H++H2O Al(OH)3↓
A.盐酸与NaAlO2溶液:AlO2—+H++H2O Al(OH)3↓
![]() B.石灰水与磷酸二氢钠溶液:2H2PO4— + 3Ca2+ + 4OH- Ca3(PO4)2↓+4H2O
B.石灰水与磷酸二氢钠溶液:2H2PO4— + 3Ca2+ + 4OH- Ca3(PO4)2↓+4H2O
![]() C.明矾溶液与小苏打:Al3+ + 3HCO3-
Al(OH)3+3CO2↑
C.明矾溶液与小苏打:Al3+ + 3HCO3-
Al(OH)3+3CO2↑
![]() D.硫酸溶液和氢氧化钡溶液:SO42-+ 2H+ +Ba2+
+ 2OH- BaSO4↓
+ 2H2O
D.硫酸溶液和氢氧化钡溶液:SO42-+ 2H+ +Ba2+
+ 2OH- BaSO4↓
+ 2H2O
13. 下列叙述正确的是
A.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
B.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(B2-)>c(H2B)
C. 10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
14. 将氢气、甲烷、乙醇等物质在氧气中燃烧时的化学能直接转化为电能的装置叫燃料电池。燃料电池的基本组成为电极、电解质、燃料和氧化剂。此种电池能量利用率可高达80%(一般柴油发电机只有40%左右),产物污染也少。下列有关燃料电池的说法不正确的是
A.上述燃料电池的正极反应材料是氢气、甲烷、乙醇等物质
B.氢氧燃料电池常用于航天飞行器,原因之一是该电池的产物为水,经过处理后可供宇航员使用
C.乙醇燃料电池的电解质常用KOH,该电池的负极反应为:C2H5OH-12e-=2CO2↑+3H2O
D.甲烷燃料电池中每消耗1molCH4,理论上转移的电子有8mol
15. 下面图像是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断属于NaCl晶体结构的是
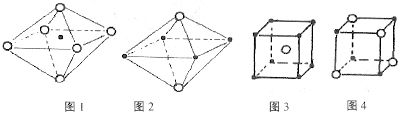
A.图1和图3 B.图2和图3 C.只有图1 D.图1和图4
16. 向盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀量m与加入的体积V之间的关系不可能是下图中的
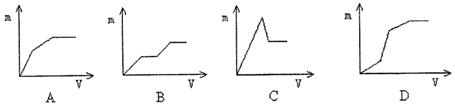
三、(本题包括2小题,共22分)
17. (10分)(1)硫酸铜晶体结晶水含量测定的实验,包括研磨、加热、称量等操作步骤。其中判断硫酸铜晶体完全失水的定性实验现象是_________ ______________
 ,完成测定过程至少要进行 次称量操作。
,完成测定过程至少要进行 次称量操作。
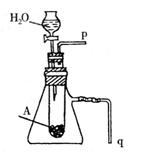
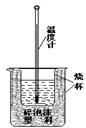
⑵实验室利用如右图装置进行中和热的测定。回答下列问题:
①该图中有两处未画出,它们是 、 ;
②在操作正确的前提下提高中和热测定的准确性的关键 ;
③如果用0.5 mol/L的盐酸和氢氧化钠固体进行实验,则实验中所测出
“中和热”将 (填“偏大”、“偏小”、“不变”);原因是 。
18. (12分)已知乙二酸( HOOC—COOH)俗称草酸,它是一种易溶于水的二元弱酸,酸性强于碳酸,其盐草酸钙和草酸氢钙均为白色不溶物。无色晶体H2C2O4·2H2O称为草酸晶体,其熔点为101.5℃。草酸晶体失去结晶水得无水草酸,它在157℃升华。
根据上述信息,回答下列问题。
(1)向盛有2mL饱和NaHCO3溶液的试管里加入约2mL乙二酸浓溶液,观察到的现象是 ,写出该反应的离子方程式: 。
(2)配平乙二酸与酸性KMnO4溶液反应的离子方程式:
MnO4- + H2C2O4 + H+ — Mn2+ + CO2↑+ H2O
(3)向试管A中加入3mL乙醇,然后边振荡试管边加入2mL浓硫酸和2mL乙二酸溶液,按下图Ⅰ连接好装置,加热3—5min。在装有饱和Na2CO3溶液的试管B中有油状且带有香味的液体产生。B中导管口在液面上而不伸入液面下的原因是 。写出乙二酸与足量乙醇完全酯化的化学反应方程式 。
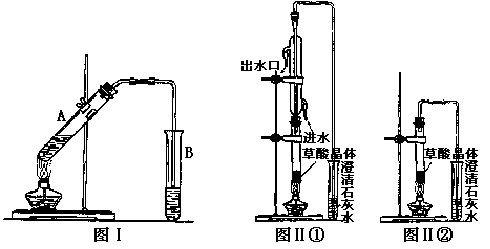
(4)已知草酸分解的化学方程式为:![]() 。
。
利用图Ⅱ①和图Ⅱ②加热草酸晶体,以验证草酸受热是否分解。连续加热一段时间后的现象是:图Ⅱ①:试管里澄清石灰水先变浑浊,后又变澄清,其原因是 ;图Ⅱ②:试管里澄清石灰水只变浑浊,其原因是 ;能验证草酸受热分解的装置是 (填图Ⅱ中的编号“①”或“②”),理由是:
(从装置的特点分析)。
四、(本题包括2小题,共18分)
19. (8分)已知Br2、Fe2(SO4)3、CaC2等物质均能与水发生反应,生成两种物质。下表中所列四种物质都易与水反应。
(1)在表中空格处填写各物质分别与水反应的产物中,属于氧化物对应水化物的化学式:
| Li3N | ClF | NaNH2 | SiBr4 |
(2)写出这四种物质与水反应的产物中,溶于水中形成无氧酸的物质的化学式______________。
(3)写出相等物质的量这四种物质分别与水反应时,耗水最少的且产物溶于水溶液显碱性,则该产物的电子式为 。
20.
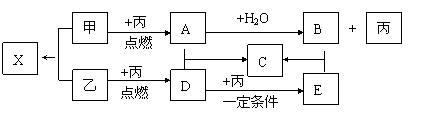 (10分) 甲、乙、丙是由短周期元素形成的常见单质,丙在常温下为无色气体,且乙、丙两元素同主族,其余均为常见化合物,A和X的摩尔质量相同,它们在一定条件下有如下转化关系:(反应中生成的水已略去)
(10分) 甲、乙、丙是由短周期元素形成的常见单质,丙在常温下为无色气体,且乙、丙两元素同主族,其余均为常见化合物,A和X的摩尔质量相同,它们在一定条件下有如下转化关系:(反应中生成的水已略去)
(1)丙的名称是 ;C的化学式是 ;X属 晶体。
(2)A+D→C的反应属于下列何种反应类型(填序号) 。
A.化合反应 B.氧化还原反应 C.非氧化还原反应 D.离子反应。
(3)工业生产中,将D转化为E的反应条件是 。
|
(5)若用如图装置来证明A和H2O的反应:
①是放热反应,②生成了丙。简单合理的实验
操作是:
① ;
② 。
五、(本题包括1小题,共10分)
21. (12分)在真空密闭容器内加入a mol PH4I固体,在一定温度下发生如下反应:
PH4I(s)![]() PH3(g)+HI(g)
PH3(g)+HI(g)
4PH3(g)![]() P4(g)+6H2(g)
P4(g)+6H2(g)
2HI(g)![]() H2(g)+I2(g)
H2(g)+I2(g)
以上三个反应建立平衡后,测得HI为b mol,I2(g)为c mol,H2为d mol,求:
① 平衡后,容器内P4(g)和PH3的物质的量(用代数式表示)
n(P4)= ,n(PH3)= ;
② a,b,c三者的关系服从a> (填含b,c的代数式),b,c,d三者的关系服从b> (填含c,d的代数式);
③ 平衡后,增大压强,容器内n(I2)将 ,n(PH4I)将 (填“增加”、“减小”或“不变”)。
六、(本题包括2小题,共18分)
22. (8分) 若某同系列的有机物通式为CnHn,它们都有多种同分异构体,C4H4为其中最简单的一种,按要求填空:
(1)若C4H4为链状结构,可把它看作是由两个乙炔分子加成得到的,其结构简式为 ;如果在一定条件下使它与H2充分加成,所生成物质的同分异构体的名称是(系统命名法) ;
(2)若C4H4为平面环状结构,与Br2按1︰1加成,加成的产物只有一种,该加成产物不可能发生的反应是
A 取代反应 B 加成反应 C 氧化反应 D 酯化反应 E 加聚反应
(3)若C4H4为正四面体结构,C8H8为正六面体结构,它们每个碳原子分别与三个碳原子通过单键相连,则符合上述结构的C8H8的二元取代物有 种。
23.
![]()
![]() (10分)已知:HCN的结构为H—C≡N,R—CN
RCOOH,R—Cl+CN- R—CN+Cl-
(10分)已知:HCN的结构为H—C≡N,R—CN
RCOOH,R—Cl+CN- R—CN+Cl-
![]() (R为烃基)。玉米芯、甘蔗渣等废物水解发酵后可制得糠醛
,
它是重要的化工原料,它在一定条件下可发生以下变化:
(R为烃基)。玉米芯、甘蔗渣等废物水解发酵后可制得糠醛
,
它是重要的化工原料,它在一定条件下可发生以下变化:
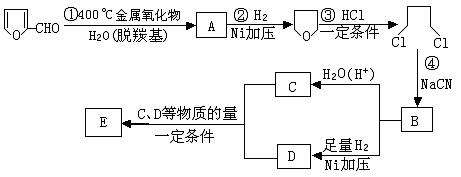
⑴写出反应类型:② ,④ 。
⑵写出反应③的化学方程式: ;
写出能证明糠醛中含有醛基的一个化学反应方程式 。
⑶若E为环状化合物,则其结构简式 。
⑷若E为高聚物,则其结构简式 。
七、(本题包括2小题,共18分)
24. (8分) 向Cu与CuO的混合物中加入混酸(硝酸和硫酸)后加热,使之恰好完全反应,反应中不产生SO2和Cu(NO3)2,硝酸的还原产物只有NO,且得到NO 8.96L(标准状况)。将溶液冷却后刚好全部结晶(无其它任何残留物)得到CuSO4·5H2O 250g。
求①混酸中硝酸和硫酸的物质的量之比,
②原混合物中Cu和CuO的物质的量之比,
③混酸中硫酸的质量分数。
25. (8分) 2006年苏北五市全面使用乙醇汽油,这种车用乙醇汽油是指在汽油组分油中按体积混合比 加入10%的变性燃料乙醇后,作为汽油车燃料用的汽油。
(1)4.6 g CH3CH2OH完全燃烧生成水和二氧化碳,则转移电子的物质的量为 。
(2)烃A是汽油的主要成分之一。取11.4 g烃A,置于一定体积的氧气中,点燃使之充分反应后,恢复到标准状况气体体积减少x L。将剩余气体经过碱石灰吸收,碱石灰质量增加y g。数据见下表(表中所有体积均在标准状况下测定)。
| 氧气体积为20 L | 氧气体积为30 L | 氧气体积为40 L | |
| x | 2.22 | 10.08 | 10.08 |
| y | 4.3 | 35.2 | 35.2 |
11.4 g烃A中含碳的物质的量是 mol,含氢的物质的量是 mol。该烃的分子式是 。
化学试题参考答案
一、单项选择题(本题包括8小题,每小题4分,共32分。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | D | A | C | B | D | B | A | C |
二、不定项选择题(本题包括8小题,每小题4分,共32分。)
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | D | BD | C | CD | B | AC | D | C |
三、(本题包括2小题,共22分)
17.(10分)(1)蓝色晶体完全变为白色粉末 (3分) 4 (2分)
(2)环形玻璃搅拌棒 塑料板 隔热效果要好 偏大 固体NaOH溶于水放热(每空1分,共5分)
18. (12分) (1)有无色气泡产生 (1分) ,2HCO3— + H2C2O4 = 2H2O + 2CO2↑+ C2O42— (2分)
(2) 2 5 6—2 10 8 (2分) (3)防止倒吸(或防止B中液体倒吸至A中); (1分)
![]() (2分)
(2分)
(4)草酸受热分解产生CO2,CO2使澄清石灰水变浑浊,过量CO2使浑浊又变澄清; 由于大量草酸蒸气逸出,与石灰水反应生成草酸钙沉淀; ①;增加了冷凝回流装置,避免草酸蒸气逸出。(每空1分, 共4分)
四、(本题包括2小题,共18分)
19.(8分) (1)LiOH HClO NaOH H4SiO4 (每空1分,共4分)
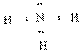
![]() (2) HF HBr
(每写对一个 1分,共2分)
(2) HF HBr
(每写对一个 1分,共2分)
(3) (每写对一个 1分,共2分)
20.(10分)(1)氧气;Na2SO4;离子。 (每空1分,共3分)
(2)A、B。 (2分)
(3)400℃~500℃,催化剂。 (1分)
(4)2Na2O2+2H2O=4NaOH+O2↑。 (2分)
①将q导管口插入水面下,打开分液漏斗活塞,反应后,q导管口有气泡冒出则证明反应放热。 (1分)
②打开分液漏斗活塞,使之反应,然后用带火星的木条置于p管口,木条复燃则证明有O2生成。 (1分)
五、(本题包括1小题,共10分)
21. (12分)①(d-c)/6 b+8c/3-2d/3 ②a>b+2c b>2d/3-8c/3 ③减小 增加 (每空2分)
六、(本题包括2小题,共18分)
22.(8分)(1) ![]() ; 2—甲基丙烷;(2) D
(3) 3 (每空2分,共8分
; 2—甲基丙烷;(2) D
(3) 3 (每空2分,共8分
23 .(10分)⑴加成反应 取代反应(各1分,共2分)
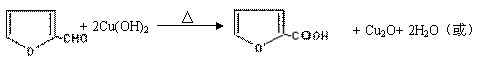 ⑵
⑵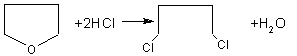 (2分)
(2分)

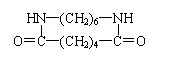
![]()
![]()
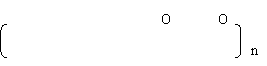 ⑶
(2分)
⑶
(2分)
⑷ (2分)
七、(本题包括2小题,共18分)
24、(8分)(1)n(HNO3):n(H2SO4)
(8.96/22.4):(250/250)=0.4:1=2:5 (2分)
(2)n(Cu):n(CuO) 3:2
(3分)
(3)W(H2SO4) 98/[(250+0.4×30-0.6×64-0.4×80)]×100%=51.1% (3分)
25.(8分)
(1)1.2 mol (2分)
(2)0.8 (2分) 1.8 (2分) C8H18 (2分)