高三第五次月考化学试题
命题人:刘海军 时间:90分钟 总分:100分
相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27 S:32 Cl:35.5 Fe:56 Cu:64
第Ⅰ卷
一、选择题(每小题有1个选项符合题意,每小题均为3分,共48分)
1.相同温度下,物质的量浓度均为1mo![]() /L的下列溶液,盐酸、硫酸、醋酸,导电能力由强到弱的顺序是
/L的下列溶液,盐酸、硫酸、醋酸,导电能力由强到弱的顺序是
A.盐酸=硫酸=醋酸 B.盐酸>硫酸>醋酸
C.硫酸>盐酸>醋酸 D.醋酸>盐酸>硫酸
2.水是一种极弱的电解质,在室温下平均每n个水分子只有1个分子发生电离,n值为
A.1×10-14 B.55.6×107 C.1×10-7 D.55.6
3.向某稀醋酸溶液中滴加一定量的氢氧化钠溶液后,若溶液中CH3COO-的物质的量等于加入NaOH的物质的量,则此时溶液的酸碱性情况是
A.酸性 B.碱性 C.中性 D.无法确定
4.物质的量浓度均为0.01mol/L的一元酸和一元碱两种溶液,其PH值分别为3和12,两种溶液等体积混合后溶液的PH值将
A.≥7 B.>7 C.≤7 D.=7
5.向碳酸钠溶液中加入氢氧化钙(固体)至CO32-沉淀完全后,过滤测得滤液的总质量比原NaCO3溶液减少0.13g。若将反应后的溶液稀释至1L,所得溶液的PH值为
A.14 B.13 C.12 D.10
6.在PH=1的含有M g2+、Fe2+、Al3+的三种离子的溶液中,可能存在的阴离子是
① Cl- ②NO3- ③SO42- ④S2-
A.①② B.②③ C.③④ D.①③
7.将等质量的锌(wg)分别投入VL,PH=3的盐酸和醋酸中,结果发现一种溶液中Zn有剩余,有关叙述正确的是
A.0.0325<W<0.065V B.产生H2的量醋酸多于盐酸
C.平均反应速率盐酸大于醋酸 D.w≤0.0325v
8.在盛有水的电解槽中加入等物质的量的Ag+、Pb2+、Na+、SO42-、NO3-、Cl-溶液摇匀后用惰性电极电解,通电片刻后,氧化产物与还原产物的质量比为
A.8:1 B.16:207 C.35.5:108 D.435:648
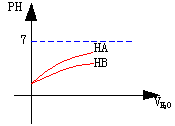 9.常温下等体积PH=2的两种酸溶液HA和HB,分别加水稀释,其PH值与所加水的体积变化如图所示,下列结论正确的是
9.常温下等体积PH=2的两种酸溶液HA和HB,分别加水稀释,其PH值与所加水的体积变化如图所示,下列结论正确的是
A.酸HB是比HA更强的酸。
B.酸HA是比HB更强的酸。
C.稀释前HA的物质的量浓度比HB大。
D.稀释后HB的物质的量浓度比原来大。
10.20ml 1mol/L的醋酸溶液与40ml 0.5mol/L NaOH溶液相混合,所得溶液中离子浓度由大到小的顺序是
A.[ Na+] >[CH3COO-]>[OH-]>[H+] B.[Na+]=[CH3COO-]>[OH-]>[H+]
C.[Na+]>[OH-]>[CH3COO-]>[H+] D.[Na+]>[OH-]>[H+]>[CH3COO-]
11.有一种钮扣微型电池,其电极分别为Ag2O和Zn电解质溶液是KOH溶液,俗称银锌电池,该电池的电极反应式为:Zn+2OH--2e==ZnO+H2O Ag2O+H2O+2e==2Ag+2OH-根据以上提供的资料,判断下列说法正确的是①锌为负极,Ag2OO 正极;②放电时正极附近溶液的PH值升高;③放电时负极附近溶液的PH值升高;④溶液中阳离子向正极方向移动,阴离子向负极方向移动。
A.都正确 B.只有①② C.①②③ D.①②④
12.在分别盛有饱和KCl溶液和CuSO4溶液的两个电解槽(电极均是石墨)串联起来,通电一段时间后,在甲池(饱和KCl)的阴极收集到11.2L气体(标准状况下)。那么不考虑其它损耗,在乙池(CuSO4溶液)的阳极收集到的气体体积是(标准状况下)
A.5.6L B.11.2L C.22.4L D.44.8L
13.下列有关金属冶炼的说法中,不正确的是
A.用电解熔融氯化钠的方法得到活泼金属钠
B.在加热的情况下利用氢气还原三氧化二铝得到金属铝
C.用铝热反应原理炼得熔点较高的金属铬
D.热分解法直接加热HgO得到金属Hg
14.现有Mg、Al混合物粉末10.2克,将它溶解在500ml 4mol/L的盐酸中,若要使沉淀量达到最大值,则需要加入2 mol/L NaOH溶液体积是
A.500ml B.1000ml C.2000ml D.不能确
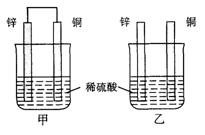 15.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
15.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
 D.产生气泡的速度甲比乙慢
D.产生气泡的速度甲比乙慢
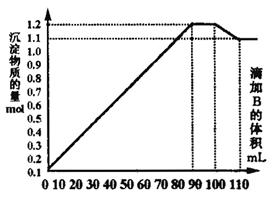
16.向amL BaCl2、AlCl3和FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B。产生沉淀的物质的量n和加入B的体积关系如图所示,下列叙述正确的是
A.90 mL B时,A溶液中金属离子沉淀完全
B.110 mL B时,沉淀物仅为BaSO4
C.B溶液中Na2SO4和NaOH的物质的量之比为1∶1
D.当溶液中含有NaAlO2时,加入B溶液体积:V(B)≥100 mL
第Ⅱ卷
二、填空题(共52分,每空均为2分)
17.称取三份锌粉,分别盛于甲、乙、丙三支试管中,按下列要求另加物质后,塞上导管塞子,定时测定生成氢气的体积。甲加入50 mL pH=3的盐酸,乙加入50 mL pH=3的醋酸,丙加入50 mL pH=3的醋酸及少量胆矾粉末。若反应终了,生成氢气的体积一样多,且没有剩余的锌,请用“>”“=”或“<”回答:
(1)开始时反应速率的大小为________。
(2)三支试管中参加反应的锌的质量为________。
(3)反应终了,所需时间为________
18.合金A由四种单质组成,经一系列反应后分别转化成沉淀或气体。
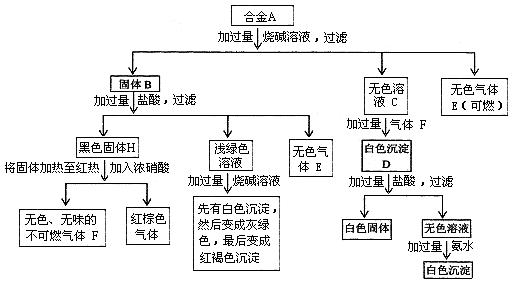
请回答下列问题:
(1)合金A由哪4种单质组成(写出化学式): _ 、 _ 、 _ 、 _ 。
(2)写出黑色固体H生成气体F的化学反应方程式 _ 。
(3)写出向无色溶液C通过量气体F生成白色沉淀D的有关反应的离子方程式:
、 。
19.航天技术中使用的氢氧燃料电池具有高能、轻便和不污染环境等优点。氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应方程式都可表示为2H2+O2=2H2O。酸式氢氧燃料电池的电解质是酸,其负极反应可表示为2H2-4e-=4H+,则正极反应表示为______________________;碱式氢氧燃料电池的电解质是碱,其正极反应表示为O2+2H2O+4e-=4OH-,则负极反应可表示为_________________________。
20.银器皿日久表面逐渐变黑色,这是由于生成硫化银,有人设计用原电池原理加以除去其处理方法为:取一内壁用NaOH溶液处理过的铝制易拉罐,放入一定浓度的食盐溶液,再将变黑的银器浸入溶液中,放置一段时间后,黑色会褪去而银不会损失。试回答:在此原电池反应中,负极发生的反应为______________。正极发生的反应为______________。原电池发生的总反应化学方程式为______________________。
21.实验室有一瓶混有少量NaCl杂质的NaOH固体试剂,为准确测其纯度,采用盐酸滴定法进行测定。
①称取WgNaOH固体试剂配制成100.00mL水溶液备用;
②将浓度为Cmol/L的标准盐酸装在用标准盐酸润洗过的25.00mL酸式滴定管中,调节液面位置在零刻度以下,并记下刻度;
③取V1 mL NaOH待测溶液置于洁净的锥形瓶中,加入2-3滴甲基橙指示剂充分振荡,然后用浓度为C mol/L的标准盐酸滴定,用去盐酸V2 mL,试回答:
(1)配制准确浓度的NaOH溶液;必须使用的主要仪器是______________。如有1mol/L和0.1mol/L的标准盐酸应选用_______mol/L盐酸。
(2)滴定终点时溶液颜色由__________突变为_____________色。
(3)若滴定前酸式滴定管尖嘴气泡未排出,滴定后气泡消失,会使碱测定值_________(偏大、偏小、无影响)。
(4)不用标准盐酸润洗酸式滴定管,会使碱测定值__________(偏大、偏小、无影响)。
(5)固体试剂NaOH纯度计算公式为 。
22.甲、乙两瓶新制氯水浓度均为0.1mol/L,如果向甲瓶中加入适量NaHCO3晶体,片刻后,甲、乙两瓶中HClO的物质的量的浓度关系是甲 乙(填大于、小于或等于),并比较盐酸、次氯酸、碳酸三种酸的酸性强弱
23计算题:合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3
(1)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4︰5,其中Fe2+与Fe3+物质的量之比为___________。
(2)当催化剂中Fe2+与Fe3+的物质的量之比为1︰2时,其催化活性最高,此时铁的氧化物混合物中铁的质量分数为___________(用小数表示,保留2位小数)。
(3)以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
2Fe2O3+C![]() 4FeO+CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入炭粉的质量为_________g。
4FeO+CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入炭粉的质量为_________g。
高三第五次月考化学答卷
相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27 S:32 Cl:35.5 Fe:56 Cu:64
一选择题(每小题3分,共48分)
| 题 次 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答 案 | ||||||||
| 题 次 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答 案 |
二、填空题(共52分,每空均为2分)
17. (1)_____ ___。(2)___ _____(3)___ _____
18. (1) _ 、 _ 、 _ 、 _ 。
(2) _ 。
(3) 、 。
19. __________ ____________; _________ ________________。
20. _______ _______、________ ______
__________ ____________。
21.(1) _________ _____、____ ___、(2) _______突变为________色。
(3)_________、(4)__________、(5) 。
22. 、
23(1)_______ ____。(2)____ _______(3)______ ___。
高三第五次月考化学答卷
一选择题(每小题3分,共48分)
| 题 次 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答 案 | C | B | C | B | C | D | B | A |
| 题 次 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答 案 | B | A | D | A | B | B | C | C |
二、填空题(共52分,每空均为2分)
17. (1)甲=乙=丙。(2)丙>甲=乙(3)甲>乙>丙
![]() 18. (1)C 、Fe、
Al 、 Si
18. (1)C 、Fe、
Al 、 Si
(2)C+4HNO3(浓) 4NO2↑+CO2↑+2H2O
(3)AlO2-+CO2+2H2O =Al(OH)3↓+HCO3- SiO32-+2CO2+2H2O =H2SiO3↓+2HCO3-。
19. O2 +4H++4e-=2H2O 2H2 +4OH--4e-=4H2O
20. 2Al-6e-=2Al3+ 3Ag2S+6e-=6Ag + 3S2-
2Al+3Ag2S+6H2O=6Ag+2Al(OH)3↓+3H2S↑
21.(1) 100ml容量瓶、 0.1 (2)黄突变为橙色。
(3)偏大、 (4)偏大、 (5)![]() %
%
22.大于、 HCl >H2CO3 >HClO
23(1) 1:1 (2) 0.72 (3) 6