高三级化学二诊考前演练试题
相对原子质量:H—1 C—12 O—16 Na—23 Al—27 Cl—35.5 Fe—56
6.生活中的某些问题常常涉及化学知识。下列有关叙述不正确的是
A.棉花和蚕丝的主要成分都是蛋白质
B.甲醛是某些劣质装饰板材释放的常见污染物之一
C.臭氧是饮用水的理想消毒剂之一,因为它杀菌能力强且又不影响水质
D.“水滴石穿”主要是溶解了CO2的雨水与CaCO3长期作用,生成了可溶性的Ca(HCO3)2
7.下列离子方程式中书写正确的是
A.碳酸氢铵溶液与足量的氢氧化钠溶液反应:NH4++OH-==NH3·H2O
B.钠与水反应:Na+2H2O==Na++2OH-+H2↑
C.铜和稀硝酸反应:3Cu+8H++2NO3-==3Cu2++2NO↑+4H2O
D.碳酸钠溶液显碱性:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
8.设NA表示阿伏加德罗常数,下列叙述正确的是
A.在标准状况下,11.2LNO与11.2L O2混合后气体分子数为0.75NA
B.7.8g Na2O2与足量的CO2反应时转移的电子数为0.2NA
C.1L 1mol/L的醋酸溶液中所含离子总数为2NA
D.常温常压下,16g O3所含的原子数为NA
9.中学化学课本中有大量的数据。下面是某学生对数据的应用,其中不正确的是
A.用两种卤素离子的半径数据比较其还原性的相对强弱
B.用质量数数据比较元素金属性的强弱
C.用溶解度数据解释长时间加热Mg(HCO3)2溶液得到的固体是Mg(OH)2而不是MgCO3
D.用沸点数据推测用蒸馏的方法分离液体混合物的可能性
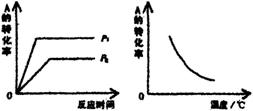 10.现有可逆反应:mA(g)+nB(g)
10.现有可逆反应:mA(g)+nB(g)![]() xC(g);
xC(g);
ΔH=akJ·mol-1。该反应在不同温度和压强(P1、P2)条件下,反应物A的转化率的变化情况如图所示。下列判断正确的是
A.a<0,m+n<x B.a<0,m+n>x
C.a>0,m+n<x D.a>0,m+n>x
11.下列关于电解质溶液的叙述中正确的是
A.Na2CO3、NaHCO3两种盐的溶液中,离子种类不相同
B.常温下1mol/L的CH3COOH溶液与1mol/L的NaOH溶液等体积混合,所得混合液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.溶质的物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH4+)前者小于后者
D.常温下,某溶液中由水电离出的c(H+)为1×10-5mol/L,则此溶液可能是盐酸
12.下列说法不正确的是
A.活性炭、SO2、Na2O2都能使品红溶液褪色,但原理不同
B.同温同压下,两份相同质量的铁粉,分别与足量的稀硫酸和稀硝酸反应,产生气体的体积不相等
C.将SO2气体通入BaCl2溶液中至饱和,未见沉淀生成,继续通入NO2则有沉淀生成
D.将Cl2通入NaBr、NaI的混合液中,反应后将溶液蒸干并充分灼烧,剩余的固体物质成分为NaCl
13.下列实验操作或安全事故处理中,正确的做法是
A.淀粉在稀H2SO4存在下水解,取水解后的溶液加入银氨溶液并微热,看其是否产生银镜,以验证水解产物
B.欲测某溶液的pH,需先用蒸馏水润湿pH试纸,再用洁净、干燥的玻璃棒蘸取该溶液并点在pH试纸上,观察试纸的颜色并与标准比色卡比较
C.不慎将浓硫酸沾在皮肤上,应立即NaOH溶液冲洗
D.将浓H2SO4和乙醇按体积比3︰1混合,置于圆底烧瓶中加热,使温度迅速升高到170℃以制取乙烯
26.(16分)双酚-A的二甲基丙烯酸酯是一种能使人及动物的内分泌系统发生紊乱,导致生育及繁殖异常的环境激素,其结构简式为:
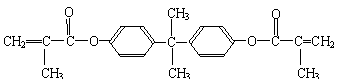
它在一定条件下水解可生成双酚-A和羧酸H两种物质。
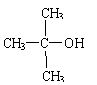 |
已知与 结构相似的醇不能被氧化为醛或酸。羧酸H可以由以下途径制得:
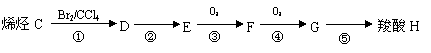 |
(1)双酚-A的分子式为 ;下列关于它的叙述中正确的是 (填写字母)。
A.与苯酚互为同系物
B.可以和Na2CO3溶液反应,放出CO2气体
C.分子中所有碳原子可能在同一平面上
D.与浓溴水反应,最多可消耗4mol Br2
(2)下列物质中与双酚-A互为同分异构体的是 (填写字母)。
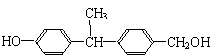 | |||
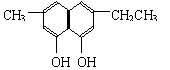 | |||
A. B.
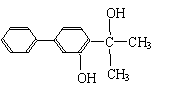 | |||
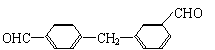 | |||
C. D.
(3)C的结构简式 ,其名称为 。
(4)G中所含官能团为 (填名称),⑤的反应类型为 。
(5)反应③的化学方程式为 。
(6)羧酸H与甲醇反应后得到的酯,能形成一种高分子化合物,可用于制造高级光学仪器透镜,请写出该酯在一定条件下生成此高分子化合物的化学反应方程式:
。
| 得分 | 评卷人 |
27.(15分)单质A、B、C在常温下均为气态,分别由甲、乙、丙三种短周期元素组成;丙元素的原子结构中次外层电子数比最外层电子数多1;G是常见的金属单质,D在常温下为液态,H是一种黑色晶体。各物质间的转化关系如下图所示(反应条件多数已略去);
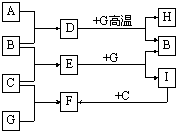
请回答:
(1)甲、乙两种元素还可形成一种含有4个原子核和18个电子的化合物,该化合物的电子式为 。
(2)实验室制取C的离子反应方程式为 ;
G与D在高温下反应的化学方程式为 。
(3)B在C中燃烧的现象是 。
在通常状况下,1gB在A中完全燃烧,生成液态D时,放出142.9kJ的热量,则表示B燃烧热的热化学方程式为 。
(4)以石墨为电极电解E的水溶液,其阳极反应为 。
(5)实验室检验F的水溶液中所含金属阳离子的操作方法
。
| 得分 | 评卷人 |
|
|
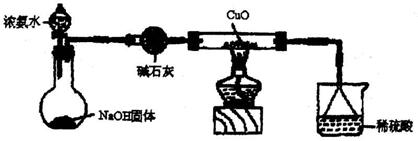
28.(17分)利用如图所示的装置和其他必要的仪器用品,完成下列实验。
(1)证明氨气具有还原性。已知2NH3+3CuO![]() N2+3Cu+3H2O。
N2+3Cu+3H2O。
①碱石灰的作用是 ,稀硫酸的作用是 。
②浓氨水与固体NaOH接触,为什么会逸出大量氨气?
。
③证明NH3具有还原性的实验现象是 。
(2)用吸收了足量尾气的溶液制取少量硫酸亚铁铵晶体。已知:硫酸亚铁铵是淡蓝绿色晶体,在空气中性质比较稳定。常温下硫酸亚铁铵在水中的溶解度(随温度的升高而增大)小于硫酸铵、硫酸亚铁。制备硫酸亚铁铵的化学方程式:(NH4)2SO4+FeSO4+6H2O==(NH4)Fe(SO4)2·6H2O。若溶液的pH>8.1,Fe2+将转化为沉淀。
①吸收了a mol气体后,烧杯中的溶液能使酚酞变红。试依据“化学实验设计基本要求”设计制备硫酸亚铁铵溶液的方案,请简述实验方法。
。
②为了从溶液中分离出硫酸亚铁铵晶体,还需要进行的实验操作是
。
| 得分 | 评卷人 |
29.(12分)Fe和Al是两种常用的金属,将它们按一定的质量比组成混合物。
(1)取一定质量的该混合物,向其中加入足量的NaOH溶液,生成气体的体积在标准状况下为nL,则反应的离子方程式为 ,混合物中的Al的物质的量为 (用含字母的数学式表示)。
(2)另取相同质量的该混合物,向其中加入足量的稀硫酸,固体全部溶解,生成气体的体积在标准状况下为mL,则反应中转移电子的物质的量为 ,混合物中Fe的质量为 (用含字母的数学式表示)。
(3)向(2)所得的溶液中加入过量的氢氧化钠溶液,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中铝的质量分数为 。
化学参考答案
6.A 7.C 8.D 9.B 10.B 11.C 12.B 13.D .
26.(共16分,每空2分) (1)C15H16O2; D (2)A、C
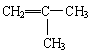 |
(3) (4)羟基、羧基;消去反应
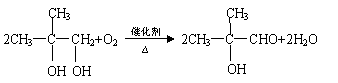 |
(5)
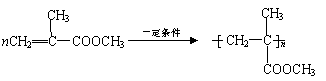 |
(6)
27.(共15分)(1)(2分)![]()
(2)(每空2分)MnO2+4H++2Cl-
![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
|
(3)(每空2分)氢气在氯气中安静燃烧,发出苍白色火焰;
![]()
(4)(2分)![]()
(5)(3分)取少量溶液置于一支试管中,滴入几滴KSCN溶液,观察溶液是否变红色,如果变红,则证明有Fe3+(其他合理答案均可给分)
28.(17分)(1)①吸收水蒸气(2分) 吸收氨气(2分)
②NaOH吸收溶液中水分放热,使溶液温度升高,氢氧根离子浓度增大,都有利于氨气的逸出(共4分,加点处和横线处各2分。其他正确结果参照本标准给分)
③黑色粉末变为红色(有无色液滴产生)(2分)
(2)①加入稀H2SO4调节溶液至酸性(共2分,加点处和横线处各1分,答“调pH8.1以下”给分);加入约0.5amol硫酸亚铁的浓溶液,搅拌(共2分,加点处和横线处各1分,答“硫酸亚铁”给分) ②加热浓缩(1分);冷却结晶(1分),过滤(1分)
29.(共12分)(1)(每空2分)![]()
(2)(每空3分)m/11.2 mol; 56(m-n)/22.4g (3)(2分)30%