高三级化学科二轮复习训练题
第I卷
可能用到的相对原子质量:K39 Ca40 Na23 Mg24 Al27 Zn65 Fe56 H1 Cu64 Ag108 F19 Cl35.5 Br80 I127 O16 S32 N14 P31 C12 Si28 Ba137
一、选择题(本题共10小题,每小题3分,共30分,每小题只有一个选项符合题意)
1.下列各组物质的分类都正确的是(括号里的是类别)( )
A.空气(混合物)、C2H5OH(醇)、H2SO4(离子化合物)、CO2(非电解质)
B.液氨(氢化物)、NH4Cl(铵盐)、HNO3(氧化性酸)、NaOH(强电解质)
C.HCl(共价化合物)、CH3COOH(羧酸)、Na2O2(碱性氧化物)、CH3I(卤代烃)
D.NO2(酸性氧化物)、CH3CHO(有机物)、CO(有机物)、CH3COOCH3(酯)
2.下列叙述中正确的是( )
A.CO2分子内含有极性键,所以CO2分子是极性分子
B.分子晶体、原子晶体中一定含有共价键,离子晶体一定含有离子键
| |
D.某非金属元素从游离态变成化合态时,该元素一定被还原
3.下列说法或表示正确的是
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨)=C(金刚石);△H=+119kJ/mol,可知金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,若将含1molCH3COOH的溶液与含1molNaOH的溶液混合,放出的热量小于57.3kJ
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l);△H=-285.8kJ/mol
4.在元素周期表短周期中的X和Y两种元素可组成化合物XY3,下列说法正确的是( )
A.XY3晶体一定是离子晶体
B.若Y的原子序数为m,X的原子序数不可能是m±4
C.X和Y可属于同一周期,也可属于两个不同周期
D.X和Y一定不属于同一主族
5.下列离子方程式或化学方程式,正确的是( )
A.NaOH溶液中加入小苏打溶液:OH-+HCO3-=CO32―+H2O
B.氯化铁溶液中通入硫化氢气体:2Fe3++S2-=S↓+2Fe2+
C.向Fe(OH)3中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
D.氯化铝溶液中加入过量氨水:4NH3·H2O+Al3+=4NH4++AlO2-+2H2O
6.向含1mol HCl和1mol MgSO4的混合溶液中加入1mol·L—1的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是( )
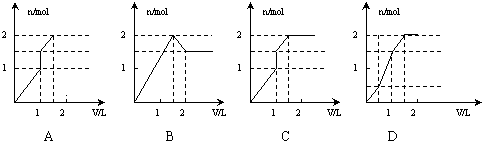 |
7.工业由粗硅制取纯硅有以下反应:
①Si(s)+3HCl(g) ![]() SiHCl3(g)+H2(g);△H=-318kJ·mol—l
SiHCl3(g)+H2(g);△H=-318kJ·mol—l
②SiHCl3(g)+ H2(g) ![]() Si(s) +3HCl(g);
Si(s) +3HCl(g);
下列关于上述反应的说法中不正确的是
A.反应①、②均为氧化还原反应 B.反应①、②均为置换反应
C.反应②一定吸热 D.欲提高SiHCl3产率,可减压或升温
8.下列实验操作中,错误的是( )
(1)用托盘天平称取5.2gNaCl ;
(2)用50mL量筒量取5.2mL盐酸;
(3)用蒸发皿加热KNO3溶液制取KNO3晶体;
(4)用100mL容量瓶配制50mL0.1mol/LH2SO4溶液;
(5)用带玻璃塞的棕色试剂瓶存放浓HNO3;
(6)用煤油液封保存锂、钠、钾单质
A.(2)(3)(5) B.(2)(4)(5) C.(1)(4)(6) D.(2)(4)(6)
9.某研究性学习小组为了探索镁粉与溴水反应的机理,做了如下四组实验:
①将镁粉投入冷水中,未见任何现象;
②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色逐渐褪去;
③将镁粉放入液溴中,未观察到任何明显现象;
④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。
则下列关于镁与溴水的反应机理的论述中正确的是( )
A.镁粉只直接与溴水中的溴反应
B.镁粉只与溴水中的酸反应
C.产生极少量的气泡是由于镁粉与水反应得到
D.镁粉在水的催化下与溴发生反应
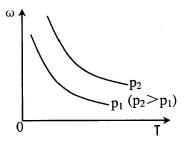
10.在密闭容器中,反应2A(g) ![]() B(g)达到化学平衡时,平衡混合物中某组分质量分数(ω)与压强(p)和温度(T)的关系可用下图曲线表示。下列说法中,正确的是
B(g)达到化学平衡时,平衡混合物中某组分质量分数(ω)与压强(p)和温度(T)的关系可用下图曲线表示。下列说法中,正确的是
A.增大压强,混合气体平均相对分子质量增大
B.升高温度,平衡向正反应方向移动
C.纵坐标表示A的质量分数
D.该反应的△H>0
二、选择题(每题有一至二个正确选项。正确答案有二个时,只选一个正确答案得2分,答案中只要有一个选项错误,得0分。共40分。)
11.有人建议用AG表示溶液的酸碱度,AG定义为AG=lg[c(H+)/c(OH-)],在AG=12的某无色溶液中能大量共存的离子组是
A.Na+、Al3+、SO42-、NO3- B.K+、Na+、HCO3-、Cl-
C.NH4+、K+、Cl-、I- D.Cu2+、Fe2+、SO42-、NO3-
12.纽扣电池的电极反应为:Zn+2OH—=ZnO+H2O+2e-;Ag2O+H2O+2e—=2Ag+2OH-。下列说法中,错误的是
A.Zn是负极,Ag2O是正极
B.电池放电时,电解质溶液的pH基本保持不变
C.Ag2O发生了还原反应
D.电池放电时,溶液中OH- 向正极移动,H+向负极移动
13.脑白金中主要成分的结构简式如图。下列对脑白金主要成分的推断错误的是
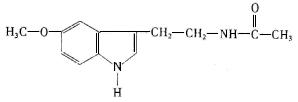
A.其分子式为C13H16N2O2 B.它能水解得到乙酸
C.该物质是苯的同系物 D.该物质不属于蛋白质或蛋白质的水解产物
14.关于下列的实验描述中,错误的是
A.做乙酸乙酯的水解实验时,向加有乙酸乙酯的试管中加入适量NaOH溶液,并放在酒精灯火焰上加热
B.只用溴水就可以将苯、四氯化碳、苯酚溶液、乙醇、乙烯五种液体区别开来
C.除去CO2中混有的SO2,可将混合气体通过盛有饱和NaHCO3溶液的洗气瓶
D.现需1mol/L的NaOH溶液90mL,配制时需取用NaOH固体的质量为4.0g
15.常温下,甲、乙两种醋酸稀溶液,甲的pH=3,乙的pH=4,下列叙述正确的是
A.等体积的甲、乙两种溶液分别与足量的锌充分反应,甲中产生的H2大于10倍乙中产生的H2
B.物质的量浓度c (甲)=10 c (乙)
C.若把甲用水稀释至pH=4,则稀释后的体积小于原来溶液体积的10倍
D.将甲稀释10倍,溶液pH变为4
16.短周期元素A、B、C原子序数依次递增,它们原子的最外层电子数之和为10,A和C处于同主族,B原子最外层电子数等于A原子次外层电子数,下列叙述不正确的是
A.原子半径:B>C>A
B.A、B、C的固态氧化物分别是分子晶体、离子晶体和原子晶体
C.A单质的熔点高于C单质的熔点
D.A与B或C均可形成离子化合物
17.某溶液中存在的离子有:S2-、HS-、OH-、Na+、H+:则下列对该溶液的有关叙述中正确的是
A.离子浓度一定是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
B.组成该溶液的溶质只能是Na2S或NaHS或两者的混合物
C该溶液可能呈中性,或碱性,或酸性
D.离子物质的量的关系一定是2n(S2-)+n(HS-)+n(OH-)=n(Na+)+n(H+)
18.与铁相似,金属锡能溶于盐酸生成氯化亚锡,氯化亚锡又能被氯化铁氧化为氯化锡。则下列有关微粒氧化、还原能力的比较中,正确的是
A.氧化能力:Sn4+<Sn2+ B.氧化能力:Fe3+<Sn4+
C.还原能力:Fe2+<Sn2+ D.还原能力:Fe<Sn
19.用6.02×1023表示阿伏加德罗常数的值,下列说法中正确的是
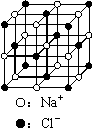 A.乙烯和丙烯的混合物1.4g中约含有6.02×1022个碳原子
A.乙烯和丙烯的混合物1.4g中约含有6.02×1022个碳原子
B.6.8 g熔融的KHSO4中含有6.02×1022个阳离子
C.23.4 g NaCl晶体中含有6.02×1022个右图所示的结构单元
D.电解精炼铜时转移了6.02×1022个电子,阳极溶解3.2 g铜
20.用含少量镁粉的铝粉制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是:
①加盐酸溶解 ②加烧碱溶液溶解
③过滤 ④通入过量CO2生成Al(OH)3沉淀
⑤加入盐酸生成Al(OH)3沉淀 ⑥加入过量烧碱溶液
A.①⑥⑤③ B.②③⑤③ C.②③④③ D.①③⑤③
第II卷
三、实验题(本题共3小题,共29分)
21.(12分)已知氨气跟氧化铜反应可以制备氮气,有关化学方程式:
![]() ,
,
纯氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水即剧烈反应生成氢氧化镁和氨气。
(1)下面是某化学课外小组的同学提出的实验制备氨气的几种方案
A.硫酸铵固体与消石灰共热 B.浓氨水逐滴加到新制的生石灰中
C.在一定条件下,氮气与氢气化合 D.加热分解氯化铵固体
你认为其中合理的方案有________________________(填字母);其反应的化学方程式为:_________________________________________________________________。
(2)该小组同学设计的制备氮化镁的方案有以下两个。分别见实验方案的装置图。且在实验前系统内的空气均已排除。
[方案一]
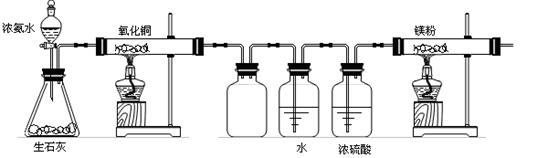
A B C D E F
①该实验完成后,能否得到纯净的氮化镁____________(填“能”或“不能”);简述理由__________________________________________________________________________。
②装置C的作用是____________________________________。
[方案二]
已知:![]()
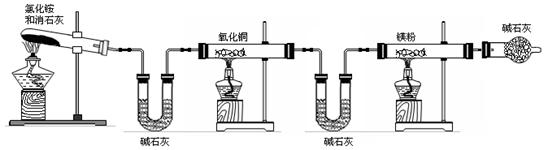
A B C D E F
①该方案中存在的主要问题是________________________________________________
____________________________________________________________。
②如何才能解决上述问题________________________________________________。
22.(8分)各地电视台的天气预报中都要预报城市的空气质量。预报中一般将城市空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)分为8个等级。目前,测定空气中SO2含量时主要用一些氧化还原法。
已知:SO2气体与酸性KMnO4溶液反应时,MnO4—被还原为Mn2+,SO2被氧化为SO42—。
现有药品:KMnO4固体、硫酸、颗粒吸附剂、品红试纸、pH试纸。
完成下列各题:
(1)配制250mL0.100mol/L的酸性KMnO4溶液需用的仪器有 、 、玻璃棒、胶头滴管、烧杯、量筒等。玻璃棒的作用是 和 。
(2)写出SO2与酸性KMnO4溶液反应的离子方程式:
;
(3)向200mL0.1mol/L的酸性KMnO4溶液通入空气至恰好褪色,若气体的流速为a cm3/min,当t min时,则空气中SO2的含量为 g/cm3 。
23.(9分)某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向滤液中滴加稀硫酸至溶液的pH=8~9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4:将得到的溶液蒸发浓缩、冷却、结晶、过滤、干燥。
请回答以下问题:
⑴上述实验中的过滤操作需要玻璃棒、____________、____________等玻璃仪器。
⑵步骤1过滤的目的是_________________________________________。
⑶当步骤2中的溶液pH=8~9时,检验沉淀是否完全的方法是______________________。
⑷步骤2中溶液的pH控制较难操作,可改用_________。有关反应的化学方程式为
。
四、(本题包括3小题,共31分)
24.(10分)短周期的四种元素A、B、C、D,原子序数依次增大。A、B、C三种元素原子核外电子层数之和是5。A、B两元素原子最外电子层上电子数之和等于C元素原子最外电子层上的电子数;B元素原子最外电子层上的电子数是它的电子层数的2倍,A和C可以形成化合物CA3;B与D的原子序数之比为3︰4。请回答:
(1)写出化合物CA3的电子式: 。
(2)由四种元素中的三种组成的甲、乙两种化合物,甲属于盐类,其溶液呈酸性,请用离子方程式表示其溶液呈酸性的原因 。
乙为常见的天然高分子化合物,写出该高分子化合物充分水解的化学方程式:
(3)丙、丁两种化合物,它们均含上述四种元素,既可以与盐酸反应又可以与NaOH溶液反应,丙为无机盐,其化学式为 ,丁为天然高分子化合物的水解产物,且是同类物质中相对分子质量最小的,其结构简式为 。
(4)A和B组成的化合物M,分子中A与B的原子个数比是3︰1,常温常压下,0.5 mol M完全燃烧放出780 kJ的热量,请写出表示M燃烧热的热化学方程式:
25.(10分)下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的重要条件及生成的水已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)反应①、②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常见的氮肥。(d)化合物L可用于漂白,可由Cl2与NaOH溶液反应制得。(e)化合物J由C、D两种元素组成,其相对分子质量为32。
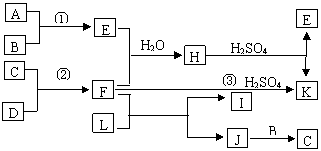
请按要求填空:
(1)反应③的化学方程式 。
(2)C的结构式 ;H的化学式 。
(3)L溶液与化合物E反应的离子方程式 。
(4)化合物J的化学式 。
26.(11分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
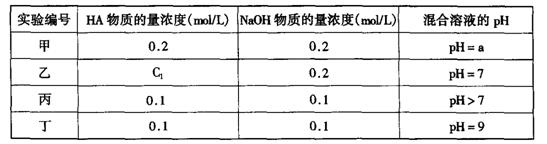
请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸
。
(2)不考虑其它组的实验结果,单从乙组情况分析,C1是否一定等于0.2mol/L (选填“是”或“否”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系是
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是 酸(选填“强”或“弱”)。
该混合溶液中离子浓度由大到小的顺序是
(4)丁组实验所得混合溶液中由水电离出的c(OH—)= mol/L
写出该混合溶液中下列算式的精确结果(不能做近似计算,回答准确值,结果不一定要化简)。
c(Na+)-c(A—)= mol/L
五、有机题(本题共1小题,共10分)
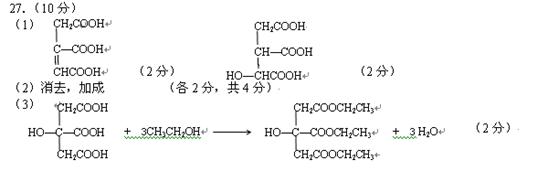
27.(10分)柠檬酸结构简式如下:
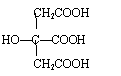
若将柠檬酸加热到150℃,则分子内失去一分子水而形成不饱和酸——顺乌头酸,后者在一定条件下会和水反应又生成柠檬酸和异柠檬酸两种异构体。
(1)写出顺乌头酸和异柠檬酸的结构简式:
顺乌头酸: 异柠檬酸: 。
(2)由柠檬酸转化为顺乌头酸的反应过程,属于 反应(填反应类型),
顺乌头酸转化为柠檬酸和异柠檬酸的反应过程,属于 反应(填反应类型)。
(3)传统塑料增塑剂为邻苯二甲酸双酯(DEHP)。因其结构中含苯环,可能致癌。柠檬酸酯无毒无味,可替代传统增塑剂。请写出用柠檬酸合成柠檬酸三乙酯(TEC)的化学方程式:
。
六、(本题分A、B二题,选做其中一题,每题10分)
28(A)(10分)已知:
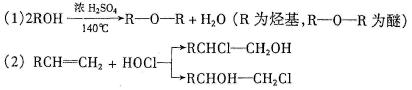
石油裂解得到C2H4可以合成很多物质,如下图:
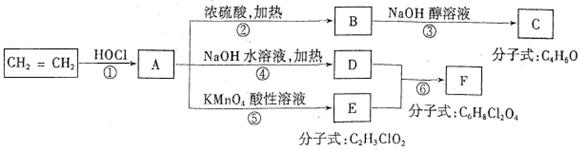
回答下列问题:
(1)写出结构简式F 。
(2)写出与A互为同分异构体的有机物结构简式有: 。
(3)上述反应中属于取代反应的是 (填反应序号①②③④⑤⑥)。
(4)写出B![]() C的化学方程式
C的化学方程式
。
(5)反应③中将B与NaOH的乙醇溶液共热,为检验生成产物C(已知:C的沸点小于40℃),某同学认为:将生成气体通入高锰酸钾酸性溶液中,若高锰酸钾溶液褪色,可证明有C生成。该同学的想法是否正确?若不正确,说明理由 。
28(B)(10分)(1)下图是部分元素的单质熔点的变化图,根据此图,填写下列空格:
⑦号元素的电子排布式为___________。②、④两元素形成的化合物其晶体有两种结构,其中一种结构与金刚石相似,该结构的晶体属__________晶体,若使其熔化,需破坏的作用力为__________。
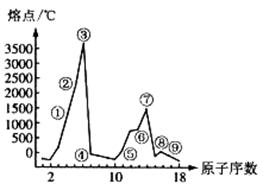
(2)参照表中物质的熔点,回答有关问题:
| 物质 | NaF | NaCl | NaBr | NaI | NaCl | KCl | RbCl | CsCl |
| 熔点℃ | 995 | 801 | 755 | 651 | 801 | 776 | 715 | 646 |
| 物质 | SiF4 | SiCl4 | SiBr4 | SiI4 | SiCl4 | GeCl4 | SnCl4 | PbCl4 |
| 熔点℃ | -90.2 | -70.4 | 5.2 | 12.05 | -70.4 | -49.5 | -36.2 | -15.0 |
①____________越大,________________越弱,故钠的卤化物及碱金属的氯化物的熔点依次降低。
②__________________越大,___________________越大,故硅的卤化物及硅、锗、锡、铅的氯化物的熔点依次升高。
③ 钠的卤化物的熔点比相应硅的卤化物的熔点高得多,这是由于_______________
______________________________________________________________。
化学科二轮训练题答题卷
一、二题答案栏:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 三、实验题(本题包括3小题,共29分) 21.(12分)你认为其中合理的方案有__________(填字母);其反应的化学方程式为: _______________________________________________________________________ ________。 (2)[方案一] ①能否得到纯净的氮化镁____________(填“能”或“不能”);简述理由__________________________________________________________________________。 ②装置C的作用是____________________________________。 [方案二] ①该方案中存在的主要问题是________________________________________________ ____________________________________________________________。 ②如何才能解决上述问题________________________________________________。 22.(8分)(1)配置200mL0.100mol/L的酸性KMnO4溶液需用的仪器有 、 、玻璃棒、胶头滴管、烧杯、量筒等。玻璃棒的作用是 和 。 (2)写出SO2与酸性KMnO4溶液反应的离子方程式: ; (3)空气中SO2的含量为 g/cm3 。 23.(9分)⑴上述实验中的过滤操作需要玻璃棒、____________、____________等玻璃仪器。 ⑵步骤1过滤的目的是_____________________________ ____________。 ⑶检验沉淀是否完全的方法是_ _____________________。 ⑷步骤2中溶液的pH控制较难操作,可改用_________。有关反应的化学方程式为 。 四、(本题包括3小题,共31分) 24.(10分) (1)CA3的电子式: 。 (2)用离子方程式表示其溶液呈酸性的原因 。 写出该高分子化合物充分水解的化学方程式:
(3)丙的化学式为 ,丁的结构简式为 。 (4)写出表示M燃烧热的热化学方程式:
25.(10分)(1)反应③的化学方程式 。 (2)C的结构式 ;H的化学式 。 (3)L溶液与化合物E反应的离子方程式 。 (4)化合物J的化学式 。 26.(11分)(1)说明HA是强酸还是弱酸 。 (2) C1是否一定等于0.2mol/L (选填“是”或“否”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系是 A.前者大 B.后者大 C.二者相等 D.无法判断 (3)HA是 酸(选填“强”或“弱”)。 该混合溶液中离子浓度由大到小的顺序是 (4)丁组实验所得混合溶液中由水电离出的c(OH—)= mol/L c(Na+)-c(A—)= mol/L 五、有机题(本题包括3小题,共10分) 27.(10分)(1)写出顺乌头酸和异柠檬酸的结构简式: 顺乌头酸: 异柠檬酸: 。 (2)由柠檬酸转化为顺乌头酸的反应过程,属于 反应(填反应类型), 顺乌头酸转化为柠檬酸和异柠檬酸的反应过程,属于 反应(填反应类型)。 (3)写出用柠檬酸合成柠檬酸三乙酯(TEC)的化学方程式:
。 28(A)(10分) (1)写出结构简式F 。 (2)写出与A互为同分异构体的有机物结构简式有: 。 (3)上述反应中属于取代反应的是 (填反应序号①②③④⑤⑥)。 (4)写出B 。 (5)该同学的想法是否正确?若不正确,说明理由 。 28(B)(10分)(1)⑦号元素的电子排布式为__ _________。②、④两元素形成的化合物其晶体有两种结构,其中一种结构与金刚石相似,该结构的晶体属__________晶体,若使其熔化,需破坏的作用力为__________。 (2)①____________越大,________________越弱 ②__________________越大,___________________越大 ③这是由于_____________ __ __________________________________。 |
参考答案
一、二题答案:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| B | C | C | C | A | D | D | D | D | A |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| AC | D | C | A | A | D | CD | C | AC | C |
21.(12分)(方程式各2分,其余未注明的每空1分)
(1)A、B;(2分)
![]()
![]()
(2)[方案一]
①不能;由于在F装置后缺少一干燥装置,部分![]() 将与空气中的水蒸气发生水解反应生成氢氧化镁,导致产品不纯。(2分)
将与空气中的水蒸气发生水解反应生成氢氧化镁,导致产品不纯。(2分)
②防止D中的液体倒吸到B中,缓冲气流作用(1分)
[方案二]
①由于氮气中混有氨气,且氨气也可与镁粉反应,造成产品不纯。(1分)
②可将装置D换成一装有浓硫酸的洗气瓶并在装置C与装置D之间加一安全瓶。或在装置C与装置D之间顺序加入安全瓶和装有水的洗气瓶。(2分)
22.(8分)(1)250mL容量瓶、托盘天平;搅拌和引流。 (每空1分,共4分)
(2)5SO2+2MnO4-+2H2O = 2Mn2++5SO42-+4H+;(2分)
(3)3.2/at (2分)
23.(9分) (1)烧杯 漏斗 (各1分) (2)除去铁等不溶于碱的杂质(1分)
(3)取上层清夜,逐滴加入稀硫酸,若变浑浊说明沉淀不完全,若不变浑浊说明沉淀完全(2分)
(4)通入足量的CO2气体(2分)
CO2+2H2O+NaAlO2=NaHCO3+Al(OH)3↓(2分)
24.(10分)

25.(10分)
(1)2NH3 + H2SO4 ==(NH4)2SO4
(2)N≡N (NH4)2SO3(或NH4HSO3 )
(3)ClO-+ SO2 + 2OH- = SO42-+ Cl- + H2O
(4)N2H4
26.(11分)

28(A)(每小题2分)
(1)CH2Cl-COO-CH2-CH2-OOC-CH2Cl
(2)CHCl(OH)-CH3 CH2Cl-O-CH3
(3)②④⑥
(4)CH2Cl-CH2-O-CH2-CH2Cl+2NaOH![]() CH2=CH2-O-CH2=CH2+2NaBr+2H2O
CH2=CH2-O-CH2=CH2+2NaBr+2H2O
(5)不正确,因为挥发出来的乙醇也可使酸性高锰酸钾溶液褪色。
28(B)(10分)(1)1s22s22p63s23p2 (2分) 原子(1分) 共价键(1分)
(2)①离子半径,阴阳离子间的静电作用(2分)
②相对分子质量,分子间作用力(2分)
③钠的卤化物形成的晶体是离子晶体,硅的卤化物形成的晶体是分子晶体(2分)