高三上册理科复习班期中考试化学试题
时量:90分钟 满分:100分
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 S-32 Cu-64
第I卷 选择题(共48分)
一、选择题(本题共16小题,每题3分,共48分,每小题只有一个最佳选项)
1.氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是:
A.一个D2O分子所含的中子数为8 B.NH3含有极性共价键
![]() C.HCl的电子式为
D.热稳定性:H2S>HF
C.HCl的电子式为
D.热稳定性:H2S>HF
2. 设NA代表阿佛加德罗常数,下列说法正确的是( )
A.22.4L N2中所含的分子数为NA
B.15.6g Na2O2与足量水反应,转移的电子数为0.4NA
C.500mL 浓度为0.1mol/L pH为3的醋酸溶液中H+数目为0.05NA
D.56gN2与CO的混合气体中原子数为4NA
3.用高能![]() 核轰击
核轰击![]() 核,发生核合成反应,得到新原子
核,发生核合成反应,得到新原子![]() ,该原子中中子数与核外电子数之差为:
,该原子中中子数与核外电子数之差为:
A.161 B.53 C.108 D.55
4下列化学式既能表示物质的组成,又能表示物质分子式的是( )
A.NH4Cl B.SiO2 C.H2O2 D.Cu.
5.下列反应对应的离子方程式中正确的是 ( )
A.FeCl3溶液中加入铁粉:Fe+Fe3+ 2Fe2+
B.NH4HSO4溶液中加入少量NaOH:NH![]() +OH-
+OH- NH3·H2O
C.饱和石灰水与饱和CaCl2溶液混合:Ca2++2OH-===Ca(OH)2↓
D.氯气通入Na2SO3溶液中:Cl2+SO![]() +H2O
+H2O
SO![]() +2HCl
+2HCl
6.质量分数不同的两种酒精溶液,以相同质量混合时,所得混合溶液密度为
ρ1;以相同体积混合时,所得混合溶液密度为ρ2。则ρ1、ρ2之间大小关系正确的是:
A.ρ1>ρ2 B.ρ1=ρ2
C.ρ2>ρ1 D.不能确定
7.在一定条件下,RO3n--和氟气可发生如下反应:RO3n-- + F2 + 2OH-- = RO4-- + 2F-- + H2O 则下列说法正确的是 :
A.R位于ⅤA族 B.R2在常温常压下一定是气体
C.R元素的最低化合价为-1价 D.n=2
8. 下列有关物质存放的叙述中,正确的是( )
A. 氯气液化后贮存于钢瓶中
B. 金属钠保存在无水乙醇中
C. 冷的浓H2SO4存放于敞口铝制容器中
D. 液溴保存在带有橡皮塞的玻璃试剂瓶中
9.下列说法正确的是:
A.用酒精或CCl4可提取碘水中的碘单质
B.NaCl和SiC的化学键类型相同
C.H2S和SiF4分子中各原子最外层都满足8电子结构
D.24Mg32S晶体中电子总数与中子总数之比为1∶1
10.下列说法正确的是:
A.ⅠA族元素的金属性比ⅡA族元素的金属性强
B.第三周期元素的离子半径从左到右逐渐减小
C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强
D.离子化合物一定含非金属元素
11.下列说法正确的是:
A.H与D,16O2与18O2互为同位素
B.H216O、D216O、H218O、D218O互为同素异形体
C.在NaCl晶体中,每个氯离子周围都有8个钠离子
D.L层电子为奇数的所有短周期元素所在族的序数与该元素原子的L层电子数相等
12.. 已知
① H2(g)+1/2O2(g)=H2O(g); △H1= a KJ/mol
② ②2H2(g)+O2(g)=2H2O(g); △H2= b KJ/mol
③ H2(g)+ 1/2O2(g)=H2O(l); △H3= c KJ/mol
④ ④2H2(g)+O2(g)=2H2O(l); △H4= d KJ/mol下列关系式中正确的是( )
A.a<c<0 B.b>d>0 C.2a=b<0 D.2c=d>0
13. 19.2毫克铜跟适量的浓硝酸反应,铜全部作用后共收集到气体8.96毫升(标准状况),反应消耗的HNO3的物质的量可能是( )×10-3摩尔.(不考虑NO2与N2O4之间的转化)
A.0.8 B.0.9 C.1.0 D.1.2
14.同主族两种元素原子的核外电子数的差值可能为:
A.6 B.12 C.30 D.26
15. 2.1克镁 铝合金完全溶于足量的盐酸,生成氢气2.24L(标况),再向溶液中加入NaOH溶液生成沉淀的质量最大是( )
A.2.9g B.4.6g C.5.5g D.6.9g
16. 某固体仅由一种元素组成,其密度为5g/cm3,用X射线研究该固体的结构表明,在边长1×10-7cm的立方体中含有20个原子,则该原子的相对原子质量最接近( )
A.32 B. 65 C. 120 D.150
 化学试题
化学试题
姓名 分数
一、选择题(本题包括16小题,每题小3分,共48分,每小题只有一个最佳选项)
| 题序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
第II卷(共52分)
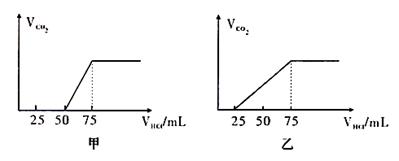
17.(12分)有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后取此溶液100mL,并向此稀释后的溶液中逐滴加入0.1mol/L的HCl溶液,产生的CO2气体体积(标况)与所加入的盐酸的体积之间的关系如下图所示:
|
试分析(1).NaOH在吸收CO2气体后,在甲所得溶液中存在的溶质是 ,其物质的量之比是 ,
产生的CO2气体体积(标况)是 。
(2).乙所得溶液中存在的溶质是 。
其物质的量之比是 ,产生的CO2气体体积(标况)是 。
18.(13分)短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素。
试回答下列问题:
(1)A在周期表中的位置_________________。
(2)A、B、C三种元素形成的简单离子的半径由大到小的顺序是________________(用离子符号表示)。
(3)A、C、D形成的化合物CD2、D2A、DA2中,各原子都满足最外层8电子结构的是__________________(请填写具体的化学式);B2A2所含化学键的类型有________________________。
(4)CA2与含1.5 molD的一种含氧酸(该酸的某盐在有催化剂存在的条件下常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,则该反应的化学方程式是______________________________________。
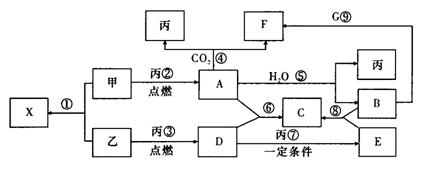
19.(15分)甲、乙、丙为常见单质,乙、丙两元素在周期表中位于同一主族,丙为无色气体。X、A、B、C、D、E、F、G均为常见的化合物,其中A和X的摩尔质量相同。G的焰色反应为黄色。在一定条件下,各物质相互转化关系如下图:
|
请回答:
(1)用化学式表示:丙为 ,C为 ,X的电子式为 , E为 (极性、非极性)分子。
(2)写出A与H2O反应的化学反应方程式
。
(3)写出B与G溶液反应的离子方程式: 。
(4)在上图的反应中,不属于氧化还原反应的是(填序号) 。.
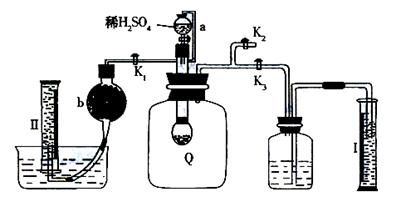
20.(12分)为了测定已部分变质的过氧化钠样品的纯度,设计如图所示的实验装置,图中Q为弹性良好的气球,YC称取一定量的样品放入其中,按图安装好仪器,打开了漏斗的活塞,将稀硫酸滴入气球中。请填空:
|
(1)Q内发生化学反应时,生成的气体是 。
(2)为了测定反应生成气体的总体积,滴加稀硫酸之前,K1、K2、K3中应
当关闭的是 ,应当打开的是 。
(3)当上述反应停止,将K1、K2、K3均处于关闭状态,然后先打开K2,
再缓缓打开K1,这时可观察到的现象是
。
(4)b中装的固体试剂是 ,为什么要缓缓打开K1?
(5)实验结束时,量筒I中有xmL水,量筒II中收集到ymL气体(已折
算成标准状态)则过氧化钠的纯度的数学表达式是
(化成最简表达式)。
参 考 答 案
第I卷(3×16=48分)
1~5 BDBCC 6~10 CCADD 11~15 DCCCC 16 D
第II卷(6+8+15+15+8=52分)
18. 17. (13分)(1)第二周期ⅥA族 (2分)
(2)S2->O2->Na+(3分)
(3)SCl2、Cl2O (2分) 离子键和共价键(或非极性共价键)(2分)
(4)![]() =
=![]() (4分)
(4分)
19.(1)O2、CO2 (2)K1、K2 K3
(3)①气球逐渐变小 ②量筒II中有气体进入,水被排出
(4)碱石灰 控制气流量,使CO2能被碱石灰充分吸收
(5)78y/(53x+25y)
20.NaOH和Na2CO3 1:1 0.056L Na2CO3和NaHCO3 1:1 0.112L
19. 1)O2 Na2SO4 Na+[ : S : ]2-Na+
(2)2H2O+2Na2O2=4NaOH+O2↑ (3)OH-+HCO![]() =CO
=CO![]() +H2O
+H2O
(4)⑧⑨