高三化学高考热身测试题
化 学 试 题

可能用到的相对原子质量:H 1 C 12 N 14 O 16 Fe 56 Na 23
一、单项选择题(本题包括8小题,每小题4分,共32分。每小题只是一个选项符合题意)
1.安全是头等大事。下列预防或处理事故的方法可行的是
A、煤矿工人可以先用明火伸入矿井以检测瓦斯的存在
B、可以往矿井中充入大量的二氧化碳气体以防止瓦斯爆炸
C、化工厂爆炸时可用湿布捂住口鼻、眼睛等并躲在低洼处
D、进入地窖前应先用点燃的蜡烛放入以防因缺氧而使人窒息
2.易燃易爆有毒的物质在其包装上应贴上警告标签。下面所列物质贴错了标签的是
| A | B | C | D | |
| 物质的化学式 | 浓H2SO4 | CCl4 | P4 | CH2(ONO2 )CH(ONO2)CH2ONO2 |
| 危险警告标签 | 腐蚀品 | 易燃品 | 剧毒品 | 爆炸品 |
3.下列有关物质分类或归类正确的是
①混合物:石炭酸、福尔马林、水玻璃、水银 ②化合物:CaCl2、烧碱、聚苯乙烯、HD
③电解质:硫酸、胆矾、冰醋酸、硫酸钡 ④同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
⑤同素异形体:C60、C70、金刚石、石墨
A.①③④ B.②④ C.②③④ D.③⑤
 4.有关化学用语正确的是
4.有关化学用语正确的是
A、乙烯的最简式C2H4 B、明矾的化学式 KAlSO4•12H2O
C、乙酸的分子式 C2H4O2 D、四氯化碳的电子式 ![]()
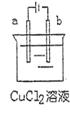
5.右图是用惰性电极电解饱和氯化铜溶液的装置,有关判断不正确的是
A.电解过程中溶液的pH值增大
B.a极是阳极,发生还原反应
C.阴阳极得到的电极产物的物质的量之比大于等于1∶1
D.电解一段时间后,b电极的质量增加
6.下面是某加碘食盐包装袋上的部分图表文字。由此你得到的信息和作出的推测正确的是
 |
A.“加碘食盐”1 kg中含碘单质(35±15) mg。
B.加碘食盐放久后会可能被氧化而呈紫黑色。
C.凭肉眼不能判断该食盐是否加碘盐。
D.“菜未烧熟不宜加入加碘盐”的原因可能是碘酸钾受热易挥发。
7.为提纯下列物质(括号内是杂质),所选用的除杂试剂(过量)和分离方法都正确的是
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 溴化钠溶液(NaI) | 溴水、CCl4 | 萃取、分液 |
| B | 氯化铵溶液(FeCl3) | NaOH溶液 | 过滤 |
| C | 一氧化碳(CO2) | 氧化铜粉末 | 通过灼热的CuO粉末 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |
8.在CH3COOH和CH3COONa组成的混合溶液中,下列离子浓度的关系不可能成立的是
A、c(CH3COO-)>c(Na+)>c(H+)>c(OH-) B、c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C、c(Na+)>c(CH3COO-) = c(OH-)>c(H+) D、c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
9.下列各组离子中,一定不能在指定溶液中大量共存的是
A.澄清透明的溶液:ClO-、MnO4-、Al3+、SO42-
B.能使pH试纸变深蓝色的溶液:Na+、AlO2-、S2-、SO32-
C.含有大量Fe2+的溶液:H+、I-、K+、Cl-
D.由水电离产生的c(H+)=1×10-12mol/L的溶液:NH4+、Na+、Cl-、NO3-
10.与Fe3O4相似,Pb3O4可以看作Pb的两种氧化物结合成的化合物,也可以看作是盐。已知Pb是ⅣA族元素,则Pb3O4也可写作为
A、PbO·Pb2O3 B、Pb(PbO2)2 C、2PbO·PbO2 D、Pb2PbO4
11.14C是碳的一种同位素原子。设NA为阿伏加德罗常数值,下列说法不正确的是
A、0.1 mol 14CH4分子所含中子数为NA
B、7 g 14C单质中所含质子数为3NA
C、常温常压下,17 g甲基(-14CH3)所含电子数为8NA
D、常温常压下,22.4 L 14CO2气体中所含的分子数小于NA
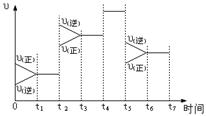 12.下图表示反应
12.下图表示反应![]() ,在某一时间段中反应速率与反应过程的关系图。下列说法正确是
,在某一时间段中反应速率与反应过程的关系图。下列说法正确是
A.t1-t2 SO3的百分含量最高
B.t2时可能是增大了压强
C. t5时可能是升高了温度
D. t3-t5一直处于平衡,正逆反应速率没有改变
13.下表中,对陈述I、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是
| 选项 | 陈述I | 陈述Ⅱ | 判断 |
| A | 工业上SO2氧化成SO3用常压 | SO2氧化成SO3是气体体积缩小的反应 | I对;Ⅱ对;有 |
| B | SO2可用于漂白纸浆 | SO2中硫呈+4价有氧化性 | I对;Ⅱ对;无 |
| C | 金属钠具有强还原性 | 高压钠灯发出透雾性强的光 | I对;Ⅱ对;有 |
| D | 石墨常用作电解池的电极 | 石墨的化学性质稳定且导电性好 | I对;Ⅱ对;有 |
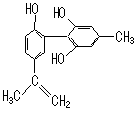 14.坚决反对运动员服用兴奋剂,是我国支持“人文奥运”的重要体现。某种兴奋剂的结构简式如右图所示,有关该物质及其溶液的说法不正确的是
14.坚决反对运动员服用兴奋剂,是我国支持“人文奥运”的重要体现。某种兴奋剂的结构简式如右图所示,有关该物质及其溶液的说法不正确的是
A.该分子中不可能所有氢原子在同一个平面上
B.1 mol该物质与浓溴水反应时,最多消耗3 molBr2
C.加入FeCl3溶液呈紫色,因为该物质属于酚类物质
D.滴入酸性高锰酸钾溶液,紫色褪去,可证明结构中存在碳碳双键
15.常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通CO2 气体,只能生成HX和NaHCO3;往NaY溶液中通入CO2则生成HY和Na2CO3。有关叙述正确的是
A.酸性由强至弱:H2CO3>HY> HX
B.结合H+的能力:Y―> X―> CO32―
C.溶液物质的量浓度相同时碱性:NaY >Na2CO3> NaX >NaHCO3
D.NaX溶液中通入足量CO2后的离子浓度:c(X―)>c(Na+)>c(HCO3―)>c(OH―)
16.将22.4g铁粉缓缓加入到含有HNO3 0.8mol的稀硝酸中(还原产物为NO),下列正确的是
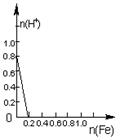
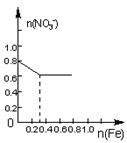
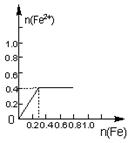
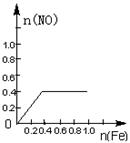
A B C D
三、(本题包括2小题,共21分)
17.(11分)某学生做元素性质递变实验时自己设计了一套方案,并记录了有关实验现象如下表
| 实验方案 | 实验现象 |
| 1.用砂纸打磨后的镁带与水反应,再向反应后溶液中滴加酚酞 | (A) |
| 2.向新制的氢硫酸饱和溶液中滴加新制的氯水 | (B)产生气体,可在空气中燃烧,溶液变成浅红色 |
| 3.钠与滴有酚酞的试液的冷水反应 | (C)反应不十分强烈,产生的气体可在空气中燃烧 |
| 4.镁带与2mol/L的盐酸反应 | (D)剧烈反应,产生可燃性气体 |
| 5.铝条与2mol/L的盐酸反应 | (E)生成白色胶状沉淀,然后沉淀消失 |
| 6.向氯化铝溶液中滴加氢氧化钠溶液至过量 | (F)生成黄色沉淀 |
请你帮助该同学完成实验报告:
(1)实验的目的 。
(2)实验仪器:① ② ③ ④试管夹⑤镊子⑥小刀⑦玻璃片⑧砂纸等
(3)实验内容:
与实验方案1—6对应的实验现象依次为 (填:字母编号)。
实验现象(A)为: 。
18.(12分)大约有85%的化学反应需要用催化剂,催化剂研究是十二一世纪化学研究的重要课题之一。
(1)现行高中化学课本第一册162页学生实验一中设计了CuO对KClO3分解的催化作用的实验,某化学兴趣小组对此产生了兴趣,研究CuO和MnO2对KClO3分解的催化性能。
实验装置:
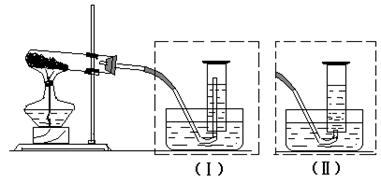
实验记录:
| 实验序号 | 试管中药品 | 加热时间 | 待测数据 |
| 1 | 8gKClO3 +2gMnO2 | 20s | |
| 2 | 8gKClO3+2gCuO | 20s |
问题与讨论
①这里的待测数据是____________________________
②测气体的体积,是选装置(Ⅰ)还是选装置(Ⅱ)? ________________
③实验开始时,是先把导管通入量筒中,还是先加热?理由是什么?
____________________________________________________________________
④实验时间到后,应如何操作?
____________________________________________________________________
(2)已知下列反应:2H2O2+2KMnO4+3H2SO4=K2SO4+MnSO4+5O2↑+8H2O。学生在做此实验时发现:在敞口容器中,当H2O2与酸化的KMnO4溶液混合后,开始产生氧气的速率很慢,一段时间后产生氧气的速率很迅速,经测定溶液的温度基本没变,该学生经过思考认为不可能是温度、浓度、压强的影响,只可能是催化剂的影响。为了证实自己的推断,设计了以下对比实验:
①空白实验; ②起始时加入少量K2SO4固体;
③起始时加少量______________ ④起始加入少量水
实验结果:起始反应速率③最快,④最慢,①②基本相同
请解释实验①过程中现象产生的原因____________________________________。
四、(本题包括2小题,共18分)
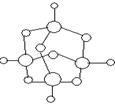 19.(8分)A、B、C、D、E、G、F均为短周期元素,且原子序数依次增大,A与D同主族,C与G同主族,A与B的质子数之和等于C的质子数,A+与C2-的核外电子数之和等于D+的核外电子数,B原子与D+的核外电子数之和等于F原子的核外电子数,E原子比B原子多8个电子。请回答下列问题:
19.(8分)A、B、C、D、E、G、F均为短周期元素,且原子序数依次增大,A与D同主族,C与G同主族,A与B的质子数之和等于C的质子数,A+与C2-的核外电子数之和等于D+的核外电子数,B原子与D+的核外电子数之和等于F原子的核外电子数,E原子比B原子多8个电子。请回答下列问题:
(1)比较D与G、A与E形成的两组化合物的熔点高低(用化学式和“>” 或“<”表示)_________________________________
(2)B的单质的电子式为__________________________
(3)E和C可形成如右图所示的化合物,该物质的化学式为 ______________
(4)A、B、C、F中的三种元素可形成多种化合物,其中既含有离子键,又含有共价键,且水溶液呈酸性的的化合物也不止一种,请用离子方程式表示其呈酸性的原因:
20.(10分)已知A为中学化学中的常见金属,X、Y为常见非金属,X、E、F、G、J常温下为气体,C为无色液体,B是一种盐,受热易分解。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图(部分反应的条件、生成物被略去):
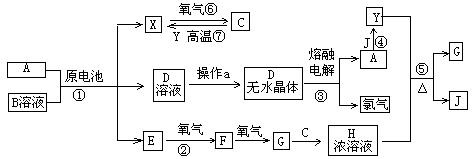
请回答下列问题:
(1)金属A为___________;操作a是_______________________________________
(2)反应⑤的化学方程式为_____________________________________________
反应⑦的化学方程式为_____________________________________________
(3)原电池反应①中,正极反应式为_____________________________________
五、(本题包括1小题,共9分)
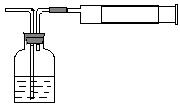 21.(1)小陈同学为测定新装修居室内甲醛含量是否超标,设
计了如右图的简易实验装置。请你帮助小陈同学选择试剂瓶内的药品________
21.(1)小陈同学为测定新装修居室内甲醛含量是否超标,设
计了如右图的简易实验装置。请你帮助小陈同学选择试剂瓶内的药品________
a、银氨溶液 b、酸性高锰酸钾溶液
c、新制氢氧化铜悬浊液
(2)合成氨工业中,原料气(N2、H2、少量CO的混合物)
在进入合成塔前常用醋酸二氨合铜溶液来吸收原料气中的CO,其反应是:
[Cu(NH3)2Ac]+ CO + NH3 ![]() [Cu(NH3)3]Ac·CO;△H<0
[Cu(NH3)3]Ac·CO;△H<0
①必须除去原料气中CO的原因是_____________________________________
②吸收CO后溶液经过适当处理又可再生,恢复其吸收CO的能力,以供循环使用,醋酸铜氨溶液再生的生产适宜条件应是___________________________
(3)通常人们把拆开1 mol化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
已知:Cl2(g)+3F2(g)=2ClF3(g);△H=-309.3kJ·mol-1
2F(g)=F2(g);△H=-157.7kJ·mol-1
2Cl(g)=Cl2(g);△H=-237.8kJ·mol-1
则ClF3分子中Cl-F化学键的键能为________________kJ·mol-1
六、(本题包括1小题,共18分)
22.(8分)300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水,没食子酸的结构简式为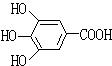 。
。
(1)用没食子酸制造墨水主要是利用了_______类化合物的性质(填代号)
A、醇 B、酚 C、油酯 D、羧酸
(2)没食子酸丙酯具有抗氧化作用,是目前广泛应用的食品添加剂,其分子式为___________________
(3)1 mol没食子酸与足量的NaHCO3溶液反应,产生CO2________L(标况)
(4)没食子酸的同分异构体有多种,其中苯环上只连有醛基和羟基的同分异构体共有__________种。
23.(10分)Ⅰ.对乙酰氨基酚,俗称扑热息痛,具有很强的解热镇痛作用,工业上通过以下方法合成(B1和B2、C1和C2分别互为同分异构体,无机产物已略去):
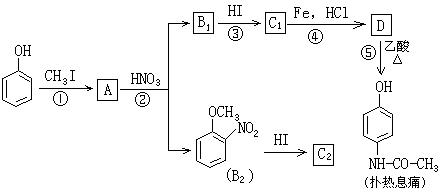
请按要求填空:
(1)上述①~⑤的反应中,不属于取代反应的是___________(填数字序号)
(2)设计反应①③的目的是______________________________
(3)写出反应③的化学方程式___________________________________
Ⅱ.已知:C4H9Cl![]() C4H9Li
C4H9Li![]() (C4H9)2CuLi
(C4H9)2CuLi![]() C4H9-C2H5
C4H9-C2H5
请以电石和苯为主要原料,其它无机试剂任选,合成 ,写出合成的流程图(格式如已知,在箭头上方写试剂,下方写条件)
,写出合成的流程图(格式如已知,在箭头上方写试剂,下方写条件)
七、(本题包括2小题,共20分)
24.(8分)氢氧化钠溶液中通入二氧化碳得到的溶液可能是碳酸钠溶液,可能是碳酸氢钠溶液,也可能是二者的混合溶液。
(1)某温度下,向100g某浓度的氢氧化钠溶液中通入过量的CO2气体后过滤,得到NaHCO3固体34.8g,求原氢氧化钠溶液的质量分数。(已知该温度下NaHCO3的溶解度为9g)
(2)用上述的氢氧化钠溶液制备纯的碳酸钠溶液,应如何操作?
25.(12分)硝酸工业尾气中的氮氧化物(NO、NO2)是大气的主要污染物之一,在排放前必须进行无害化处理。目前对硝酸工业尾气的处理主要有以下二种方法:
①氢氧化钠溶液吸收法,反应原理是:2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
NO + NO2 + 2NaOH = 2 NaNO2 + H2O
②氨催化还原法,反应原理是:___ NOx + ___ NH3 ![]() ___ N2 + ___ H2O
___ N2 + ___ H2O
现将含氮氧化物的体积分数为10%的硝酸工业尾气(设尾气中只有NO、NO2与NaOH溶液或氨反应)缓缓通过250 mL氢氧化钠溶液,并测量吸收后剩余气体的体积,当收集到剩余气体体积为100.8 L(已折合成标况下,无氮氧化物剩余)时,氢氧化钠溶液恰好反应完全,生成的NaNO3和NaNO2的物质的量之比恰好和原尾气中的NO和NO2的体积比相等。
(1)配平上述②的化学方程式。
(2)求所用氢氧化钠溶液的物质的量浓度。
(3)求尾气中NO的体积分数。
(4)若用氨氧化法处理上述尾气,尾气的流量Q为1.2 m3·min-1,氨气的转化率为80%,欲使尾气氮氧化物完全吸收,则氨气的流量应至少为多大?