08届高三化学物质结构元素周期律测试
一、选择题(下列各题只有一个选项符合题意。每小题4分,共48分。)
1.最近,意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子,并用质谱仪探测到了它存在的证据。若该氧分子具有空间对称结构,下列关于该氧分子的说法正确的是 ( )
A.是一种新的氧化物 B.不可能含有极性键
C.是氧元素的一种同位素 D.是臭氧的同分异构体
2.下列化合物中,既有离子键,又有共价键的是 ( )
A.CaO B.SiO2 C.H2O D.Na2O2
3.下列物质的电子式书写正确的是 ( )
![]() A.NaCl
A.NaCl ![]() B.H2S
B.H2S
C.-CH3 ![]() D.NH4I
D.NH4I ![]()
4.已知A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,原子半径按D、E、B、C、A的顺序依次减小,B和E同主族,下列推断不正确的是 ( )
A. A、B、D不可能在同周期 B.D一定在第二周期
C.A、D可能在同一主族 D.C和D的单质可能化合为离子化合物
5. X、Y、Z均为短周期元素。已知X元素的某种原子核内无中子,Y元素的原子核外最外层电子数是其次外层电子数的2倍,Z元素是地壳中含量最丰富的元素。有下列含该三种元素的化学式:①X2Y2Z2 ②X2YZ3 ③X2YZ2 ④X2Y2Z4 ⑤X3YZ4 ⑥XYZ3,其中可能存在对应分子的是 ( )
A.② D.②④ C.②⑤⑥ D.①②③④
6.下列说法中正确的是 ( )
A.NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8e-稳定结构;
B.P4和CH4都是正四面体分子且键角都为109o28ˊ;
C.NaCl晶体中与每个Na+距离相等且最近的Na+共有12个;
D.由原子间通过共价键而形成的晶体一定具有高的熔、沸点及硬度。
7.已知CsCl晶体的密度为![]() ,NA为阿伏加德罗常数,相邻的两个
,NA为阿伏加德罗常数,相邻的两个![]() 的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为
(
)
的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为
(
)
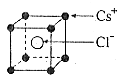 A.
A. ![]() B.
B.![]()
C. ![]() D.
D.![]()
8.下列物质中,含极性键和非极性键且分子有极性的是 ( )
A.乙烯 B.乙醛 C.甲醇 D.三氯甲烷
9. A、B为短周期元素,二者可以组合成多种中学生所熟知的化合物。在这些化合物中,A与B的原子个数比为A∶B=1∶2。已知A的原子序数为n,B的原子序数是①n+2
②n+3 ③n+4 ④n+5 ⑤n+8 ⑥n-5 ⑦n-7 ⑧n-8中的几种,其中不符合题目要求的是 ( )
A.①④ B.②⑧ C.③⑤ D.⑥⑦
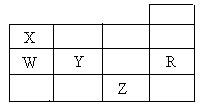 10.右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
( )
10.右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
( )
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
11.下列说法正确的是 ( )
A.常温常压下,只有一种元素的单质呈液态
B.周期表中所有元素都是从自然界中发现的 C.过渡元素不全是金属元素
D.常温常压下,气态单质的分子都是由非金属元素的原子形成的
12.下列说法中正确的是 ( )
A.金属Na、Mg、Al的硬度依次降低 B.HI、HBr、HCl、HF的沸点依次降低
C.氯化钠和氯化氢溶于水时,破坏的化学键都是离子键
D.C60气化和I2升华克服的作用力相同
二、(本题包括4小题,共60分)
13.(07年高考理综重庆卷 ) (14分) a、b、c、d、e是短周期元素,周期表中a与b、b与c相邻;a与e的最外层电子数之比为2:3,b的最外层电子数比e的最外层电子数少1个;常见化合物d2c2与水反应生成c的单质,且溶液使酚酞试液变红。
(1) e的元素符号是__________。
(2)a、b、c的氢化物稳定性顺序为(用分子式表示)______________________;b的氢化物和b的最高价氧化物的水化物反应生成Z,则Z中的化学键类型为_________________,Z的晶体类型为_____________;ab-离子的电子式为____________。
(3)由a、c、d形成化合物的水溶液显碱性,其原因是(用离子方程式表示)______________________________________________。
(4)一定量的d2c2与ac2反应后的固体物质,恰好与0.8 mol稀盐酸溶液完全反应,并收集到0.25 mol气体,则用物质的量表示该固体物质的组成为__________________、___________________。
14.(18分)已知X、Y、Z、W是元素周期表中短周期中的四种非金属元素,它们的原子数依次增大,X元素的原子形成的阳离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。试回答:
(1)写出下列元素的元素符号
X 、Y 、Z 、W 。
(2)X单质和Z单质在一定条件下反应生成化合物E,该反应的化学方程式为(请注明反应条件) 。E分子的空间构型为 ,电子式为 。E在催化剂存在的条件下可用于还原汽车尾气中的 ,以减少对大气的污染。
(3)仅由X、Z、W三种元素组成的某种盐是一种速效肥料,但长期施用会使土壤酸化,有关的离子反应方程式为 。
(4)这四种元素可组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序),该化合物的水溶液与足量NaOH溶液反应的离子方程式 。
(5)将9g单质Y在足量W单质中燃烧,所得气体通入lL lmol·L-1NaOH溶液中,完全吸收后,溶液中的各离子浓度由大到小的顺序是 。
15.(16分)X、Y、Z为短周期元素的单质,U、V为它们的化合物,这些物质之间的关系如图5-3所示,其中反应条件和某些产物已经略去:
(1)如果X、Y的组成元素是同主族的,写出反应Ⅰ的化学反应方程式:
①若已知V是水:___________________________;
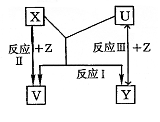 ②若已知U、V均为氧化物_________________________。
②若已知U、V均为氧化物_________________________。
(2)如果X、Y的组成元素不同主族时,按下列要求回答问题。
①X组成元素是地壳中含量最多的金属元素时,则X、Y、Z的化学式是:X为____________;Y为_____________;Z为___________。
②若Y组成元素在自然界中形成的化合物种类最多时,则V、U的化学式是:V为______________;U为_____________。
③若Z是通常情况下密度最小的物质,则反应Ⅰ的化学反应方程式:
_______________________________________________。
16.(12分)A~J是中学化学中常见的几种物质,它们之间的转化关系如下图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F化合生成,J可作禽流感、SARS等病毒的杀菌消毒剂。
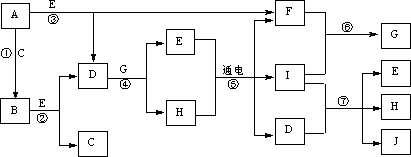
(1)写出E、B的电子式:B_______________。E 。
(2)写出反应⑦的离子方程式:_________________________________。
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式:____________________________________________________________。
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则阳极的电极反应式为:__________________。_____________极(填“阴”或“阳”)附近溶液由无色变为红色。
答案:
一、选择题
| 题目 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | B | D | C | B | D | C | A | B | C | D | D | D |
二、13.(共8分,每空2分)
、(14分)(1)S。
(2)CH4<NH3<H2O; 共价键和离子键; 离子晶体; ![]() 。
。
(3)CO32 -+H2O![]() HCO3- +OH- 或 C2O42 -+H2O
HCO3- +OH- 或 C2O42 -+H2O![]() HC2O4- +OH-。 (4)0.3 mol Na2O2、0.1 mol Na2CO3
HC2O4- +OH-。 (4)0.3 mol Na2O2、0.1 mol Na2CO3
![]()
![]() 14.(1)H C N O (2)3H2+N2
2NH3 三角锥形
NO,NO2
14.(1)H C N O (2)3H2+N2
2NH3 三角锥形
NO,NO2
![]() (3)NH4++H2ONH3·H2O+H+ (4)NH4++HCO3-+2OH-=NH3↑+ +2H2O
(3)NH4++H2ONH3·H2O+H+ (4)NH4++HCO3-+2OH-=NH3↑+ +2H2O
(5)c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
提示:(1)X元素原子形成的离子就是一个质子,则X为氢元素。Y原子的最外层电子数是内层电子数的2倍,Y只能是碳元素。周期表中相邻元素的单质常温下均为无色气体的只有氮气和氧气。
(3)仅由X、Z、W三种元素组成的某种盐是一种速效肥料,则该盐为NH4HO3,由于NH4+水解,溶液呈酸性,所以长期使用NH4NO3会使土壤酸化。
(4)这四种元素组成的原子个数比为5∶1∶1∶3的化合物是NH4HCO3,它与足量NaOH反应生成NH3和Na2CO3,即NH4HCO3+2NaOHNH3↑+Na2CO3+2H2O。
![]() (5)9g碳为
生成的CO2也是0.75mol,n(NaOH)=1L×1mol·L-1=1mol。
(5)9g碳为
生成的CO2也是0.75mol,n(NaOH)=1L×1mol·L-1=1mol。
没完全吸收后,溶液中Na2CO3、HaHCO3物质的量分别为x、y,由Na原子守恒、C原子守恒可得
所以完全吸收后的溶液中含0.25mol Na2CO3和0.5mol NaHCO3的混合物,溶液中离子浓度由大到小的顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
15.(1)①![]() ②
②![]()
(2)①![]() ②
②![]() ③
③![]()
16.(1) ![]() (2分)
(2分)
(2)Cl2+2OH-![]() Cl-+C1O-+H2O(2分)
Cl-+C1O-+H2O(2分)
(3)4AlCl3+6Na2O2+6H2O![]() 4Al(OH)3↓+12NaCl+3O2↑(2分)
4Al(OH)3↓+12NaCl+3O2↑(2分)
(4)2C1--2e-![]() Cl2(2分) 阴(2分)
在阴极H+不断放电,破坏了水的电离平衡,促使水继续电离,导致溶液中c(OH-)>c(H+),所以阴极附近溶液变红(2分)
Cl2(2分) 阴(2分)
在阴极H+不断放电,破坏了水的电离平衡,促使水继续电离,导致溶液中c(OH-)>c(H+),所以阴极附近溶液变红(2分)