08届高三化学第一学期期中调研考试试题
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分120分。考试时间100分钟。
第一卷(选择题 共48分)
注意事项:
1.回答第I卷前,考生务必在答题卡姓名栏内写上自己的姓名、考试科目、准考证号,并用2B铅笔涂写在答题卡上。每小题选出正确答案后,用2B铅笔把答题卡上对应题号的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案。
2.回答第Ⅱ卷前,考生务必在答题纸密封线内写上自己的姓名和准考证号,Ⅱ卷的答题内容应填写在答题纸的相应位置上。
3.第I卷和第Ⅱ卷答案写在试卷上无效。考试结束后,将答题卡和答题纸一并交回。
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Mg-24 Al—27 P-31
S-32 K-39 Ca-40 Fe-56 Cu-64
一、选择题(本题包括8小题,每题3分,共24分。每小题只有一个选项符合题意)
1.气体分子中的极性键在红外线的照射下,易像弹簧一样作伸缩和弯曲运动,从而产生热量。下列气体不属于温室效应气体的是
A.CO2 B.N2O C.CH4 D.N2
2.已知“凡气体分子总数增多的反应一定是熵增大的反应”。一定条件下,下列反应不可能自发进行的是
A.2O3(g)=3O2(g) △H<0 B.2CO(g)=2C(s)+O2(g) △H>0
C.N2(g)+3H2(g)=2NH3(g) △H<0 D.CaCO3(s)=CaO(s)+CO2(g) △H>0
![]() 3.下列化学用语表达正确的是
3.下列化学用语表达正确的是
A.丙烷的分子结构模型示意图:
![]() B.Na2S的电子式:
B.Na2S的电子式:
C.丙烯的结构简式:CH3CH2CH2
D.氢硫酸的电离方程式:H2S+H2O=H3O++HS-
4.下列有关物质分类的说法正确的是
A.O2和O3、H2和D2、H![]() O和H
O和H![]() O都互为同素异形体
O都互为同素异形体
B.纯碱、烧碱、碱式碳酸铜都属于碱类物质
C.煤、石油和天然气都属于化石能源
D.CH2Cl2、CH4O、C2H4O2一定是纯净物
5.下列有关物质类别判别的依据正确的是
A.原子晶体:晶体的熔点是否很高 B.电解质:水溶液是否导电
C.离子化合物:是否含有离子键 D.共价化合物:是否含有共价键
6.下列过程或现象与盐类水解无关的是
A.加入硫酸铜溶液加快制氢气的速度 B.硫酸铝溶液不能置于铁质容器中
C.用热的纯碱溶液去除油污 D.浓硫化钠溶液有硫化氢的气味
 7.下列大小或强弱比较正确的是
7.下列大小或强弱比较正确的是
A.原子半径:Cl>S B.稳定性:HCl>HBr
C.酸性:H2SiO3>H2CO3 D.碱性:Al(OH)3>Mg(OH)2
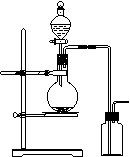
8.可用右图装置制取(必要时可加热)和收集的气体是
A.氯酸钾溶液与二氧化锰反应制氧气
B.浓氨水与氢氧化钙固体制氨气
C.乙醇和浓硫酸(170℃)制乙烯
D.铜和浓硝酸制二氧化氮
二、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得1分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
9.阿伏加德罗常数约为6.02×1023mol-1。下列叙述中正确的是
A.32g含有少量臭氧的氧气中,共含有氧原子1.204×1024
B.在标准状况下,2.24L己烷中所分子数约为6.02×1023
C.12.5 mL 16 mol/L浓硫酸与足量铜反应,生成SO2的分子数约为6.02×1022
D.2.7g铝与足量氢氧化钠溶液反应转移的电子数约为1.806×1023
10.下列各组离子可能大量共存的是
A.pH=1的溶液中:Fe2+、Al3+、HCO3—、MnO4—
B.能与金属铝反应放出氢气的溶液:K+、NO3—、Cl-、NH4+
C.含有大量OH-的无色溶液中:Na+、Cu2+、AlO2—、SiO32—
D.常温下水电离出的c(H+)·c(OH-)=10-20的溶液中:Na+、C1-、S2-、SO32—
11.下列离子方程式书写正确的是
A.用氨水溶解氯化银沉淀:Ag++2 NH3·H2O=[Ag(NH3)2]++2 H2O
B.向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+NH4++H++SO42—=BaSO4↓+NH3·H2O+ H2O
C.硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++H2O2 +2H+=2Fe3++2H2O
D.向次氯酸钠溶液中通入足量SO2气体:ClO-+ SO2+ H2O = HClO+ HSO3—
12.下列有关化学事实或现象的解释正确的是
A.合金在潮湿的空气中形成原电池,故其耐腐蚀性都较差
B.氯化钠溶于水也有化学过程,是因为离子键发生了断裂
C.升高温度反应速率加快,原因是活化分子百分数增加
D.铝的金属性较强,所以铝制容器在空气中容易被腐蚀
13.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水的离子反应是:
4FeO42—+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-。工业上先制得Na2FeO4,然后在低温下,向Na2FeO4溶液中加入一定量KOH,可制得K2FeO4。下列说法中不正确的是
A.K2FeO4溶液有丁达尔效应 B.K2FeO4溶液具有吸附性
C.K2FeO4溶液能除去氧化性杂质 D.上述制得K2FeO4的反应为复分解反应
14.下列溶液中各微粒的浓度关系正确的是
A.物质的量浓度相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中c(NH4+):
c[(NH4)2SO4] > c(NH4HSO4) > c(NH4Cl)
B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA—)+c(A2—)
D.1.0mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
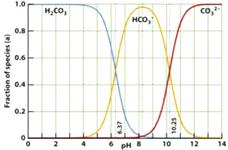 15.下图是一水溶液在pH从0至14的范围内,H2CO3、HCO
15.下图是一水溶液在pH从0至14的范围内,H2CO3、HCO![]() 、CO
、CO![]() 三种成分平衡时的组成百分率,下列叙述正确的是
三种成分平衡时的组成百分率,下列叙述正确的是
A.此图是1.0mol/L碳酸钠溶液滴定1.0 mol/L
HCl溶液的滴定曲线
B.在pH为6.37及10.25时,溶液中
c(H2CO3)= c(HCO![]() )= c(CO
)= c(CO![]() )
)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO![]() 的形式存在
的形式存在
D.若用CO2和NaOH反应制取Na2CO3,溶液的pH必须控制在12以上
16.世界上60%的镁是从海水中提取的,其主要步骤如下:
①把贝壳制成石灰乳;②在海水中加入石灰乳,过滤,洗涤沉淀物;③将沉淀物与盐酸反应,结晶、过滤;④在氯化氢热气流中干燥晶体;⑤电解上述晶体的熔融物。
下列说法正确的是
A.镁元素在元素周期表中位于第三周期、ⅡA族
B.向洗涤液中滴加碳酸钠溶液可检验沉淀是否洗涤干净
C.在氯化氢热气流中干燥晶体的目的是加快干燥速度
D.步骤⑤也可以采用电解该晶体水溶液的方法
第二卷(非选择题 共72分)
三、(本题包括2小题,共22分)
17.(10分)某化学兴趣小组在做实验时,将AgNO3溶液和KI溶液混合,发现有黄色沉淀生成,振荡后迅速消失。大家经查阅资料后,发现可能的原因是发生了下列反应:AgI+I-![]() [AgI2]-。
[AgI2]-。
⑴甲同学设计了两个简单的实验方案来进行验证,请你协助他完成实验。
实验1:向浓KI溶液中滴加AgNO3溶液,现象为 。
实验2:向AgNO3溶液中滴加稀KI溶液,有黄色沉淀生成;再
。
⑵乙同学在实验所得的溶液中滴加硝酸溶液,结果又出现了沉淀。请解释出现沉淀的原因 。
⑶丙同学在实验所得的溶液中滴加氯水也可以看到沉淀,但由于溶液为黄色,分不清沉淀的颜色。大家通过查阅数据,分析认为产生的沉淀不可能是AgCl,所查阅的数据是 ;请设计简单的实验说明不会产生AgCl沉淀: 。
18.(12分)测定含I-浓度很小的碘化物溶液时,利用振荡反应进行化学放大,可以准确求出原溶液中I-的浓度。主要步骤如是:
①取100mL样品溶液,用单质溴将样品中的I-氧化成IO![]() ,将过量的溴除去。
,将过量的溴除去。
②再加入过量的KI,并用硫酸酸化,使IO![]() 完全转化成I2。
完全转化成I2。
③将②中生成的碘完全萃取后,用肼将其还原成I-。
④将生成的I-萃取到水层后,用步骤①的方法再处理转化为IO![]() 。
。
⑤将④得到的溶液加入适量的KI溶液,并用硫酸酸化,使IO![]() 完全转化成I2。
完全转化成I2。
⑥将⑤得到的溶液完全转入250mL容量瓶,并加水稀释至刻度。
⑦分别取⑥得到的溶液25.00mL于锥形瓶中,加入指示剂,用0.1010mol/L 的Na2S2O3标准溶液滴定(2Na2S2O3+I2=Na2S4O6+2NaI)。
⑧重复操作⑦两次。
根据上述步骤回答下列问题:
⑴在操作①中,除去过量溴单质的方法是 。
⑵请写出操作②中发生的反应的离子方程式 。
⑶在萃取操作中,使用的玻璃仪器有 。步骤⑦使用的指示剂是 ;判断滴定达到终点的现象为 。
⑷下表是该实验的记录结果:
| 滴定 次数 | 待测溶液的体积 | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.05 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.11 | 20.09 |
原溶液中I-的物质的量浓度为 。
四、(本题包括2小题,共22分)
19.(10分)在一固定体积的密闭容器中,在850℃时发生如下反应:
CO(g)+H2O(g)![]() CO2(g)+H2(g); △H=-41.2kJ/mol。容器内各物质的浓度(mol/L)变化如下(在850℃其化学平衡常数K=1.0)。
CO2(g)+H2(g); △H=-41.2kJ/mol。容器内各物质的浓度(mol/L)变化如下(在850℃其化学平衡常数K=1.0)。
| 时间/min | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
⑴下列可以作为判断该反应已经达到化学平衡状态依据的是 。
a.容器内压强不变 b.v正(H2) = v逆(CO)
c.混合气体中CO2的浓度不变 d.c(CO2) = c(CO)
⑵若在850℃时向反应容器中充入H2O(g),K值 (填“增大”、“减小”或“不变”,下同);若升高反应体系的温度,K值 。
⑶上表中:c1 = mol/L,H2O (g)的转化率为 。
20.(12分)下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。
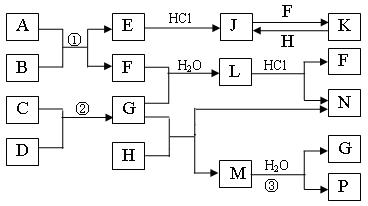
已知:E为红色固体,K为浅绿色溶液;反应②是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F、P 和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G分子构型为三角锥形,化合物M由两种元素组成,分子内共有58个电子。
⑴化合物A中含有的两种元素是 。
⑵F的化学式 ;G的水溶液中,最多的阳离子是 。
⑶写出K与H反应的离子方程式: ;
G与H反应的化学方程式: 。
⑷在实验室中,向饱和H水溶液中加入CaCO3粉末,充分反应后过滤,可制得浓度较大的P的水溶液。使用化学平衡移动原理加以解释
。
五、(本题包括1小题,共12分)
 21.(12分)2007年诺贝尔化学奖授予德国科学家格哈德·埃特尔,以表彰他在表面化学研究领域作出的开拓性贡献。
21.(12分)2007年诺贝尔化学奖授予德国科学家格哈德·埃特尔,以表彰他在表面化学研究领域作出的开拓性贡献。
⑴某校化学研究性学习小组的同学在技术人员的指导下,按下列流程探究不同催化剂对NH3还原NO反应的催化性能。
![]()
若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通过滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。为比较不同催化剂的催化性能,需要测量并记录的数据是 。
⑵在汽车的排气管上安装“催化转化器”(用铂、钯合金作催化剂),它的作用是使CO、NO反应生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧。
①写出CO与NO反应的化学方程式: ,该反应作氧化剂的物质是_________。
②用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g); ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g); ΔH2
若1mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,则ΔH2= 。
⑶①有人认为:该研究可以使氨的合成反应,在铁催化剂表面进行时的效率大大提高,从而使原料的转化率大大提高。请你应用化学基本理论对此观点进行评价: 。
②合成氨工业生产中所用的α—Fe催化剂的主要成分是FeO、Fe2O3,当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高,以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:2 Fe2O3十C ![]() 4FeO十CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入炭粉的质量为
g。
4FeO十CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入炭粉的质量为
g。
六、(本题包括2小题,共16分)
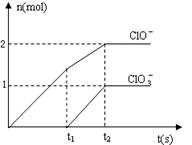 22.(8分)在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如右图所示。
22.(8分)在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如右图所示。
⑴t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为_____________________________________________。
⑵该石灰乳中含有Ca(OH)2的物质的量是_______ mol。
⑶ 据分析,生成Ca(C1O3)2的反应是由温度升高引起的,通入氯气的速度不同,C1O-和C1O3-的比例也不同。
若在原石灰乳中通入氯气的速度加快,则反应后![]() 2(填“>”、“<”或“=”);
2(填“>”、“<”或“=”);
若![]() ,则n(C1-)= mol(用含a的代数式来表示)。
,则n(C1-)= mol(用含a的代数式来表示)。
23.(8分)现有一种碱金属的碳酸盐(M2CO3)和碳酸氢钠组成的混合物,取其1.896g加热至质量不再变化,把放出的气体通入足量的澄清石灰水中,得到白色沉淀0.800g。将加热后残留的固体与足量稀硫酸充分反应,生成的气体经充分干燥后通过足量的过氧化钠粉末(反应为:2Na2O2+2CO2=2Na2CO3+O2),结果过氧化钠粉末增重0.336g。
⑴通过计算确定M2CO3的M为何种元素。
⑵有同学提出,通过简单的定性实验,也可以确定该样品中的M为何种碱金属元素。你认为该实验方案是什么?
答案及评分标准
一、选择题(本题包括8小题,每题3分,共24分。每小题只有一个选项符合题意)
1.D 2.B 3.A 4.C 5.C 6.A 7.B 8.D
二、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得1分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
9.AD 10.D 11.BC 12.C 13.C 14.AD 15.CD 16.AB
三、(本题包括2小题,共22分)
17.⑴没有沉淀生成 在所得的黄色沉淀中滴加浓KI溶液,黄色沉淀溶解
⑵加入硝酸溶液后,HNO3将I-氧化,使I-浓度减小,平衡AgI+I-![]() [AgI2]-逆向移动 ⑶AgI、AgCl的溶解度 在黄色的AgI沉淀中滴加NaCl溶液,沉淀未转化为白色
[AgI2]-逆向移动 ⑶AgI、AgCl的溶解度 在黄色的AgI沉淀中滴加NaCl溶液,沉淀未转化为白色
(每空2分,共10分)
18.⑴多次萃取或将溶液加热煮沸 ⑵5I-+IO![]() +6H+==3I2+3H2O
+6H+==3I2+3H2O
⑶烧杯、分液漏斗 淀粉试液
滴入最后一滴Na2S2O3,溶液由蓝色变为无色,且30s不恢复
⑷5.611×10-3mol/L (每空2分,共12分)
四、(本题包括2小题,共22分)
19.⑴bc ⑵不变 减小 ⑶0.08mol/L 0.4或40% (每空2分,共10分)
20.⑴S、Fe
⑵SO2 NH4+
⑶2Fe2++ Cl2=2 Fe3+ + 2Cl- 4NH3+3Cl2=NCl3+3NH4Cl
⑷饱和H水溶液中存在平衡:Cl2+H2O![]() H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大
(每空2分,共12分)
H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大
(每空2分,共12分)
五、(本题包括1小题,共12分)
21.⑴溶液显色所需要的时间 ⑵①2CO+2NO![]() N2+2CO2 NO
②-1160 kJ·mol-1
N2+2CO2 NO
②-1160 kJ·mol-1
⑶①该研究只能提高化学反应速率,不能使化学平衡发生移动 ②6g
(每空2分,共12分)
六、(本题包括2小题,共16分)
22.⑴10Ca(OH)2+10Cl2=2Ca(C1O)2+Ca(C1O3)2+7CaCl2+10H2O
⑵5 ⑶< ![]() (每空2分,共8分)
(每空2分,共8分)
23.⑴2NaHCO3 ~ Na2CO3 ~ CO2 ~ CaCO3
n(NaHCO3)=![]() × 2=0.016mol(2分)
× 2=0.016mol(2分)
2CO2+2Na2O2=2Na2CO3+O2 △m
2mol 56g
(0.012mol) 0.336g
加热后的n(M2CO3)=0.012mol-![]() ×0.016mol =0.004mol (2分)
×0.016mol =0.004mol (2分)
设M的相对原子质量分别为x 。
依题意:84g·mol-1×0.016mol+(2x+60)g·mol-1×0.004mol=1.896g x=39
根据碱金属的相对原子质量,可知M元素是K。(2分)
⑵对混合物进行焰色反应实验,透过蓝色的钴玻璃,若看到浅紫色火焰,则说明M元素是K。(2分)