08届高三化学第一次月考试题
可能用到的相对原子质量:H:1 Li:7 C:12 N:12 O:16 F:19
Na:23 Mg:24 Al:27 Si:28 S:32 Cl:35.5 Ba:137 Ag:108
一、选择题(每小题只有一个正确答案,每小题3分,20小题共60分)
1.铋(Bi)在医药方面有重要应用.下列关于20983Bi 和21083Bi
的说法正确的是
A、20983Bi 和21083Bi都含有83个中子; B、20983Bi 和21083Bi互为同位素
C、20983Bi 和21083Bi的核外电子数不同;
D、20983Bi 和21083Bi分别含有126和127个质子
2.下列叙述正确的是
A、48gO3气体含有6.02×1023个O3分子
B、常温常压下,4.6gNO2气体含有1.81×1023个NO2分子
C、0.5mol·L-1CuCl2溶液中含有3.01×1023个Cu2+
D、标准状况下,33.6LH2O含有9.03×1023个H2O分子
3.氯气是一种重要的工业原料。工业上利用反应在3Cl2 + 2NH3 = N2 + 6HCl检查氯气管道是否漏气。下列说法错误的是
A、若管道漏气遇氨就会产生白烟; B、该反应利用了Cl2的强氧化性
C、该反应属于复分解反应 D、生成1molN2有6mol电子转移
4.下列化学反应的离子方程式正确的是
A、用小苏打治疗胃酸过多: HCO3- + H+ == CO2↑+ H2O
B、往碳酸镁中滴加稀盐酸: CO32- + 2H+ == CO2↑+ H2O
![]()
 C、往氨水中滴加氯化铝:
C、往氨水中滴加氯化铝:
Al3+ + 4OH- == AlO2- + 2H2O
D、氢氧化钡溶液与稀硫酸反应:
Ba2+ + SO42- + H+ + OH- == BaSO4↓+ H2O
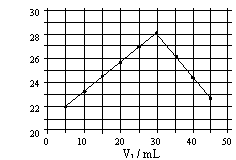
5. 将V1mL1.0mol/L HCl溶液和V2mL未
知浓度的NaOH溶液混合均匀后测量并记
录溶液温度,实验结果如图所示(实验中始终保持 V1 + V2= 50mL)。
下列叙述正确的是
A、做该实验时环境温度为28℃ B、该实验表明化学能可转化为热能
C、NaOH溶液的浓度约为1.0mol/L
D、实验表明有水生成的反应都是放热反应
6.灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
① Sn(s、白) + 2HCl(aq)= SnCl2(aq)+ H2(g) △H1
② Sn(s、灰) + 2HCl(aq)= SnCl2(aq)+ H2(g) △H2
|
下列说法正确的是
A、△H1 >△H2 B、锡在常温下以灰锡状态存在
C、灰锡转化为白锡的反应是放热反应
D、锡制器皿长期处于低于13.2℃的环境中,会自行毁坏
7.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍。下列说法正确的是
A、X的氢化物溶于水显酸性 B、Y的氧化物是离子化合物
C、Z的氢化物的水溶液在空气中存放不易变质
D、X和Z的最高价氧化物对应的水化物都是弱酸
8.下述实验能达到预期目的的是
| 编号 | 实验内容 | 实验目的 |
| A | 将SO2通入酸性KMnO4溶液中 | 证明SO2具有氧化性 |
| B | 将Cl2通入NaBr溶液中 | 比较氯与溴的氧化性强弱 |
| C | 将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 | 研究温度对化学反应速率的影响 |
| D | 分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其中1支加入少量MnO2 | 研究催化剂对H2O2分解速率的影响 |
9. 下列说法正确的是
A、硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B、蔗糖、硫酸钡和水分别属于非电解质、强电解质和非电解质
C、Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到
D、天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源
10. 三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程为:用NaOH调NiCl2溶液pH至7.5,加适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
A、可用铁作阳极材料 B、电解过程中阳极附近溶液的pH升高
C、阳极反应方程式为: 2Cl- - 2e- = Cl2
D、1mol二价镍全部转化为三价镍时,外电路中通过了2mol电子。
11.向存在大量Na+、Cl-的溶液中通入足量的NH3后,该溶液中还可能大量存在的离于组是
A、K+、Br-、CO32- B、Al3+、H+、MnO4-
C、NH4+、Fe3+、SO42- D、Ag+、Cu2+、NO3-
12.下列说法正确的是
A、原子晶体中只存在非极性共价键
B、稀有气体形成的晶体属于分子晶体
C、干冰升华时,分子内共价键会发生断裂
D、金属元素和非金属元素形成的化合物一定是离子化合物
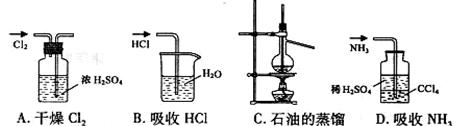
13.用下列实验装置完成对应的实验(部分仪器巳省略),能达到实验目的的是 D
 |
14.有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同 (选项中m、n均为正整数)。下列说法正确的是
A、若X(OH)n为强碱,则Y(OH)n也一定为强碱
B、若HnXOm为强酸,则X的氢化物溶于水一定显酸性
C、若X元素形成的单质是X2,则Y元素形成的单质一定是Y2
D、若Y的最高正价为+m,则X的最高正价一定为+m
15.室温时,下列混合溶液的 pH 一定大于7 的是
A、pH=3 的盐酸和 pH=11 的氨水等体积混合
B、pH=3 的盐酸和 pH=11 的氢氧化钡溶液等体积混合
C、pH=3 的醋酸和 pH=11 的的氢氧化钡溶液等体积混合
D、pH=3 的硫酸和 pH=11 的烧碱溶液等体积混合
16.在三个密闭容器中分别充入 Cl2、O2、H2 三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是
A、p(Cl2)>p(H2)>p(O2) B、p(O2)> p(Cl2)>p(H2)
C、p(H2)>p(O2)> p(Cl2) D、p(H2)> p(Cl2)>p(O2)
17.已知氧化还原反应:
2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O
其中 1mol氧化剂在反应中得到的电子为
A、10mol B、11mol C、12mol D、13mol
18.等物质的量的下列化合物在相应条件下完全分解后得到氧气最多的是
A、KClO3(加 MnO2 催化剂,加热) B、KMnO4(加热)
C、H2O2(水溶液,加 MnO2 催化剂) D、HgO(加热)
19.某有机化合物仅由碳、氢、氧三种元素组成,其相对分子质量小于 150,若已知其中氧的质量分数为 50%,则分子中碳原子的个数最多为
A、7 B、6 C、5 D、4
20.在101 kPa时燃烧1 t 含FeS2质量分数为70%的黄铁矿生成固态Fe2O3和气态SO2,放出4.98×106 kJ的热量,表示上述反应的燃烧热的热化学方程式正确的是
A、4FeS2(s)+11O2(g) = 2 Fe2O3(s)+8SO2(g);△H= -3414.8 kJ·mol-1
B、4FeS2(s)+11O2(g) = 2 Fe2O3(s)+8SO2(g);△H= +3414.8 kJ·mol-1
C、FeS2(s)+![]() O2(g) =
O2(g) = ![]() Fe2O3(s)+2SO2(g);△H=+853.7 kJ·mol-1
Fe2O3(s)+2SO2(g);△H=+853.7 kJ·mol-1
D、FeS2(s)+![]() O2(g) =
O2(g) = ![]() Fe2O3(s)+2SO2(g);△H=-853.7 kJ·mol-1
Fe2O3(s)+2SO2(g);△H=-853.7 kJ·mol-1
08届应届第一次月考化学答题卷
班别 姓名 得分
| 题 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答 |
|
|
|
|
|
|
|
|
|
|
| 题 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答 |
|
|
|
|
|
|
|
|
|
|
二、填空题(共40分)
21.(7分)a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码: | a | b | c | d | e | f | g |
| 原子核数: | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数:(单位电荷) | 0 | 1 | 1 | 0 | 2 | 1 | 0 |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子。
试写出: (1)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为:___________>___________ (用化学式表示)。
(2)d溶于水的电离方程式____________________ __。
(3)g粒子所构成的晶体类型属_________________。
(4)c粒子是_______________,f粒子是_______________(用化学式表示)。
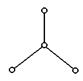 22.
(11分) 19. (8分)美国《科学》杂志报道,意大利科学家合成了一种新型氧分子,它是由4个氧原子构成的O4分子,专家认为它液化后的能量密度比普通氧分子高得多。O4分子的结构如下图所示,是平面型分子,键角为120°。四个氧原子以一个O原子为中心,与另外三个O原子分别构成一个非极性共价键;中间O原子提供三个电子,周围三个O原子各提供1个电子,构成一个特殊的化学键——四个O原子均等地享有这6个电子,请回答:
22.
(11分) 19. (8分)美国《科学》杂志报道,意大利科学家合成了一种新型氧分子,它是由4个氧原子构成的O4分子,专家认为它液化后的能量密度比普通氧分子高得多。O4分子的结构如下图所示,是平面型分子,键角为120°。四个氧原子以一个O原子为中心,与另外三个O原子分别构成一个非极性共价键;中间O原子提供三个电子,周围三个O原子各提供1个电子,构成一个特殊的化学键——四个O原子均等地享有这6个电子,请回答:
(1)固体属于____________晶体(填“原子”、“离子”、“分子”、“金属”)
(2)与氧气的关系是___________________,它们之间的转化是否为氧化还原反应_________(填“是”或“否”)。
(3) O4具有强氧化性,能将Fe2+氧化为Fe3+,
配平: O4 + Fe2++ → Fe3+ + H2O + O2
在该反应中,当生成1 mol ![]() ,转移电子的物质的量为________ mol。
,转移电子的物质的量为________ mol。
23.(8分) W、X、Y和Z都是周期表中前20号元素,已知:①W的阳离子和Y的阴离子具有相同的核外电子排布,且能形成组成为WY的化合物;②Y和Z属同族元素,它们能形成两种常见化合物;③X和Z属同一周期元素,它们能形成两种气态化合物;④W和X能形成组成为WX2的化合物;⑤X与Y不在同一周期,它们能形成XY2的化合物。请回答:
(1)W元素名称是 ;Z元素名称是 。
(2)WY和WX2的化学式分别是 和 。
(3)Y和Z形成的两种常见化合物的分子式是 、 。
(4)写出X和Z形成的一种气态化合物跟WZ反应的化学方程式:
。
24.(10分)A、B、C、D、E均为可溶于水的固体,构成他们的离子有
| 阳离子 | Na+ Mg2+ Al3+ Ba2+ |
| 阴离子 | OH- Cl- CO32- SO42- HSO4- |
分别取它们的水溶液进行实验,结果如下:
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。
据此推断它们是
A ;B ;C ;D ;E 。
25.(4分)现有SO2气体和H2S气体共1mol,将两种气体混合后所得产物中,若经氧化得到的产物比还原得到的产物多6.4g。
若以上反应完全进行,则H2S和SO2气体的物质的量可能各是
(填空)