08届汕头市龙湖区高三化学联考试卷
可能用到的相对原子质量:H:1 C:12 O:16 S:32 Cl:35.5 I:127
Na:23 K:39 V:51 Pb:207 Cu:64 Ag:108 Ba:137
第一部分 选择题 (共63分)
一、单项选择题(本题包括9小题,每小题3分,共27分,每小题只有一个选项符合题意)
1.新华社2007年3月21日电,全国科学技术名词审定委员会21日公布:111号元素(符号为Rg)的中文名称为“![]() ”(读音为伦)。下列说法正确的是:
”(读音为伦)。下列说法正确的是:
A.111号元素是第6周期、第ⅠA族的金属元素 B.111号元素属于过渡元素
C.111号元素为非金属元素 D.111号元素质量数为111
2.《新科学家》网站报道,科学家通过电解Fe2O3-SiO2-CaO的熔融液(1600℃)制得了铁和氧气。与常规方法比,将该方法用于工业上大规模冶铁,以下优点分析错误的是:
A.副产物可做工业用氧 B.大幅度降低能耗
C.大幅度降低温室气体的排放 D.制得更纯的铁
3.下列说法正确的是:
A.化学式符合XOH(X代表某一元素)的物质一定是碱
B.分子式为C6H6的物质一定是苯
C.最简单的烯烃一定是乙烯
D.含碳量最高的烃一定是乙炔
4.下列实验设计能够成功的是:
| 实验目的 | 实验步骤及现象 | ||||
| A | 检验亚硫酸钠试样是否变质 |
| |||
| B | 检验某卤代烃是否是氯代烃 |
| |||
| C | 证明酸性条件下H2O2氧化性比I2强 |
| |||
| D | 除去氯化钠溶液中的少量硫酸钠 |
溶液 |
5.某无色溶液中,若加入NaClO溶液或适量HCl溶液,均能产生淡黄色沉淀。则该溶液中可能大量存在的离子组是:
A.Na+、K+、S2—、Cl— B.H+、Na+、S2-、NO3—
C.K+、Ca2+、S2—、SO32— D.Na+、S2—、SO32—、SO42—
6.水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32—+O2+xOH—=Fe3O4+S4O62—+2H2O,下列说法正确的是:
A.硫元素被氧化,铁元素被还原 B.Fe2+、S2O32—都是还原剂
C.x=2 D.每生成1mol Fe3O4,则转移电子数为3mol
7.有关键能数据如表:
| 化学键 | Si—O | O=O | Si—Si |
| 键能/kJ·mol-1 | X | 498.8 | 176 |
则晶体硅在氧气中燃烧的热化学方程式:Si(s)+O2(g)==SiO2(s)中,△H= —989.2 kJ·mol-1,则X的值为:
A. 460 B. 920 C. 1165.2 D. 423.3
8.聚合氯化铝(PAC)通式为[Al2(OH)nCl6-n]m,是无机高分子絮凝剂,它是用软铝矿(主要成分Al2O3·H2O)为原料制备,制备的最后一步反应是将Al(OH)3凝胶与[Al(OH)2(H2O)4]Cl按照一定配比恰好完全反应制得PAC,则该反应中前者与后者的物质的量之比为:
A.1:1 ![]() B.
B.![]() C.
C.![]() D.
D.![]()
9.有些反应看起来不能进行,而实际生产中恰被用来制备带下划线的物质,下列四个反应中,其反应原理与其它三个反应不同的是:
A.KC1O4+H2SO4→HC1O4+KHSO4 B.KC1+NaNO3→NaC1+KNO3
C.Mg+2RbC1→MgC12+2Rb D.Na+KC1→NaC1+K
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
10.短周期元素A、B、C的原子序数依次递增,它们的原子最外层电子数之和为10,A与C同主族,B原子的最外层电子数等于A原子的次外层电子数,则下列叙述正确的是:
A.原子半径:A<B<C
B.A的氢化物稳定性大于C的氢化物稳定性
C.三种元素的最高价氧化物对应水化物均可由化合反应得到
D.高温下,A单质能置换出C单质
11.阿伏加德罗常数约为6.02×1023mol-1,下列说法中错误的是:
A.16.9 g BaO2固体中阴、阳离子总数约为0.3×6.02×1023
B.2.3 g 钠被O2完全氧化时,失去电子数约为0.1×6.02×1023
C.0.5 mol超重水(T2O)的质子总数约为5×6.02×1023
D.常温下,11.2 L甲烷与乙烯的混合物所含氢原子的数目约为2×6.02×1023
12.下列离子方程式书写正确的是:
A.在澄清的石灰水中通入过量的CO2:CO2+OH- HCO![]()
B.NaHS溶液呈碱性:HS—+H2O![]() H3O++S2—
H3O++S2—
C.4 mol/L的KAl(SO4)2溶液与7 mol/L的Ba(OH)2溶液等体积混合:
4Al3++7SO42—+7Ba2++14OH—==2Al(OH)3↓+2AlO2—+7BaSO4↓+4H2O
D.将过量的SO2气体通入Ca(ClO)2溶液中:SO2+ClO—+H2O==HClO+HSO3—
13.实验指出,无水氯化铝在标准大气压条件下不同温度时的密度为:
| t(℃) | 200 | 600 | 800 |
| d(g/mL) | 6.8×10-3 | 2.65×10-3 | 1.51×10-3 |
| 气体摩尔体积(L/mol) | 38.8 | 71.6 | 88.0 |
可见,600℃时无水氯化铝存在形式的化学式为
A.AlCl3 B.Al2Cl6 C.AlCl3和Al2Cl6 D.Al3Cl9
14.25℃时,等物质的量浓度的醋酸钠与醋酸的混合溶液pH < 7,则下列关系式中错误的是:
A.c(Na+)+ c(H+)= c(OH-) + c(CH3COO-)
B.c(CH3COO-) + c(CH3COOH) > c(Na+)
C.c(CH3COO-) > c(Na+) > c(H+) > c(OH-)
D.c(CH3COOH) > c(CH3COO-)
15.氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有H2生成,下列叙述错误的是:
A.NH4H是离子化合物
B.NH4H固体投入少量的水中,有两种气体生成
C.NH4H与水反应时,NH4H是还原剂
D.NH4H溶于水,所形成的溶液显酸性
16.将某NaOH溶液分成两等份,一份用pH=2的一元酸HA溶液中和,消耗酸溶液的体积为V1;另一份用pH=2的一元酸HB溶液中和,消耗酸溶液体积为V2,则下列叙述正确的是:
A.若V1>V2,则说明HA的酸性比HB的酸性强
B.若V1>V2,则说明HA的酸性比HB的酸性弱
C.若中和所得混合液的pH前者大于后者,则V1>V2
D.若中和所得混合液的pH前者小于后者,则V1>V2
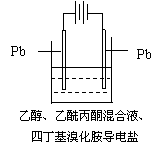
17.有机电解制备的金属醇盐,可直接作为制备纳米材料的前体。以下是一种电化学合成金属醇盐的主要装置。在电解过程中,已知乙醇和乙酰丙酮(CH3COCH2COCH3)在阴极发生的电极反应为:
2CH3CH2OH+2e-=2CH3CH2O-+H2↑
![]()
![]()
下列说法正确的是
A.阳极Pb失去电子,发生还原反应
B.当阳极失去2 mol e—时,阴极产生2 mol氢气
C.电解过程中,阳离子向阴极移动
D.已知Pb-4e—=Pb4+,当消耗Pb的质量为103.5 g时,则转移电子2 mol
18.某温度下,在密闭容器中存在下列可逆反应:A(g)+2B(g)
![]()
![]() 4 C(g),达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1,且A的质量分数为w%。保持温度不变,再充入A、B、C的物质的量分别为a、b、c,则下列说法正确的是
4 C(g),达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1,且A的质量分数为w%。保持温度不变,再充入A、B、C的物质的量分别为a、b、c,则下列说法正确的是
A.若为恒容容器,当a∶b∶c为2∶2∶1时,平衡不移动
B.若为恒容容器,当a∶b =9∶10,且c=0时,达平衡后,A、B、C物质的量之比仍为2∶2∶1
C.若为恒压容器,当a∶b为9∶10,c为任意值时,平衡后A的质量分数一定仍为w%
D.若为恒压容器,当a=b=0,且c为任意值时,平衡后A的质量分数小于w%
第二部分 非选择题 (共87分)
三、(本题包括3小题,共34分)
19.(10分)文献资料显示,草木灰主要含有不溶性杂质及K2CO3,还含有少量KCl、K2SO4等。某化学兴趣小组拟测定草木灰中钾盐的含量及钾盐中K2CO3的含量。
【测定草木灰中钾盐含量】
(1)该实验的主要步骤顺序为:称量.→ → → → →冷却→再称量(填字母序号)
A. 溶解 B.过滤 C、洗涤、烘干 D、蒸发
(2)称量前,在调整托盘天平的零点时,若指针偏向右边,应将右边的螺丝向 (填左、右)旋动。某学生称量时,在天平右盘加上规定质量的砝码后,在左盘的小烧杯中加入样品,此时指针稍偏右边,该学生的操作应为 。
(3)实验中A、B、C、D三步操作均使用了玻璃棒,操作B中玻璃棒的作用是 ,操作D用玻璃棒不断搅动的原因 。
【测定钾盐中K2CO3含量】
(4)取上述操作中所得的钾盐,配成稀溶液,加入CaCl2溶液使CO32-生成沉淀,过滤得到碳酸钙沉淀后,用蒸馏水多次洗涤,烘干、称量、计算。检验沉淀是否完全的方法是 ,检验沉淀是否洗净的方法是 。
20.(15分)硫酸铜是一种应用极其广泛的化工原料。制备硫酸铜是无机化学实验教学中一个重要的实验。由于铜不能与稀硫酸直接反应,实验中将浓硝酸分次加入到铜粉与稀硫酸中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)。
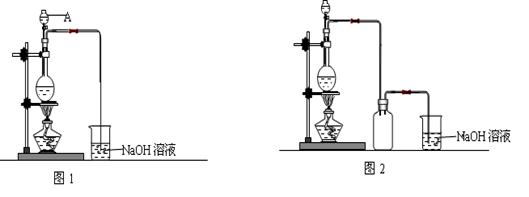
(1)图1中,A仪器的名称为 ,烧瓶中发生的离子反应方程式 。
(2)图2是图1的改进装置,改进的目的是 。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加FeSO4或Fe2(SO4)3,反应完全后,向其中加物质甲调节pH到3~4,过滤、蒸发、结晶,滤渣作催化剂循环使用。(已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4。)
请回答下列问题:
①方案1中的B仪器名称是 。
②方案2中甲物质是 (填字母序号)。a、CaO b、CuCO3 c、CaCO3
调节pH到3~4的目的是: 。
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45 mL 1.5mol/L的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h后,升温到60℃,持续反应1 h后,过滤、蒸发结晶、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.6g。请回答下列问题:
③该反应的离子反应方程式为 。
④控制温度在50℃和60℃加热的原因为 ,晶体采用酒精淋洗的优点是 。
⑤上述两种氧化法中,更符合绿色化学理念的是 (填“第一组”或“第二组”),理由是 。
21.(9分)化合物KxFe(C2O4)y·3H2O(Fe为+3价)是一种光敏材料,实验室可以用如下的方法来制备这种材料并测定这种材料的组成。
Ⅰ.制备
 K2C2O4
K2C2O4
FeCl3
⑴结晶时应将溶液用冰水冷却并在黑暗处等待晶体的析出,这样操作的原因是:________________________________________________________________。
⑵操作Ⅲ的名称是___________。
Ⅱ.组成测定
称取一定质量的晶体置于锥形瓶中,加入足量的蒸馏水和稀H2SO4,将C2O42-转化为H2C2O4后用0.1000 mol·L-1KMnO4溶液滴定,当消耗KMnO4溶液24.00mL时恰好完全反应;再向溶液中加入适量的还原剂,恰好将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液4.00mL。相关反应的化学方程式如下:
2 KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
⑶配制100mL 0.1000 mol·L-1KMnO4溶液及滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有_______________________________(填仪器名称)。两个滴定中,终点时溶液颜色为________色,且30 秒内不变色。
⑷该化合物KxFe(C2O4)y·3H2O中,x=_______。
四、(本题包括3小题,共33分)
22.(12分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
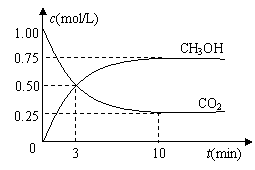 ⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol
H2,一定条件下发生反应:
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol
H2,一定条件下发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
△H=-49.0kJ/mol
CH3OH(g)+H2O(g)
△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)。氢气的转化率= 。
②该反应的平衡常数表达式为__________________。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
⑵在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2 CO2=2 CO+O2,CO可用作燃料。
已知该反应的阳极反应为:4OH――4e―=O2↑+2H2O
则阴极反应式为:________________________________。
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你判断是否可行并说出理由:______________________________________________。
23.(10分)现代社会中铜在电气、交通、机械和冶金、能源及石化工业、高科技等领域有广泛的应用。某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(Si02) ,现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进入有机层的过程)和反萃取(铜从有机层进入水层的过程)是现代湿法炼铜的重要工艺手段。
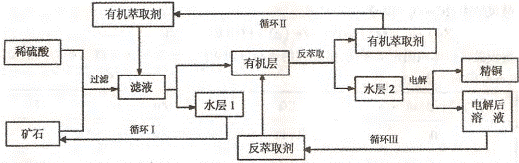
已知:①Cu2O+2H+=Cu2++Cu + H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜; ③反萃取后的水层2是硫酸铜溶液。回答下列问题:
(1)矿石用稀硫酸处理过程中发生反应的离子方程式为:Cu2O+2H+=Cu2++Cu + H2O
、 (写其中2个)
(2)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体,该晶体的化学式是 。若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写出水层l暴露在空气中发生反应的离子方程式
(3)“循环n”中萃取剂是一类称作为肟类的有机化合物,如N一510、N一530等。某肟类化合物A的分子结构中仅含n1个—CH3、n2个一OH和n3个![]() 三种基团,无环状结构,三种基团的数目关系为n3 =
。若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是
三种基团,无环状结构,三种基团的数目关系为n3 =
。若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是
(4)“循环Ⅲ”中反萃取剂的主要成分是
24.(11分)已知A、B、C、D四种短周期元素的原子序数依次增大,B的核电荷数是A、D核电荷数之和的![]() 倍;A能分别与B、C、D形成电子总数相等的分子X、Y、Z 。回答下列问题:
倍;A能分别与B、C、D形成电子总数相等的分子X、Y、Z 。回答下列问题:
(1)B元素的名称是 ,D的原子结构示意图为 。
(2)化合物B2A2的电子式为 。
(3)Y与C的最高正价氧化物的水化物刚好完全反应时,其生成物的水溶液呈 性(填“酸”“碱”或“中”),其原因是(用离子方程式表示) 。
(4)在(3)所得生成物的水溶液中,存在着如下关系,用粒子浓度符号填写(每空只能填一种粒子的浓度):
① c(H+) + = c(OH-) + ;
② c(H+) = c(OH-) + 。
五、(本题包括1小题,共10分)
25.(10分)A、B、C、D为四种不同的有机物,完全燃烧均生成等物质的量的CO2和
H2O,且都能通过一步反应生成乙醇,它们的相对分子质量依次递增。A、B、D均能使酸性高锰酸钾溶液褪色。B、D均能发生银镜反应。
(1)写出B和D的结构简式:
B ;D 。
(2)上述四种物质中,来自石油化工的是__________(写物质名称),写出该物质转变成乙醇的反应方程式 ,该反应类型为 反应。
(3)写出C与氢氧化钠溶液共热的化学方程式 。
(4)配平下列化学方程式
CH3CH2OH + KMnO4 + → CH3COOH + MnSO4 + K2SO4 + H2O
六、(选做题,本题共10分)
考生注意:26、27题为选做题,考生可任选一题。在答题卡对应位置填写你所选择的试题答案。26题适合选修《有机化学基础》模块的考生解答,27题适合选修《物质结构与性质》模块的考生解答。
26.(10分)相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。
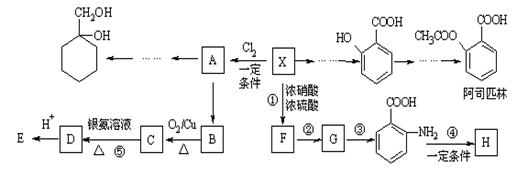
已知:
Ⅰ ![]()
Ⅱ ![]() (苯胺,易被氧化)
(苯胺,易被氧化)
请根据所学知识与本题所给信息回答下列问题:
⑴H的结构简式是______________;
⑵反应②的类型是 ___ ___ ;
⑶反应⑤的化学方程式是____________________________________________;
⑷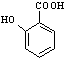 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有________种;
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有________种;
⑸请用合成反应流程图表示出由![]() 和其他无机物合成
和其他无机物合成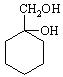 最合理的方案(不超过4步),请在答题纸的方框中表示。
最合理的方案(不超过4步),请在答题纸的方框中表示。
![]() 例:
例:![]()

27.物质结构与性质
 聚合铁(简称PFS)化学式为:
聚合铁(简称PFS)化学式为:![]() 现代污水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子。
现代污水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子。
(l)①PFS中铁显 价,铁原子的电子排布式是 。 ②O元素的第一电离能 N 元素的第一电离能(填“大于”或“小于”) ,原因 ;水分子中氧原子的杂化轨道类型为 。H2O与H+以配位键结合成H3O+的立体结构为 。
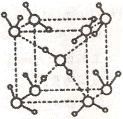
(2)水在不同的温度和压力条件下可以形成11种不同结构的晶体,密度从比水轻的0.92g/cm3扩到约为水的一倍半。冰是人们迄今已知的由一种简单分子堆积出结构花样最多的化合物。其中冰一VII的晶体结构为一个如右上图所示的立方晶胞,每个水分子可与周围 个水分子以氢键结合,晶体中,1mol水可形成 mol氢键。
(3)已知下列元素的电负性数据:H: 2.1, O: 3.5, F:4.0。OF2与水的立体结构相似,但水分子的极性比OF2强得多,其原因有:①OF2中氧原子上有两对孤对电子,抵消了F一O键中共用电子对偏向F而产生的极性;②从电负性上看,
2008届龙湖区高三化学联考试卷
答题卡
姓名 座号 总分
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |

三、实验题
19.(10分)(1) → → →
(2) 。
。
(3) , 。
(4)
,
。
20.(15分)(1) , 。
(2) 。
(3)① 。②
目的是: 。
③ 。
 ④
,
④
,
。
⑤ ,
。
21.(9分)
Ⅰ.⑴________________________________________________________________。
⑵_______ ____。
Ⅱ.⑶__________________ _____________。 ________
⑷x=_______。
四、(本题包括3小题,共33分)
22.(12分)
⑴①v(H2)=________mol/(L·min)。转化率= 。
②___________ _______。 ③___________。
⑵阴极反应式为:___________ __________ ____。
理由:____ __________________________________
_ 。
 23. (10分) (1)
、
23. (10分) (1)
、
(2) 。
(3) n3 = 。
(4)
24. (11分)(1) , 。
(2) 。
(3) 。
(4) ① c(H+) + = c(OH-) + ;
② c(H+) = c(OH-) + 。
五、(本题包括1小题,共10分)
25.(10分)
(1) B ;D 。
(2)________ __。
, 反应。
(3) 。
(4)
CH3CH2OH + KMnO4 + → CH3COOH + MnSO4
+ K2SO4 + H2O
 六、(选做题,本题共10分)
六、(选做题,本题共10分)
26.
⑴__________ ____;⑵ ___ ___ ;
⑶________________________ ____________________;
⑷________种;
⑸
| |
27.
(l)①PFS中铁显 价,铁原子的电子排布式是 。
② ,原因是 ;
杂化轨道类型为 。立体结构为 。
(2) , mol。
(3)②从电负性上看,
2008届龙湖区高三化学联考试卷参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | B | B | C | D | D | B | A | C | B |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | BD | AD | AC | C | D | D | AD | CD | D |
19.(10分)(1)ABDC(2分)(颠倒不得分)
(2)左(1分), 继续往左盘小烧杯中慢慢加少量样品,使指针指向标尺中间,直至天平平衡(1分)
(3)引流(1分) 防止液体局部过热,液滴溅出(1分)
(4)沉淀后静置,向上层清液中加入CaCl2溶液,观察是否有沉淀生成,若无沉淀生成,则说明沉淀完全,反之则沉淀不完全。(2分)取最后一次洗涤液少许,滴入数滴K2CO3溶液(或AgNO3溶液等也可),若无沉淀产生,即沉淀洗涤干净。(2分)
20.(共15分)
(1)分液漏斗(1分)。Cu+4H++2NO3—=Cu2++2NO2↑+2H2O(2分)。
(2)安全瓶(防止倒吸等)(1分)
(3)①坩埚(1分) ②b(1分) 使铁离子完全沉淀(2分)
③Cu+H2O2+2H+=Cu2++2H2O(2分)
④防止双氧水分解(1分),酒精与水互溶且极易挥发,减少晶体溶解(1分),
⑤第二组(1分)
理由:第一组中的方案1需要加热,消耗能源,方案2所得产品含有铁元素杂质。而第二组方案几乎不产生有害气体,且所得产品纯度较高。(2分)
21.(9分)⑴用冰水冷却有利于析出更多的晶体,黑暗可以防止晶体分解(2分)
⑵过滤、洗涤(2分)
⑶100mL容量瓶、酸式滴定管(2分) (紫)红(1分) ⑷3 (2分)
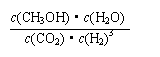
22.(12分)⑴①0.225 0.75 ②
③C、D ⑵2CO2+4e―+2H2O=2 CO+4OH― 不可行,该反应是一个焓增、熵减的反应,任何情况下不能自发进行 (每空2分,共12分)
23.(10分)![]() (任写出其中两个即给分,每空 l分,共 2 分)
(任写出其中两个即给分,每空 l分,共 2 分)
![]()
![]() (2分)
(2分) ![]()
(4)![]()
24.(11分)(1)碳 (1分) 氧原子结构示意图(1分)
(2)H : C![]() C : H(2分)
C : H(2分)
![]() (3)酸(1分)
(3)酸(1分) ![]() +H2O NH3·H2O+H+(2分)
+H2O NH3·H2O+H+(2分)
(4)①![]()
![]() (各1分,顺序颠倒为0分) ②c(NH3·H2O)(2分)
(各1分,顺序颠倒为0分) ②c(NH3·H2O)(2分)
25.(10分)(1)CH3CHO, CH2OH(CHOH)4CHO( 各1分)
![]() (2)乙烯( 1分), CH2=CH2 + H2O 催化剂 △ CH3CH2OH (2分),加成( 1分)
(2)乙烯( 1分), CH2=CH2 + H2O 催化剂 △ CH3CH2OH (2分),加成( 1分)
![]() (3) CH3COOC2H5
+NaOH △ CH3COONa +CH3CH2OH
(2分,其中正确写出C的化学式给1分,条件不写扣1分)
(3) CH3COOC2H5
+NaOH △ CH3COONa +CH3CH2OH
(2分,其中正确写出C的化学式给1分,条件不写扣1分)
(4) 5 CH3CH2OH + 4 KMnO4 + 6 H2SO4→ 5 CH3COOH + 4 MnSO4 + 2 K2SO4+ 11 H2O ( 2分,H2SO41分,配平全对1分)
26.⑴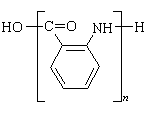 ⑵氧化反应 (1分)
⑵氧化反应 (1分)
⑶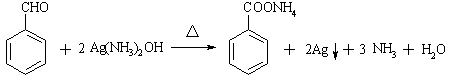 ⑷6
⑷6
⑸
(合成反应流程图3分,其他每空2分,共12分)
27.物质结构与性质
![]() (1分) ② 小于( l 分),因为O原子和N原子的外围电子排布分别为:
(1分) ② 小于( l 分),因为O原子和N原子的外围电子排布分别为:![]() N 原子的
p 轨道半充满,相对稳定,所以第一电离能大( 2分);sp3 ( l 分);三角锥形( l 分)。(2) 4 ( l 分);2 ( l 分)。
(3)氧与氢的电负性差大于氧与氟的电负性差( 1 分)。
N 原子的
p 轨道半充满,相对稳定,所以第一电离能大( 2分);sp3 ( l 分);三角锥形( l 分)。(2) 4 ( l 分);2 ( l 分)。
(3)氧与氢的电负性差大于氧与氟的电负性差( 1 分)。