08届考理科综合化学部分模拟试题
6 .有①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液各25mL,物质的量浓度均为0.1mol·L-1,下列说法正确的是( )
A.3种溶液pH的大小顺序是③>②>①
B.将3种溶液稀释相同倍数,pH变化最大的是②
C.分别加入25mL0.1mol·L-1盐酸后,pH最大的是①
D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
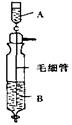 7.《Inorganic
Syntheses》(无机合成)一书中,有一如下图所示的装置,用以制备某种干燥的纯净气体。该装置中所装的药品正确的是
7.《Inorganic
Syntheses》(无机合成)一书中,有一如下图所示的装置,用以制备某种干燥的纯净气体。该装置中所装的药品正确的是
A.A中装浓硫酸,B中装浓盐酸
B.A中装浓盐酸,B中装浓硫酸
c.A中装氢氧化钠浓溶液,B中装浓氨水
D.A中装浓氨水,B中装氢氧化钠浓溶液
8.下列物质发生变化,因反应条件或反应物的用量不同,能够得到不同生成物的是①SO2和Ba(OH)2溶液②Na和O2③FeBr2和Cl2④C2H5OH和浓H2SO4⑤Ca(HCO3)2溶液和NaOH溶液 ⑥AlCl3溶液和KOH溶液
A.①⑥ B.①④⑥ C.除②③外 D.全部
9.下列叙述正确的是( )
①CO2、NO2、P2O5均为酸性氧化物
②Ca(HCO3)2 、Fe(OH)3、FeCl2均可由化合反应制得
③碘晶体分散到酒精中、氯化钠晶体分散到酒精中所形成的分散系分别为:溶液、胶体
④灼热的炭与CO2的反应、Ba(OH)2·8H2O与NH4Cl的反应均既属于氧化还原反应,又是吸热反应
⑤需要通电才可进行的有:电离、电解、电泳、电镀、电化腐蚀
⑥氯化铁溶液与氢氧化铁胶体具有的共同性质是:能透过滤纸,加热蒸干、灼烧后都有氧化铁生成
⑦按照纯净物、混合物、强弱电解质和非电解质顺序排列的是.单甘油酯、混甘油酯、苛性钾、次氯酸、氯气
⑧金属元素和非金属元素形成的化合物一定是离子化合物
A.①②③④ B.②③⑥ C.①③④⑤⑥⑦⑧ D.②④⑦
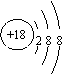 10.下列叙述正确的是( )
10.下列叙述正确的是( )
①A r原子的结构示意图为
②已知26Fe核外最外层有2个电子,可推知核外此外层有14个电子
③Al、N原子结构中单电子数分别为:1、3
④SiO2、NaCl、S、He不能代表一个分子,不是分子式,而CO2、C60代表一个分子,是分子式
⑤在CS2、PCl3中各原子最外层均能达到8电子的稳定结构
⑥乙烯的结构简式为:CH2CH2 甲烷的最简式为:CH4
⑦21H2、11H2互为同位素,其摩尔质量分别为:4、2
⑧由两种原子组成的纯净物一定是化合物
⑨聚乙烯有固定沸点
⑩能证明氯化氢是共价化合物的是:氯化氢不易分解
A.①②③ B.①②③⑤⑦ C.①③④⑥⑦⑧⑨ D.①⑤⑦⑩
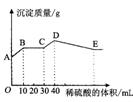 11.将氢氧化钠、氯化钡和硫酸铝三种固体组成的混合物溶于足量的水中,充分溶解,用1mol·L-1稀硫酸滴定,加入稀硫酸的体积与生成沉淀的质量关系如图所示。下列有关判断正确的是
11.将氢氧化钠、氯化钡和硫酸铝三种固体组成的混合物溶于足量的水中,充分溶解,用1mol·L-1稀硫酸滴定,加入稀硫酸的体积与生成沉淀的质量关系如图所示。下列有关判断正确的是
A.A点所表示的沉淀的化学式是: Al(OH)3、 BaSO4
B.B~C段所发生反应的离子方程式是:H+ + OH- = H2O
C.A~B段所发生反应的离子方程式是:Ba2+ + SO42- = BaSO4↓
D.E点所表示的溶液中:n (Na+) = n (Cl-)
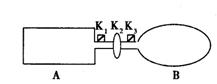 12.A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热保持恒压的气球。关闭K2,将少量且等量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同。[已知:2NO2(红棕色)
12.A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热保持恒压的气球。关闭K2,将少量且等量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同。[已知:2NO2(红棕色) ![]() N2O4(无色) ; △H<0 ] 下列说法正确的是
N2O4(无色) ; △H<0 ] 下列说法正确的是
A.一段时间后反应达到平衡,此时A、B中生成N2O4速率是v(A)> v(B)
B.若打开活塞K2,气球B将变大
C.如果将已开启的K2关闭,再向A、B中分别充入与初始量相等的NO2,则达到新平衡时,A中NO2的转化率将减小
D.保持K2关闭、室温和A、B体积都不变,将A套上一个绝热层,B与外界可以进行热传递,向真空的A、B中分别充入等量且少量的NO2,达到平衡时混合气颜色较深的是容器A
13.6.二○○八年北京残奥会吉祥物是以牛为形象设计的“福牛乐乐”(Funiulele)。有一种有机物的键线式也酷似牛,故称为牛式二烯炔醇(cowenynenynol)。已知连有四个不同的原子或原子团的碳原子,称为手性碳原子。下列有关说法不正确的是
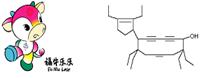 A.牛式二烯炔醇含有3种官能团
A.牛式二烯炔醇含有3种官能团
B.牛式二烯炔醇含有3个手性碳原子
C.1mol牛式二烯炔醇最多可与6molBr2发生加成反应
D.牛式二烯炔醇分子内能发生消去反应
26.(15分)现有aA、bB、cC、dD、 eE五种短周期元素,A、B、C、D都是生命体不可缺少的重要元素。已知它们的原子序数有如下关系:a+b=c a+c=d ,B、D都有同素异形体。人类已知的化合物中,有一类化合物的种类已超过三千万,这类化合物中一般都含有A、B两种元素。E是一种生活中常用的金属。根据以上信息,回答下列有关问题:
(1)写出下列元素的元素符号:B__________ D__________ E ____________。
(2)若由上述五种元素中的两种元素组成化合物,化合物分子中分子的空间构型为直线型。写出符合上述要求且原子数不少于3的任意两种化合物的电子式:__________、_________。
(3)写出由上述五种元素中的四种元素组成的离子化合物的化学式(写出两种即可)______________________、________________________。
(4)在A、B、D三种元素中选择两种或三种元素组成两种可以发生反应的阴离子,请写出该反应的离子方程式_______________________________________。
(5)E用于焊接钢轨时的化学方程式为:________________________________________。
(6)A单质与C单质的化合反应是化学工业中的一个重要反应,写出该反应的化学方程式:_________________________________________________________________________。
(7)由A、B、D三种元素按照原子个数比6︰2︰1组成的化合物甲可与D单质构成燃料电池,该电池用多孔的惰性电极浸入浓KOH溶液,两极分别通入化合物甲和D单质,写出该电池的正极反应式和总反应方程式:
正极:______________________________________________。
总反应方程式 。
27.(17分)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所
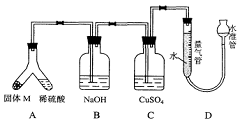 得固体M的成分,设计了如右图装置。倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况)。
得固体M的成分,设计了如右图装置。倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况)。
注意:CuS是既不溶于水也不溶于酸的黑色沉淀。
由上述实验事实可知:
(1)①固体M中一定有的物质是______________(填化学式) ,理由是
_______________________________________________________________________。
②其中一种物质的质量可以确定为___________g(用代数式表示)。
(2)B装置的名称是________。
写出B装置中反应的离子方程式_______________________________________。
(3)C装置的作用是_________________________,如果实验中没有B装置,则C装置中产生的现象是_________________________________________________。
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是_____________,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是_____________。
28(13分)海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)海水中含有大量的氯化钠。氯化钠中的金属元素位于元素周期表第 族。
(2)目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是 (填物理变化、化学变化)
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应式为: 。
利用电解所得气体制36.5%的浓盐酸1000t,最少需要消耗食盐 t。
|
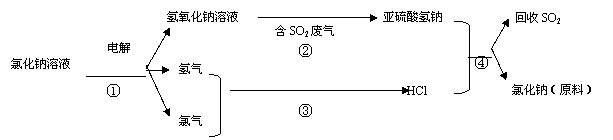 |
写出②④的化学反应方程式:
⑸ 上述亚硫酸氢钠与甲醛经过一定反应,可以合成俗称“吊白块”(雕白粉)的物质。因吊白块对人体有害,不能用于食品漂白。其结构简式为:HOCH2SO3Na,根据其结构特点,吊白块能发生的反应有:
A.皂化反应 B.聚合反应 C.与金属钠反应 D.氧化反应
29.(15分) 某有机物X分子中只含C、H、O三种元素,分子量小于110,其中氧元素含量为14.8 %,已知该物质可与FeCl3溶液发生显色反应,回答下列问题:
(1)X 的分子式为 。若1mol X 与浓溴水反应时消耗了3 mol Br2,
则X 的结构简式为 。
(2)若X 和 Y 能发生如下反应得到Z(C9H10O2),
X + Y ![]() Z + H2O
Z + H2O
写出该反应的化学方程式 ,反应类型为 。
(3)Z 有多种同分异构体,其中属于酯类且苯环上只有一个取代基的有 种,
写出其中任意两种的结构简式: 。
6.C7.B8.D9.B10.A11.B12.D13.D
二、26:(15分)(1)--(3)每空1分,(4)--(7)每空2分
(1)B.C D.O E.Al
(2)二氧化碳、乙炔等直线型分子的电子式
(3)NH4HCO3 (NH4)2CO3等。
(4)HCO3-+ OH-== H2O + CO32-
(5)2Al+Fe2O3 ![]() Al2O3
+ 2Fe
Al2O3
+ 2Fe
(6) N2 + 3H2![]() 2NH3
2NH3
(7) 正极:O2 + 4e- + 2H2O == 4OH-
27.(共17分)
(1)①FeS、Fe(2分) B装置增重、量气管有气体(2分)。
② V/400(3分)
(2)洗气瓶(1分) 2OH-+H2S== 2H2O+S2-(2分)
(3)证明H2S已被完全吸收(2分) 黑色沉淀(1分)
(4)硫(2分) 漏斗、玻璃棒(2分)
28.(13分)(1)、 IA (1分 ) 。 (2)、 物理变化 (1分) 。
(3).2NaCl+2H2O=2NaOH+H2↑+Cl2↑;(2分) 585 t。(3分)
(4).反应② NaOH+SO2=NaHSO3 (2分);反应④NaHSO3+HCl=NaCl+H2Cl+SO2↑。(2分)
(5)、 C 、D 。(其余每空2分)
29、(共15分)
(1)(共4分)C7H8O (2分) , 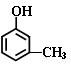 (2分)
(2分)
(2)(共4分)
CH3COOH + 
![]()
![]() + H2O (3分)
+ H2O (3分)
酯化反应 或取代反应(1分)
(3)(共7分) 6种(3分);
![]() 、
、![]() (写对一个2分,共4分)
(写对一个2分,共4分)