08届高三化学2月考试题
第I卷(共66分)
相对原子质量:
H:1 C:12 N:14 O:16 Na:23 Mg:24 S:32 K:39 Fe:56 Ba:137
一、选择题(共10分,每小题只有一个正确答案)
1、今年冬天,我国的一些地区连续多天出现大雪天气,致使房屋倒塌,树枝折断,铁路停运,航班停飞,高速公路关闭。雪属于下列中的 ( )
A.溶液 B.悬浊液 C.纯净物 D.胶体
2、某药品说明书中标明,本品每克含碘15mg,镁65mg,铜2mg,锌1.5mg,锰lmg。此处所标成分是指 ( )
A.分子 B.原子 C.单质 D.元素
3、成语、谚语、歇后语、缩语等都是中华民族几千年传统文化的积淀,其中一些包含丰富的化学知识。下列各项中只发生物理变化的是 ( )
A.烈火炼真金 B. 只要功夫深,铁杵磨成针 C. 火树银花 D.雷雨肥庄稼
4、下列各项表达式正确的是 ( )
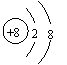 |
A.O2―的结构示意图:
B.Na2S的电子式:![]()
C.甲醛的结构简式:CH2O
D.氮分子的结构式:![]()
5、下列物质固态时,必定是分子晶体的是 ( )
A.酸性氧化物 B.非金属单质 C.碱性氧化物 D.含氧酸
二、选择题(本题共36分),每小题3分,只有一个正确选项。
6、元素周期表中前七周期的元素种数如下表,请分析周期数与元素种数的关系.预言第八周期最多可能含有的元素种数为 ( C )
| 周期 | 一 | 二 | 三 | 四 | 五 | 六 | 七 |
| 元素种数 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
A.18种 B.32种 C.50种 D.64种
7、下列各组物理量中,都不随取水量的变化而变化的是 ( )
A.水的沸点;蒸发水所需热量 B.水的密度;水中通入足量CO2所得溶液pH
C.水的体积;电解水所消耗的电量 D.水的物质的量;水的摩尔质量
8、硫酸铵在强热条件下分解,生成氨、二氧化硫、氮气和水。反应中生成的氧化产物和还原产物的物质的量之比是 ( )
A.1∶3 B.2∶3 C.1∶1 D.4∶3
9、下列反应的离子方程式正确的是 ( )
A.向Ca(ClO)2溶液中通入过量二氧化碳 Ca2++2ClO一+CO2+H2O→CaCO3↓+2HClO
B.铜片加入稀硝酸中 Cu+NO3-+4H+→Cu2++NO↑+2H2O
C.碳酸钙溶于醋酸 CaCO3+2H+→Ca2++CO2↑+H2O
D.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合
Ba2++2OH-+NH4++HCO3-→BaCO3↓+NH3·H2O+H2O
10、有人认为CH2 = CH2与Br2的加成反应,实质是Br2先断裂为Br+和Br-,然后Br+首先与CH2 = CH2一端碳原子结合,第二步才是Br-与另一端碳原子结合。根据该观点如果让CH2 = CH2与Br2在盛有NaCl和NaI的水溶液中反应,则得到的有机物不可能是
( )
A.BrCH2CH2Br B.ClCH2CH2Cl C.BrCH2CH2I D.BrCH2CH2Cl
11、已知可逆反应:aA+bB ![]() cC,物质的质量分数A%和C%随温度的变化曲线如右下图所示,下列说法正确的是
( )
cC,物质的质量分数A%和C%随温度的变化曲线如右下图所示,下列说法正确的是
( )
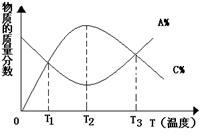 A.该反应在T1、T3温度时达到化学平衡
A.该反应在T1、T3温度时达到化学平衡
B.该反应在T2温度时未达到化学平衡
C.该反应的逆反应是吸热反应
D.升高温度,平衡向正反应方向移动
12、下列有关铁元素的叙述中正确的是 ( )
A.铁是较活泼的金属,它与卤素(X2)反应的生成物都为FeX3
B.氢氧化铁与氢碘酸反应:Fe(OH)3+3HI→FeI3+3H2O
C.氢氧化铁可以由相关物质通过化合反应而制得
D.铁元素位于周期表的第四周期第ⅧB族
13、下列物质中,既可与盐酸反应,又可与氢氧化钠溶液反应的是 ( )
①Na2SiO3;②AlCl3;③NH4HCO3;④Al2O3;⑤NaHSO4
A.①②④ B.②③⑤ C.②③ D.③④
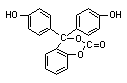
14、某有机物的结构简式为 ,1 mol此有机物与足量NaOH溶液充分
反应,消耗NaOH的物质的量为 ( )
A.2 mol B.3 mol C.5 mol D.6 mol
15、把一小块镁、铝合金放入 6 mol·L-1的NaOH溶液中,可以形成微型原电池。则该原电池负极上发生的电极反应为 ( )
A.Mg-2e-→Mg2+ B.Al+4OH--3e-→AlO2-+2H2O
C.4OH--4e-→2H2O+O2↑ D.2H2O+2e-→2OH-+H2 ↑
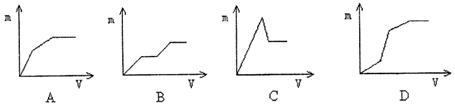
16、向盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀量m与加入的体积V之间的关系不可能是下图中的 ( c)
17、某浓度的硝酸与过量铁粉反应时生成了4.48LN2O气体(标准状况下),若改与铝反应(生成NO气体),则最后可溶解的铝的质量是 ( )
A.13.5g B.9g C.27g D.8.9g
三、选择题(本题共20分),每小题4分,每小题有一个或两个正确选项。只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个该小题不给分。
18、下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C 外,另一产物是盐酸盐。
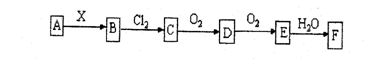
下列说法正确的是 ( )
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和Cl2的反应是非氧化还原反应
D.当X是强酸时,C在常温下是气态单质
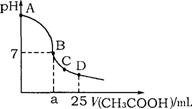
19、在25mL 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是 ( )
A.在A、B间任一点(不含A、B点),溶液中可能有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点,c(Na+)>c(CH3COO-) >c(H+)>c(OH-)
D.在D点,c(CH3COO-)+c(CH3COOH)=c(Na+)
20、依照阿伏加德罗定律,下列叙述中正确的是 ( )
A.同温同压下两种气体的体积之比等于摩尔质量之比
B.同温同压下两种气体的物质的量之比等于密度之比
C.同温同压下两种气体的摩尔质量之比等于密度之比
D.同温同体积下两种气体的物质的量之比等于压强反比
21、设N0为阿伏加德罗常数值,下列有关叙述不正 确的是 ( )
A.常温常压下,lmol甲基(一CH3)所含的电子数为10N0
B.0.4mol以任意比例混合的乙炔和乙醛混合气体,在氧气中充分燃烧。消耗氧气的分子数为N0
C.常温常压下,N0个甲烷分子的体积大于22.4L
D.O.1molK2O2与水反应时,转移的电子数为2N0
22、实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是 ( )
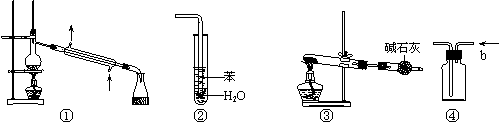 |
A.装置①常用于分离互相溶沸点不同的液体混合物
B.装置②可用于吸收HCl气体,并防止倒吸
C.以NH4HCO3为原料,装置③可用于实验室制备少量NH3
D.装置④b口进气可收集CO2、NO等气体
第II卷(共84分)
四、填充题(24分)
23、(8分)把H2S通入碘水中,过滤出生成的硫,可得一定浓度的氢碘酸,氢碘酸可被空气中的O2氧化为I2。I2在水溶液中易与红磷反应生成PI3,并水解生成HI和H3PO3(亚磷酸)
(1)写出氢碘酸氧化变质的离子方程式,并标出电子转移的方向与数目:
。
(2) (填“能”或“不能”)用浓硫酸与固体NaI共热制HI,原因是:
。
(3)在配制的氢碘酸溶液中,可加入少量的红磷。当该溶液置于空气中时,只要溶液的
| |
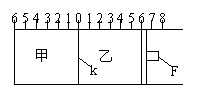 24、(8分)如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)
24、(8分)如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)![]() 2C(g);反应达到平衡后,再恢复至原温度。回答下列问题:
2C(g);反应达到平衡后,再恢复至原温度。回答下列问题:
(1)可根据 现象来判断甲、乙都已达到平衡。
(2)达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范围是 。
(3)若达到平衡时,隔板K最终停留在左侧刻度1处,则甲中C的物质的量为
mol,乙中C的转化率 50%(填:>、<、=),此时,乙中可移动活塞F最终停
留在右侧刻度 处(填下列序号)① <6 ② >6 ③ =6。
(4)若一开始就将K、F固定,其它条件均不变,则达到平衡时:
a.甲、乙中C的摩尔分数是 (填:“甲>乙”或“甲<乙”或“甲=乙” );
b.测得甲中A的转化率为b,则乙中C的转化率为 ;
c.假设乙、甲两容器中的压强比用d表示,则d的取值范围是 。
25、(8分)元素周期表反映了元素性质的周期性变化规律。请根据短周期元素在周期表中的位置、结构和相关性质,回答下列问题:

(1)短周期元素中,原子最外层电子数和电子层数相等的元素有
种。
(2)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如下表1所示,其中C的化学式为 ;第三周期元素单质的熔点(℃)变化如下图I所示,其中h的元素符号为 。
(3)原子半径最小的元素与第二周期的两种元素可分别形成分子甲和离子乙。分子甲和离子乙含有相等的电子数,且乙的立体结构如图II所示。请写出甲、乙反应的离子方程式
。
(4)第二、第三周期的某些元素中能形成具有图II所示的结构单元的单质丙和化合物丁,丙和丁的晶体类型相同,且丙与丁在高温时能发生置换反应。若该反应中丙被破坏了1 mol共价键,则参加反应的丁的质量为 g。
五、实验题(24分)
26、“化学多米诺实验”即利用反应中气体产生的压力和虹吸作用原理,使若干化学实验依次发生,整个过程只须控制第一个反应,就好像多米诺骨牌游戏一样。右图就是一个“化学多米诺实验”。
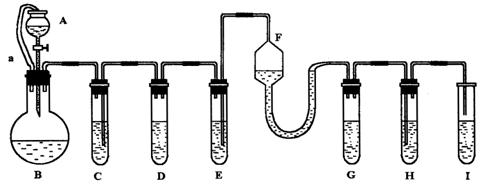
各装置中试剂或物质是:A.2mol/LH2SO4 B.Zn C.2mol/LH2SO4+CuSO4
D.Zn E.CuSO4溶液 F.NH3.•H2O G.30%H2O2 H.H2S溶液 I.NaOH溶液
已知:Cu2++4NH3•H2O →[Cu+(NH3•)4]2+ +4H2O 该反应产物可作为H2O2分解的催化剂。请回答下列问题:
(1)进行实验前必须进行的操作___________________________________。
(2)B与D两容器中反应速率比较B______D(填>、<、=)原因是_ _ ________ __。
(3)H中的现象是_________________________________________________________。
(4)I的作用是(用化学方程式表示)___________________________________。
(5)A和B之间导管a的作用是_________________________________________。
(6)在该实验中不涉及的反应类型是(填序号)____ __。
①分解反应 ②化合反应 ③置换反应 ④复分解反应
27、(18分)某同学用下列装置制备并检验Cl2的性质。
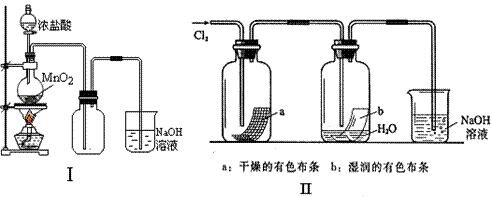 |
(1)II图中褪色的是 (填a或b),烧杯中反应的离子方程式是
(2)①将Cu丝换成Fe丝,做III实验,结果也能点燃,你认为Fe丝也可点燃的理由是 。
a.Fe与Cu都是金属元素 b.Fe的熔点比Cu高
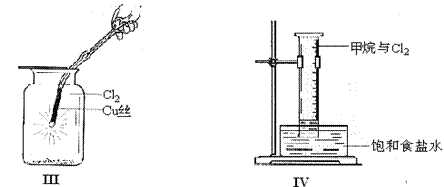 c.Fe的密度比Cu小
d.Fe的金属性比Cu强
c.Fe的密度比Cu小
d.Fe的金属性比Cu强
②通常由燃烧产物(FeCl3)配制其溶液的方法 。
(3)将IV装置放置在光亮的地方(日光没有直接照射),一会儿后,观察到量筒壁上有油状
液滴生成,饱和食盐水中有少量固体析出,量筒内黄绿色气体颜色变浅 ,量筒内液面上升等。
1油状液滴的成分可能是(写分子式) ,
2水槽用饱和食盐水而不用水的原因是_____________ ____________________。
3饱和食盐水中有少量固体析出,其原因是_______________ ______________。
(4)将硫酸溶液滴入II图烧杯中,至溶液显酸性,结果也有Cl2生成,该反应的离子方程
式是 。
六、有机题(20分)
28、
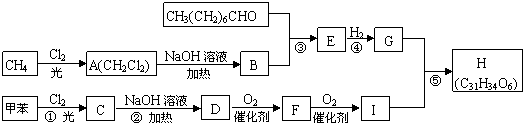 |
一种用于治疗高血脂的新药灭脂灵可按如下路线合成:
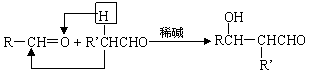 |
已知①
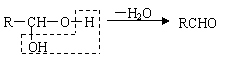 |
②
又知G的分子式为C10H22O3,试回答:
(1)写出B、E的结构简式:B__________________,E_________ _______。
(2)反应①~⑤中属于取代反应的有_____________。
(3)反应②方程式为______________________________________________。
(4)反应⑤方程式为______________________________________________。
29、国家质检总局查处了在食品中使用“雕白块”七大案例。“雕白块”的化学名称为甲醛次硫酸氢钠(NaHSO2·CH2O),违法者往食品中添加“雕白块”是为了漂白增色、防腐、增加米面制品的韧性及口感。但人食用“雕白块”后会刺激肠道,引起过敏和食物中毒,容易致癌。已知“雕白块”是甲醛和次硫酸氢钠(可表示成Na+[OSOH]-)反应制得:
![]() 回答下列问题:
回答下列问题:
(1)“雕白块”_______________(填“易”或“微”或“难”)溶于水。“雕白块”具有________(填“强还原性”或“强氧化性”), 已知“雕白块”溶液中滴加足量碘水反应生成的产物中有甲醛,写出化学方程式_____________________________________。
(2)写出次硫酸氢根的电子式___________________________。
(3)写出水溶液中次硫酸氢钠和氢氧化钾反应的离子方程式__ 。
(4)甲醛能使__________变性凝固,所以可用其浓溶液保存动物标本。
(5)甲醛是非常重要的合成原料。纯净的甲醛在[F3B←O(CH2CH3)2]配位化合物的催化下,加聚生成聚甲醛(是一种优良的工程塑料),聚甲醛的结构简式为_____________;俄国化学家布特列洛夫在1861年首次发现在弱碱作用下,6个甲醛分子加合得到己糖,此己糖的分子式为___________。
(6)已知
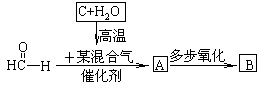
其中A可还原新制的氢氧化铜悬浊液,亦可与乙酸发生酯化反应;B的相对分子质量是甲醛的整数倍,自然界中常以盐的形式存在于多种植物的细胞膜中,B可洗除衣物上的铁锈渍。完成下列填空:
A的同分异构体有(写出结构简式)__________________________________。
A催化加氢的化学方程式____________________________________________。
B可被酸性高锰酸钾溶液氧化,写出B跟稀硫酸、高锰酸钾混合溶液反应的反应式_____ 。
七、计算题(16分)
30、取一定量的Na2CO3、NaHCO3、Na2SO4混合物与250ml 1.00mol/L过量盐酸反应,生成2.016升CO2 (标准状况),然后加入500ml 0.100mol/LBa(OH)2溶液,得到沉淀的质量为2.33g,溶液中过量的碱用10.0ml 1.00mol/L盐酸恰好中和。计算混合物中各物质的质量。
31、(1)现有一类只含碳、氢、氧三种元素的有机物,它们完全燃烧时消耗的氧气与生成的
二氧化碳的体积比(在同温、同压下测定)为3:2。
①这类有机物的通式可表示为_________ __。②这类有机物完全燃烧时,若消耗的氧气
与生成的水的物质的量之比为1:1,则该有机物的结构简式可能为_______ _。
(2)使含有碳、氢、氧三种元素的该某有机物完全燃烧,当消耗的氧气的体积(aL)与生成的二氧化碳的体积(bL)的相对大小不同时,请在下表中填写与该类有机物相应的分子式通式及该类有机物中式量最小者的结构简式。
| a/b的取值范围 | 分子式通式 | 式量最小的该类有机物的结构简式 |
参考答案:
23、(1)4H++4I-+O2=2I2+2H2O(4分)
|
|
(3)2P + 3I2 2PI3 (1分);PI3 + 3H2O 3HI + 3H3PO3(1分)
24、(1)K、F不再移动 (2)0<a<2 (3)1 > ②
(4)a. 甲=乙 b. 1-b c. ![]() <d<
<d<![]() (每空1分)
(每空1分)
25、(1)3 (2分) (2) HF Si (2分)
![]() (3)NH4+ +2H2O NH3·H2O +OH― (2分)
(3)NH4+ +2H2O NH3·H2O +OH― (2分)
(4)15 (2分) (本题共8分)
26、(1)检查装置气密性
(2)<;D中Zn与CuSO4发生反应覆盖在Zn表面形成原电池,从而使反应速率加快
(3)有气泡并有乳白色(或浅黄色)浑浊.
(4)![]()
(5)平衡烧瓶(B)和漏斗(A)的气压,使液体易于流下
(6)B
27、(共12分)
(1) b Cl2+2OH—=Cl—+ClO—+H2O (1×2分)
(2)① d (1分)
② 将FeCl3溶解在较浓的盐酸中,然后再用水稀释到所需浓度 (1分)
(3)1CH2Cl2、CHCl3、CCl4 (分1,不全对不得分)
2降低Cl2在水中的溶解度,抑制Cl2和水的反应 (1分)
3反应中有HCl生成,使溶液中的Cl-浓度增大,促使NaCl的溶解平衡向生成NaCI固体的方向移动 (1分)
(4) Cl—+ClO—+ 2H+= Cl2 ↑+H2O (2分)
28、⑴HCHO 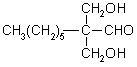 ⑵①②⑤
⑵①②⑤
⑶
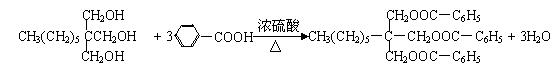 |
29、答案:(1)易。强还原性。NaHSO2·CH2O+2I2+2H2O→4HI+NaHSO4+HCHO。
(2)![]() 。(3)HSO2-+OH-=H2O+SO22-。
。(3)HSO2-+OH-=H2O+SO22-。
(4)蛋白质。(5)![]() 。 C6H12O6。(6)CH3COOH、HCOOCH3。
。 C6H12O6。(6)CH3COOH、HCOOCH3。
HOCH2CHO+H2![]() HOCH2CH2OH
HOCH2CH2OH
5HOOCCOOH+2MnO4-+6H+=10CO2+2Mn2++8H2O
30、m(Na2SO4) = 1.42g m(Na2CO3) = 7.42g m(NaHCO3) = 1.68g
31、 (1)①(CH2)n (H2O)m______。②_CH3CH2OH或CH3OCH3_______。
(2)
| a/b的取值范围 | 分子式通式 | 式量最小的该类有机物的结构简式 |
| 0<a/b<1:1 | (CxOy)n(H2O)m | HCOOH |
| a/b=1:1 | Cn(H2O)m | HCHO |
| 1<a/b<2 | (CxHy)n(H2O)m | CH3OH |