08届高三化学上册第二次月考试题
化学试卷
 考试时间:90分钟 试卷分值:100分
考试时间:90分钟 试卷分值:100分
命题人:陈学龙
可能用到的相对原子质量:O:16 Cl:35.5 Ag:108 H:1 Na:23
第Ⅰ卷(选择题 共45分)
一、选择题(每一题只有一个选项符合题意,每小题3分 ,共45分)
1、在下图所表示的粒子中,氧化性最强的是:( )
A、![]() B、
B、![]() C、
C、 ![]() D、
D、 ![]()
2、根据下列实验事实,能确定某晶体一定是离子晶体的是( )
A、晶体熔点达2500℃ B、晶体不导电,溶于水导电
C、晶体不导电,熔融能导电 D、温度越高,溶解度越大
3、从毒韭菜到炸鸡翅、从速溶茶到儿童奶粉,关于食品质量的报道中不断有①“致癌农药”;②“苏丹红”;③“碘元素”;④“亚硝酸盐”等化学名词出现。上述化学名词所提到的物质中,在某食品添加剂中允许含有且符合限量时不会引起中毒的是( )
A、②③④ B、②③ C、③④ D、只有③
4、下列各离子组,因发生氧化还原反应而不能大量共存的是( )
A、K+、Na+、HSO3—、NO3— B、Mg2+、Al3+、SO42—、OH—
C、K+、Fe2+、Cl—、S2— D、K+、Ba2+、NO3—、SO32—
5、下列反应的离子方程式书写正确的是( )
A、碳酸氢镁溶液和过量NaOH溶液的反应:Mg2+ +2HCO32-+ 2OH-= MgCO3↓+2H2O
B、氢氧化钡溶液滴入硫酸氢钠溶液至中性:Ba2++ 2OH-+ 2H+ +SO42-= BaSO4↓+2H2O
C、亚硫酸钠和足量的稀硝酸混合:SO32-+ 2H+ = SO2↑+ H2O
D、硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2+ +2H+ + H2O2 = Fe3+ + 2H2O
6、NO3-+ Zn + OH- + H2O—NH3 + Zn(OH)42-配平后,离子方程式中H2O的化学计量数是( )
A、2 B、4 C、6 D、8
7、已知反应:⑴101KPa时:2C(S) + O2(g) = 2CO(g);△H = -221 kJ/mol
⑵在稀溶液中:H+(aq) + OH-(aq) = H2O(l);△H = -57.3 kJ/mol
下列结论正确的是( )
A、碳的燃烧热大于110.5 kJ/mol
B、反应⑴的反应热为221 kJ/mol
C、稀硫酸和稀NaOH溶液反应的中和热为-57.3 kJ/mol
D、稀醋酸和稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
8、VL浓度为0.5mol/L的盐酸,欲使其浓度增大一倍,可采取的措施是( )
A、通入标准状况下的HCl气体11.2VL
B、加入10mol/L的盐酸0.1VL,稀释至1.5VL
C、将溶液加热浓缩到0.5VL
D、加入VL1.5mol/L的盐酸混合均匀
9、利用下列试剂,选用合适方法鉴别Na2SO4、Na2SO3、Na2CO3、NaCl四种溶液,最佳试剂组是( )
A、AgNO3和BaCl2溶液 B、BaCl2、HCl、石蕊溶液
C、AgNO3和HNO3溶液 D、BaCl2、HCl、品红溶液
10、某气体的摩尔质量为Mg·mol-1,NA表示阿伏加德罗常数的值,在一定的温度和压强下,体积为VL的该气体所含有的分子数为X。则![]() 表示的是(
)
表示的是(
)
A、以g为单位VL该气体的质量 B、以g为单位1L该气体的质量
C、1L该气体所含的分子数 D、以L为单位1mol该气体的质量
11、下列有关实验操作的叙述不正确的是( )
A、用干燥、洁净的玻璃棒醮取待测液滴在 pH试纸(置于表面皿内)上测溶液的pH
B、在中学“硫酸铜晶体里结晶中含量的测定”的实验中,至少需要进行四次称量操作
C、制备Fe(OH)3胶体时,应往沸水中加饱和FeC13溶液,并继续加热至溶液呈现红
褐色为止
D、烧瓶、锥形瓶、蒸发皿加热时都要垫石棉网
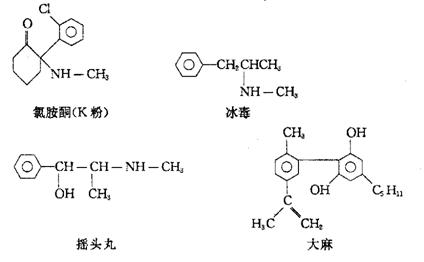
12.以下是四种毒品的结构简式,下列有关说法不正确的是( )
|
A、这四种毒品都各于芳香族化合物
B、K粉的分子式为C13H12C1NO
C、1mol大麻最多可与含3molBr2的溴水发生反应
D、摇头丸在一定条件下可发生加成反应
13、质量分数为a%,物质的量浓度为c mol/L 的KOH溶液,蒸发溶剂,恢复到原来温度,
若质量分数变为2a%,则物质的量浓度变为( )
A、小于2c mol/L B、等于2c mol/L
C、大于2c mol/L D、在c mol/L∽2c mol/L之间
14、鉴别碳酸钠和碳酸氢钠两种溶液,应采用的方法是( )
A、滴加NaOH溶液 B、滴加氯化钙溶液 C、加热 D、滴加石灰水
15、设NA为阿伏加德罗常数值,下列说法正确的是 ( )
A、常温常压下,0.1NA个H2O分子的质量为1.8g
B、7.1g C12变为氯离子时,得到的电子数为0.1NA个
C、20℃、1.01×l05Pa时,11.2 LH2所含原子数为NA个
D、1 L0.2mol·L-1硫酸铁溶液中含有的SO42-离子数目为0.2NA个
第Ⅱ卷(非选择题 共55分)
二、(本题共7小题,共55分)
16、(7分)用![]() 的硫酸配制
的硫酸配制![]() 硫酸,若实验仪器有:
硫酸,若实验仪器有:
A、100mL量筒 B、托盘天平 C、玻璃棒 D、50mL容量瓶 E、20mL量筒
F、胶头滴管 G、50mL烧杯 H、100mL容量瓶
(1)实验时应选用仪器的先后顺序是(填入编号)_________________________。
(2)在容量瓶的使用方法中,下列操作不正确的是(填写编号)___________________。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线2cm~3cm处,用滴管滴加蒸馏水到标线
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近容量瓶刻度标线1cm~2cm处,用滴管滴加蒸馏水到刻度线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次
(3)怎样检查容量瓶是否漏水
。
17、(5分)铁路提速为鲜活水产品、新鲜水果和蔬菜的运输提供了有利条件。在鲜活鱼的长途运输中,必须考虑以下几点:水中需要保持适量的O2;及时除去鱼排出的CO2;防止细菌的大量繁殖。现有两种在水中能起供氧灭菌作用的物质,其性能如下:
过氧化钠(Na2O2):易溶于水,与水反应生成NaOH和O2;
过氧化钙(CaO2):微溶于水,与水反应生成Ca(OH)2(微溶)和O2。
根据以上介绍,你认为运输鲜活水产品时应选择 加入水中。原因是: 。
18、(8分)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是___________________。
(2)该反应中,发生还原反应的过程是_________→______________。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目___________________________________________________________。
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为_____________________________________。
19、(14分)已知A、B、C、D、E为五种短周期不同主族的元素,其原子序数依次递增。A、E两种原子最外层电子数之和是B原子最外层电子数的2倍;C、E两种原子最外层电子数之和是D原子最外层电子数的2倍。A、E形成的化合物分子甲中电子总数为18,D是地壳中含量最多的元素。回答下列的问题。
(1)甲的电子式为 ,其分子为 分子(填“极性”或“非极性”)
(2)工业生产E元素的单质的化学方程式为 。
(3)A单质与C单质在一定条件下可化合为乙,工业生产乙的条件为 ,室温下,向pH=a的乙的水溶液中加入等体积pH=b的甲的水溶液,且a+b=14,充分作用后,溶液pH 7(填“>”“<”或“=”),该溶液中各种离子浓度由大到小的顺序为 。
(4)C、D两元素可形成多种化合物,其中某一化合物含C元素质量分数为46.67%,写出该化合物的化学式 ,将它转化为C的最高价含氧酸的化学方程式为 。
(5)A、B两元素也可形成多种化合物,其中分子量最小的分子为丙,则丙的空间构型为 。用D的单质和丙可以制成原电池,电池中装有浓KOH溶液,用多孔的惰性电极浸入浓KOH溶液 在X极通入化合物丙,Y极通入D的单质,则X极是该电池的 极,X极的电极反应式为 。
20、(12分)某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。
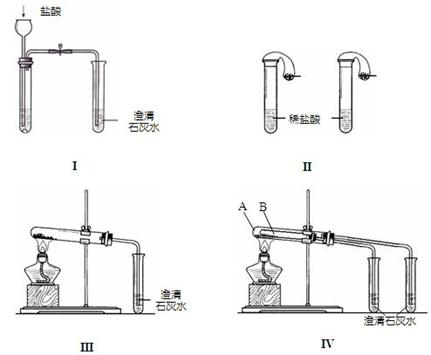
(1) 只根据图I、II所示实验,能够达到实验目的是(填装置序号)__________________; (2)图III、IV所示实验均能鉴别这两种物质,其反应的化学方程式为
______________________________
;与实验III相比,实验IV的优点是(填选项序号)___________________;
A、IV比III复杂
B、IV比III安全
C、IV比III操作简便
D、IV可以做到用一套装置同时进行两个对比实验,而III不行
(3)若用实验IV验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是___________________;
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应。
①当石灰水过量时,其离子方程式为___________________ ;
②当碳酸氢钠与氢氧化钙物质的量之比为2 : 1时,所得溶液中溶质的化学式为___________________,请设计实验检验所得溶液中溶质的阴离子。
_____________________________________________________________________________________ 。
21、(9分)下列框图中的A—J是中学化学中常见的八种物质,所有物质均由短周期元素组
成,已知常温、常压下D为无色液体, C、E、G均为气体单质,B为金属,I是由3个原
子组成的一元含氧弱酸分子, A—J可发生如下转化:
|
|
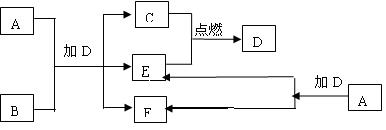
请填写下列空白:
(1)G的名称为 ,F的电子式为 。
(2)15.6gA与D完全反应,转移的电子的物质的量为 。
(3)常温下,A为一种 色的固体,它的一种重要用途是
。
(4)写出D、G反应转化为I和J的离子方程式 。
08届高三第二次月考
化学试卷答案
第Ⅰ卷(选择题 共45分)
一、选择题(每一题只有一个选项符合题意,每小题3分 ,共45分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 | B | C | C | A | B | C | A | B | D | B | D | B | C | B | A |
第Ⅱ卷(非选择题 共55分)
二、(本题共7小题,共55分)
16、(7分)(1)G、E、C、H、F或E、G、C、H、F (3分)
(2)B、C、D(2分)
(3)将瓶塞打开,加入少量水,塞好瓶塞,倒转,不漏水,然后正放,把瓶塞旋转1800,再倒转不漏水,则说明该容量瓶瓶塞严密。(2分)
17、(5分)过氧化钙(或CaO2);(2分)
Na2O2与水反应激烈,生成NaOH溶液的碱性太强(或CaO2在水中逐步溶解,
与水缓慢反应不断提供O2)。(合理即给分)(3分)
18、(8分)(1)H2O2(2分) (2)H2CrO4![]() Cr(OH)3(2分)
Cr(OH)3(2分)
(3)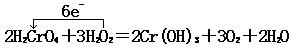 (2分) (4)3.36L(2分)
(2分) (4)3.36L(2分)
19、(14分)
|
(1) (1分) 极性(1分)
|
(2)2NaC1+2H2O 2NaOH+C12↑+H2↑(1分)
(3)200—500atm(或20MPa-50MPa),500℃左右,催化剂(1分)>(1分)
c(NH4+)>c(C1-)>c(OH-)>c(H+)(2分)
(4)NO(1分) 2NO+O2=2NO2 3NO2+H2O=2HNO3+NO(或4NO+3O2+2H2O=4HNO3)(2分)
(5)正四面体(1分) 负(1分) CH4-8e-+10OH-=CO32-+7H2O(2分)
20、(12分)(1)II(1分)
(2)2NaHCO3![]() Na2CO3 + H2O
+ CO2↑(1分) CO2+Ca(OH)2==
CaCO3↓+H2O(1分) D (1分)
Na2CO3 + H2O
+ CO2↑(1分) CO2+Ca(OH)2==
CaCO3↓+H2O(1分) D (1分)
(3)NaHCO3 (1分)
(4)①Ca2+
+ OH– + HCO3– ![]() CaCO3↓
+ H2O(2分) ②Na2CO3(1分)
CaCO3↓
+ H2O(2分) ②Na2CO3(1分)
![]() 取少量上层清液于试管中,加入适量氯化钙溶液,振荡,若有白色沉淀生成,则证明溶液中含有CO32–(四个要点“操作、试剂、现象、结论”每项1分,缺一即扣1分)
取少量上层清液于试管中,加入适量氯化钙溶液,振荡,若有白色沉淀生成,则证明溶液中含有CO32–(四个要点“操作、试剂、现象、结论”每项1分,缺一即扣1分)
21、(9分)(1)氯气(1分), ( 2分)
(2)0.2mol(2分)
(3)淡黄(1分) 作供氧剂(或漂白剂)(1分)
(4)Cl2+H2O=H++Cl—+HClO(2分)