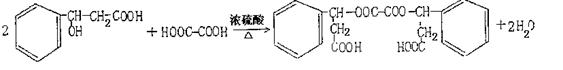
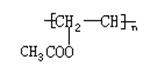高三年级化学下学期联合考试试题
(时间120分,满分150分)
可能用到的相对原子质量:H—1 C—12 O—16 S—32 Na—23 K—39 Ca—40
Fe—56Ag—108
第Ⅰ卷(共66分)
一、选择题(本题共10分,每小题2分,只有一个正确选项,答案写在答题纸上)
1.绿色化学符合“又好又快”新的发展要求,下列生产过程体现绿色化学精神的是( )
A.联合制碱法
B.用氯气消毒自来水
C.以黄铁矿为原料的冶炼金属铁
D.用工业酒精勾兑白酒
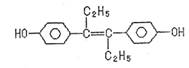
2.化学与生活密切相关,下列有关说法正确的是 ( )
A.淀粉、蛋白质、脂肪都是营养物质,都属于高分子化合物
B.生理盐水的浓度为0.9%
C.“低钠盐”就是氯化钠中加入一定量的氯化钙,降低钠元素的含量
D.家庭可以用明矾将自来水净化成纯净水
3.工业生产氯化钡的主要原料是重晶石,为使重晶石中的钡离子溶解,估计生产中首先和
重晶石反应的物质是 ( )
A.盐酸 B.硝酸 C.炭粉 D.碳酸钠
4.下列化学用语正确的是 ( )
|
C.水分子的电子式: D.钠离子的电子排布式:1S22S22P63S1
5.下列古代发明或活动与化学关系不大的是 ( )
A.黑火药 B.造纸术 C.炼丹术 D.钻木取火
二、选择题(本题共36分,每小题3分,只有一个正确选项,答案写在答题纸上)
6.下列说法正确的是 ( )
A.H2O和D2O互为同位素 B.乙醇和乙二醇互为同分异构体
C.C2H4和C3H6一定属于同系物 D.新戊烷和2,2-二甲基丙烷属于同一种物质
7.既含有极性键又含有非极性键的非极性分子是 ( )
A.H2O2 B.Na2O2 C.C2H2 D.C2H5OH
8.下列变化过程中,体系温度下降的是 ( )
A.硫酸溶于氢氧化钠溶液 B.铝热反应
C.液溴和苯在铁粉存在下制溴苯 D.硝酸铵溶于水
9.一定温度下,影响一定质量气体体积大小的决定因素是 ( )
A.气体的密度 B.气体分子体积的大小
C.气体分子间的平均距离 D.气体的相对分子质量
10.NA代表阿佛加德罗常数,下列说法正确的是 ( )
A.11.2L的臭氧所含原子数为1.5NA
B.286gNa2CO3·10H2O晶体中所含CO32-的数目小于NA
C.3.2g铜和足量的硫反应转移电子数为0.05NA
D.13g13C所含的质子数为13NA
| |
|
A.可以用有机溶剂萃取
B.可与NaOH和NaHCO3发生反应
C.1mol该有机物可以与5molBr2发生反应
D.该有机物分子中,可能有18个碳原子共平面
12.在通常情况下,下列各组微粒能够大量共存的是 ( )
A.SO2、O2 B.NH3、HC1
|
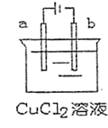
13.下图是用惰性电极电解饱和氯化铜溶液的装
置,有关判断正确的是 ( )
A.电解过程中溶液的pH值保持不变
B.a极是阳极,发生还原反应
C.电解过程中溶液的浓度保持不变
D.电解一段时间后,b电极的质量增加
14.有些反应看起来不能进行,而实际生产中恰
被用来制备带下划线的物质,下列四个反应
中,其反应原理与其它三个反应不同的是 ( )
A.KC1O4+H2SO4→HC1O4+KHSO4 B.KC1+NaNO3→NaC1+KNO3
C.Mg+2RbC1→MgC12+2Rb D.Na+KC1→NaC1+K
15.下列实验能说明氮元素的非金属性较活泼的事实是 ( )
A.常温下氮气很稳定 B.氨气极易溶于水且易液化
C.硝酸易挥发 D.硝酸是强酸
16.下列实验操作不会引起安全事故的是 ( )
A.排水法收集气体后,先熄灭酒精灯,再取出导气管
B.氢气还原氧化铜时,先加热再通入氢气
C.实验室制取氯气时,先加热二氧化锰,后滴入浓盐酸
D.混合浓硫酸和浓硝酸时,应将浓硫酸慢慢加入浓硝酸中并及时搅拦
17.为了进一步提高合成氨的生产效率,科研中最有开发价值的是 ( )
A.录求氮气新来源 B.研制低温下活性较大的催化剂
C.研制500℃左右活性较大的催化剂 D.研制耐高温、高压的新材料
三、选择题(本题共26分,每小题4分,每小题有一个或两个正确选项,只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个不给分,答案写在答题纸上)
18.以下集气装置中不正确的是 ( )
|
A.H2S的收集 B.NO的收集 C.N3的收集 D.C12的收集
19.化学生语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
![]() ( )
( )
A.加热饱和三氯化铁溶液制备氢氧化铁胶体:Fe3++3H2O Fe(OH)3(胶体)
![]() +3H+
+3H+
B.硫氢化钠的水解离子方程式:HS-+H2O H2O++S2-
C.少量氢氧化钙溶液与碳酸氢钙溶液混合离子方程式:Ca2++HCO3-+OH‑→CaCO3↓
+H2O
D.表示氢气燃烧的热化学方程式:2H2+O2→2H2O+QKJ
20.将0.2mol/LNaA溶液和0.1mol/L盐酸等体积混全后,溶液pH>7,则以下关系式错误的是 ( )
| |
B.c(A-)>c(HA)
C.c(Na+)+c(H+)=c(A-)+c(C1-)+c(OH-)
D.c(Na+)=c(A-)+c(HA)
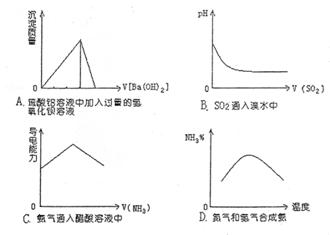
21.下列实验或生产过程中对应的图象正确的是 ( )
|
22.在密闭容器中,将2mol的碳酸钠固体与一定量的过氧化钠固体混合加热,充分作用后过氧化钠无剩余,最终得到固体的物质的量可能为 ( )
A.[1,2]mol B.(1,3)mol C.[2,6]mol D.[2,4]mol
第Ⅱ卷(共84分)
四、(本题共24分)
注意:23题为分叉题,分A、B两题,考生可任选一题。若两题均做,一律按A题记分,A题适合使用二期课改新材料的学生解答,B题适合使用一期课改教材的考生解答。
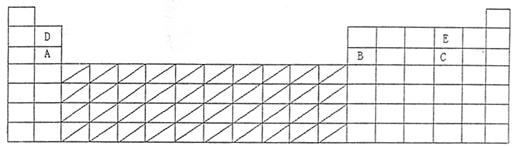
23.(A)元素周期表是学习化学的重要工具,它饮食许多信息和规律。下表所列是五种短周期的原子半径及主要化合价:
| 元素代号 | A | B | C | D | E |
| 原子半径/m | 0.16 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 |
(1)用元素代号标出它们的周期表中对应位置
(2)在上面的元素周期表中通常寻找催化剂材料的区域,用斜线阴影标明。
(3)A、B、E所代表元素的离子半径最大的为 (填离子符号)
(4)周期表有些元素存在“对角线相似”现象,请写出D的单质与强碱溶液反应的离子方程式
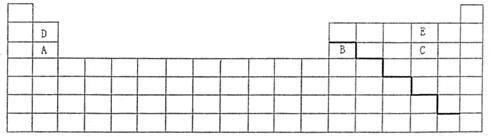
23.(B)元素周期表是学习化学的重要工具,它饮食许多信息和规律。下表所列是五种短周期的原子半径及主要化合价:
| 元素代号 | A | B | C | D | E |
| 原子半径/m | 0.16 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 |
(1)用元素代号标出它们的周期表中对应位置
(2)在上面的元素周期表中通常寻找催化剂材料的区域,用粗线标出。
(3)五种元素中非金属性最强的是 (填元素符号),C、E形成化合物为 (填化学式)
(4)证明B元素与A元素在性质上有明显不同的离子方程式为
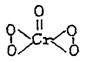
24.K2Cr2O7和H2O2在H2SO4溶液中混合时,可以看到下面两个现象:
(1)混合后5s—10s内,溶液由橙色变暗蓝色;
(2)在80s —160s内由暗蓝色变为绿色,与此同时,放出气泡。
与之相对应的两个方程式为:
A:Cr2O72‑+H2O2→CrO5+H2O
|
CrO5的结构式为
(1)指出A、B是否属于氧化原还反应。
(2)配平A、B反应组成的总反应方程式,并标出反应的电子转移方向和数目。
(3)若反应中生成O211.2L(标准状况),H2O2 (填:得到或失去)电子的数目为 个。
25.醋酸是重要的一元酸,在有机和无机反应中都有应用。
(1)在酯化反应的实验中,乙酸、乙醇的用量和平衡时乙酸乙酯的生成量如下表
| 反应 | 乙醇(kmol) | 乙酸(kmol) | 乙酸乙酯(kmol) |
| 1 | 2 | 2 | 1.33 |
| 2 | 3 | 2 | 1.57 |
| 3 | 4 | 2 | X |
| 4 | 5 | 2 | 1.76 |
①该酯化反应的平衡常数K的表达式为:K=
②由表中数据推测,数值X的范围是 推断的依据为
![]() ③假设乙醇的价格为500/k mol,乙酸乙酯的价格为1600元/kmol,同反应2相比,反应3的经济效益
(填:增加或减少)
③假设乙醇的价格为500/k mol,乙酸乙酯的价格为1600元/kmol,同反应2相比,反应3的经济效益
(填:增加或减少)
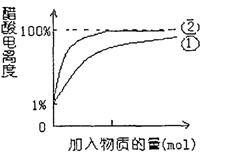
(2)10mL 0.10mol/L的稀醋酸中存在着平衡:CH3COOH CH3COO-+H+。①向稀醋酸中不断加水②向稀醋酸中慢慢滴加0.10mol/L的稀氢氧化钠溶液。①中醋酸电离度的变化图线已画出,请你在下图中画出②过程中醋酸电离度的变化图线
|
五、(本题共24分)
注意:25为分叉题,分A、B两题,考生可任选一题。若两题均做,一律按A题记分,A题适合使用二期课改新材料的学生解答,B题适合使用一期课改教材的考生解答。
26.(A)某学生做元素性质递变实验时自己设计了一套方案,并记录了有关实验现象如下表
| 实验方案 | 实验现象 |
| 1.用砂纸打磨后的镁带与水反应,再向反应后溶液中滴加酚酞 | (A) |
| 2.向新制的氢硫酸饱和溶液中滴加新制的氯水 | (B)产生气体,可在空气中燃烧,溶液变成浅红色 |
| 3.钠与滴有酚酞的试液的冷水反应 | (C)反应不十分强烈,产生的气体可在空气中燃烧 |
| 4.镁带与2mol/L的盐酸反应 | (D)剧烈反应,产生可燃性气体 |
| 5.铝条与2mol/L的盐酸反应 | (E)生成白色胶状沉淀,然后沉淀消失 |
| 6.向氢化铝溶液中滴加氢氧化钠溶液至过量 | (F)生成黄色沉淀 |
请你帮助该同学完成实验报告:
(1)实验的目的 。
(2)实验仪器:① ② ③ ④试管夹⑤镊子⑥小刀⑦玻璃片⑧砂纸等
(3)实验内容:
与实验方案1—6对应的实验现象依次为 (填:字母编号)。
实验现象(A)为: 。
|
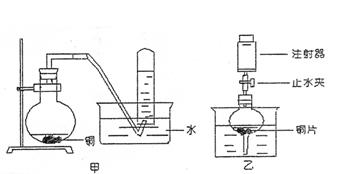
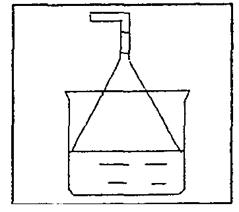
26.(B)下图是甲、乙两位同学研究铜与硝酸反应的装置图,请回答下列问题:
(1)写出铜和稀硝酸反应的离子方程式 。
(2)实验装置甲能否证明铜和稀硝酸反应的产物是NO气 (填:能或否),理由是 。
(3)若用实验装置乙进行实验,检查装置气密性的操作是
。
在烧杯中加入一定体积的稀硝酸,打开止水夹,用注射器慢慢抽干干燥管内的空气,稀硝酸沿着干燥管慢慢上升,直到充满整个干燥管,停止抽拉注射器,关闭止水夹,观察干燥管内的现象是 。反应停止后打开止水夹,用注射器抽取干燥管内的气体(注射器内原有的空气已排尽)。关闭止水夹后取下注射器,并抽取一定量空气,观察到的现象是 。
(4)上述实验完成后,将注射器内的气体通到NaOH溶液中,目的是
。
|
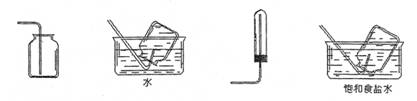
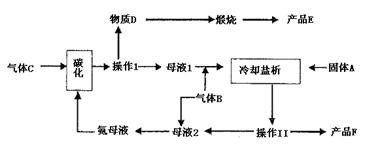
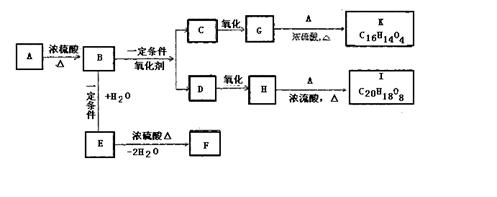
仔细阅读上图,完成下列问题:
(1)写出碳化反应方程式: 。
(2)气体B的分子式为 。向饱和食盐水中应先通入气体 再通入气体 (填气体名称)才能得到物质D,其原因是
。
(3)在下列方框内画出实验室中向饱和食盐水中通入气体B的装置图:
| |
(4)操作Ⅰ的名称是 ,操作Ⅱ的名称是 。进行操作Ⅱ所需要的玻璃仪器是:玻棒、烧杯、 。在实验室里进行煅烧所用的主要仪器是 。
(5)上述生产过程中能循环使用的物质是:C、B、F、 、 。(填:物质编号)
六、(本题共20分)
28.在某工厂在生产维尼纶过程中,先以乙炔和醋酸为原料,通过以下反应制各中间体。
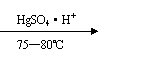 |
CH≡CH+CH3COOH CH3COOH=CH2
(1)以上反应类型是 ,中间体名称是 。
(2)写出中间体通过碳碳双键由小分子变成大分子的反应方程式
。
(3)将中间华体和稀碱溶液共热,可蒸馏出一种有机物甲的水溶液,含2.2g甲的溶液进行银镜反应可得10.8g银,甲的结构简式 。
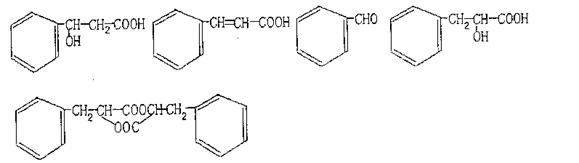
29.已知烯烃在一定条件下可发生下列反应:
|
|
(1)写出A、B、C、D、E、F的结构简式
A 、 B 、C 、D 、D 、F
(2)写出H→I化学方程式:
(3)A的一种同分异构体不能和碳酸钠反应,1molA与足量的金属钠反应,产生标况下11.2L氢气,请写出符合条件的A的一种结构简式 。
七、(本题共16分)
30.将0.03mol的硫酸铁和硫酸亚铁的混合物溶于水中,加入25.0mL 4.00mol/L氢氧化钠溶液,恰好完全反应,再放置一段时间。求:
(1)原混合液中硫酸铁、硫酸亚铁的质量
(2)最后能得到的沉淀的质量
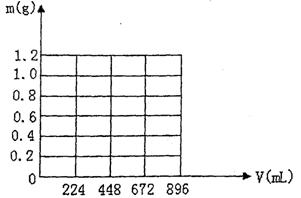
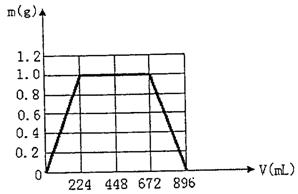
31.将KOH和Ca(OH)2混合物1.86g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体。当生成沉淀的质量刚好最大时,消耗CO2的体积为224mL(标准状况,忽略CO2溶于水情况。以下情况相同。)
(1)生成沉淀的质量刚好最大时,反应的方程式为: 。
(2)原混合物中Ca(OH)2的质量为 g。
(3)沉淀恰好溶解时,消耗CO2的体积为 mL
(4)写出溶液中生成沉淀的质量m(g)与通入CO2的体积V(mL)之间的函数表达式。
|
参考答案
一、选择题
| 1 | 2 | 3 | 4 | 5 |
| A | B | C | B | D |
二、选择题
| 6 | 7 | 8 | 9 | 10 | 11 |
| D | C | D | A | C | B |
| 12 | 13 | 14 | 15 | 16 | 17 |
| A | D | B | D | D | B |
三、选择题
| 18 | 19 | 20 | 21 | 22 |
| AC | C | AB | BD | BD |
四、填空题(24分)
23.(A)(8分)
(1)2分(全对2分,写元素符合的为0分)
|
(3)O2-(2分)
(4)Be+2OH-→BeO22-+H2↑(2分)
23.(B)
(1)2分(全对1分,写元素符号的为0分)
|
(3)O(1分),SO2、SO3(2分,对1个得1分)
(4)2A1+2OH‑+2H2O→2A1O2-+3H2↑(2分)
24.(8分)
(1)A否,B是(2分)
6e
(2)Cr2O72-+3H2O2+8H+→2Cr3++3O2↑+7H2O
(配平2分,转移电子数2分)
(3)失去(1分),NA(1分)
25.(8分)
(1)K=![]() (2分)
(2分)
|
(3)减少(1分)
(4)(2分)
五、实验题(24分)
26.(A)(11分)
(1)探究同周期元素的金属性和非金属性的递变规律(2分)
(2)试管;酒精灯;胶头滴管(3分,对1个得1分错一个扣1分,不出现负分)
(3)B、F、A、D、C、E(2分,错一个为0分)
钠浮在水面上,熔化化成小球,四处浮动,最终消失,溶液变红(2分)
(4)同周期元素从左到右金属性减弱,非金属性增强(2分)
26.(B)(11分)
(1)3Cu+8H++2NO3-→3Cu2++2NO↑+4H2O(2分)
(2)否(1分),因为圆底烧瓶中有空气,空气中的氧气会与NO反应生成NO2,出现红棕色。(1分)
(3)关闭止水夹,将干燥管放入带有水的烧杯中,若干燥管内的液面比烧杯中的液面低,且过一段时间后干燥管内的液面位置保持不变,则表明该装置的气密性良好。(或打开止水夹,慢慢抽拉注射器,水进入干燥管,半闭止水夹,干燥管内液面保持不变。则表明该装置的气密性良好。(2分,其他合理答案都给分)铜片表面有气泡生成,干燥管上部产生无色气体,干燥管内液面下降,溶液呈蓝色。(2分)注射器内气体由无色变红棕色(1分)
(4)用氢氧化钠溶液吸收氮的氧化物,防止污染空气(2分)
27.(13分)
(1)NaC1+H2O+NH3+CO2→NaHCO3↓+NH4C1(1分)
(2)NH3(1分),B,C(2分),先通氨气使溶液碱性增强,能溶解更多的二氧化碳,生成较多的碳酸氢钠,使碳酸氢钠晶体析出。(2分)
|
(4)过滤(1分),漏斗(1分),坩埚(1分)
(5)A、D(2分)
六、有机题20(分)
28.(7)
(1)加成(1分),乙酸乙烯酯(2分)
![]()
|
n CH3COOCH=CH2
(3)CH2CHO(2分)
|
(1)(10分)
(2)(2分)
|
|
(3))(1分)
七、计算题(16分)
30.(6分)
(1)m[Fe2(SO4)3]=4.00 g,(2分) m(FeSO4)=3.04g(2分)
(2)4.28g(2分)
31.(10分)
(1)CO2+Ca(OH)2→CaCO3↓+H2O(1分)
(2)0.74g(2分)
(3)896mL(2分)
(4)(3分)
①0≤V<224 m=V/224
②224≤V≤672 m=1
|