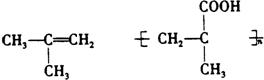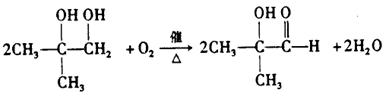高三年级化学第一学期教学质量检测
化 学 试 题
本卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共100分,考试时间90分种。
第Ⅰ卷
注意事项:
1.答第I卷前,考生务必将自己的姓名、考号、考试科目用铅笔涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡 皮擦干净后,再选涂其它答案标号。不能答在试卷上。
3.考试结束,将第Ⅱ卷和答题卡一并交回。
可用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23 Mg—24 Al—27
一、选择题(本大题共14小题,每小题3分,共计42分。在每小题列出的四个选项中,只有一项是最符合题目要求的)
1.为了防止瓦斯爆炸,可采取的措施有:a、定期检查矿井内瓦斯的浓度,保持矿井内有良好的通风状况;b、定期向矿井内撒石灰粉,以除去矿井内的瓦斯;c、用矿井通风和控制瓦斯涌出的方法,防止瓦斯浓度超标;d、定期向矿井内喷洒水,以保持矿井内空气湿润;e、杜绝一切非生产需要的火源;f、矿工戴上防毒面具,以防不测。其中正确的是( )
A.abce B.ace C.acde D.acef
2.背景材料:①2006年5月信息时报报道:世界卫生组织建议每人每天钠的摄取量应少于2000毫克,长期过量摄入钠可能引起高血压、肾病、胃病;②2004年冬季,诺贝尔化学奖授予研究蛋白质的科学家;③2006年初夏,四川大部分地区进行人工降雨;④2005年春末,某高速公路发生液氯运输车翻倒泄露事故。下列相应说法不正确的是 ( )
A.钠单质是一种活泼金属,常常保存在煤油中
B.蛋白质是由氨基酸形成的不可降解的高分子化合物,其水溶液有丁达尔现象
C.AgI和干冰都可用于人工降雨
D.附近人员应迅速远离液氯泄露地点,并逆风往安全区域疏散
|
A.N4属于一种新型的化合物
B.N4转化为N2属于物理变化
C.N4的摩尔质量为56
D.N4与N2互为同素异形体
| |
|
5.下列各组物质的分类都正确的是(括号里的是类别) ( )
A.空气(混合物)、C2H5OH(醇)、H2SO4(离子化合物)、CO2(非电解质)
B.液氨(氢化物)、NH4Cl(铵盐)、HNO3(含氧酸)、NaOH(强电解质)
C.HCl(共价化合物)、CH3COOH(羧酸)、Na2O2(碱性氧化物)、CH3I(卤代烃)
D.NO2(酸性氧化物)、CH3CHO(有机物)、CO(有机物)、CH3COOCH3(酯)
6.运用元素周期律分析下面的推断,其中推断错误的是 ( )
A.氢氧化铍(Be(OH)2)的碱性比氢氧化镁弱
B.哎(At)为有色固体;Hat不稳定;AgAt感光性很强,且不溶于水也不溶于稀酸
C.硫酸锶(HrSO4)是难溶于水的白色固体
D.硒化氢(H2Se)是无色、有毒,比H2S稳定的气体
7.下列影响因素中,既不能改变反应速率常数,也不能改变平衡常数的是 ( )
A.压强 B.催化剂 C.温度 D.固体表面性质
8.X、Y元素的原子,在化学反应中都容易失去电子而形成与Ne相同的电子层结构,已知X的原子序数比Y的原子序数大,下列说法中正确的是 ( )
A.X的金属性比Y的金属性强
B.常温下,X和Y都不能从水中置换出氢
C.Y元素的最高价氢氧化物碱性比X元素最高价氢氧化物碱性强
D.Y元素的最高化合价比X元素的最高化合价高
9.能正确表示下列反应的离子方程式是 ( )
|
B.Na2CO3溶液中通入少量SO2:2CO![]() +SO2+H2O
+SO2+H2O 2HCO![]() +SO
+SO![]()
C.CuSO4溶液中加入Ba(OH)2溶液:SO![]() +Ba2+
+Ba2+ BaSO4↓
D.用食醋溶解水垢:CaCO3+2H2+=Ca2++CO2↑+H2O Mg(OH)2+2H+ Mg2++2H2O
10.要证明某酸是弱酸,下列方法正确的是 ( )
A.将串联一小灯泡的该酸溶液与串联一相同小灯泡的硫酸并联,接通电源后,若该溶液上的灯泡较暗,则说明该酸是弱酸
B.测定该酸的钠盐溶液常温下的pH,若pH>7,则说明该酸是弱酸
C.用该酸与金属锌反应,产生气泡较慢,则说明该酸是弱酸
D.中和等体积等浓度的NaOH溶液消耗该酸的量大于硫酸,则说明该酸是弱酸
![]() 11.近来,科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子作溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更加安全,电池总反应为:C2H5OH+3O2 2CO2+3H2O,下列说法不正确的是 ( )
11.近来,科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子作溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更加安全,电池总反应为:C2H5OH+3O2 2CO2+3H2O,下列说法不正确的是 ( )
A.C2H5OH在电池的负极上参加反应
B.1 mol乙醇被氧化转移6 mol电子
C.在外电路中电子由负极沿导线流向正极
![]() D.电池正极的电极反应为:4H++O2+4e- 2H2O
D.电池正极的电极反应为:4H++O2+4e- 2H2O
12.在火星上工作的美国“勇气号”“机遇号”探测车的一个重要任务就是收集有关Fe2O3及硫酸盐的信息,以证明火星上存在或曾经存在过水,以下叙述正确的是 ( )
A.铝热剂就是单指Fe2O3粉和铝粉的混合物
| |
C.分别还原amol Fe2O3所需H2、A1、CO的物质的量之比为3:2:3
D.明矾属硫酸盐,含结晶,是混合物
|
14.物质的提纯是化学实验中的一项重要操作,也是化工生产及物质制备中的主要环节。下列有关叙述中,不正确的是 ( )
A.乙酸乙酯中混有乙酸,可选用饱和Na2CO3溶液洗涤,然后将两层液体分开
B.在提纯鸡蛋中的蛋白质时,可向鸡蛋清溶液中加入浓(NH4)2SO4溶液,然后将所得沉淀滤出,即得较纯的蛋白质
C.油脂的提纯中,可将油脂加入浓NaOH溶液中加热,然后过滤,滤出的溶液即为较纯的油脂
D.甘蔗是制备蔗糖的主要原料,榨出的甘蔗汁因含色素而呈棕黄色,在制取蔗糖前应先加入适量的活性炭,搅拌、过滤、蒸发结晶,即得较纯的蔗糖
第Ⅱ卷(非选择题 共58分)
注意事项:
1.用钢笔或圆珠笔直接答在试卷中。
2.答题前将密封线内的项目填写清楚。
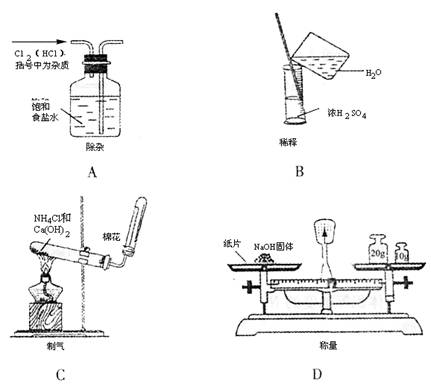
15.(12分)(1)化学实验必须要注意安全,下列做法存在安全隐患的是 (选填序号)
A.氢气还原氧化铜实验中,先加热氧化铜后通氢气。
B.蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拔开橡皮塞并投入碎瓷片。
C.实验室做钠的实验时,余下的钠屑投入到废液缸中。
D.配制浓硫酸与酒精混合液时,将1体积的酒精倒入3体积的浓硫酸中。
E.皮肤沾有少量浓酸时,立刻用大量水冲洗,再涂上稀碳酸氢钠溶液。
F.制乙烯时,用量程为300℃的温度计代替量程为200℃的温度计,测反应液的温度。
(2)已知
电极材料:铁、铜、银、石墨、锌、铝;
电解质溶液:CuCl2溶液、Fe2(SO4)3溶液、盐酸。
接要求回答下列问题:
①电工操作上规定:不能把铜导线和铝导线连接在一起使用。请说明原因
。
 ②若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,
②若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,
外加导线,能否构成原电池? ,
若能,请写出电极反应式,负极 ,
正极 。
③若电极反应为:Cu+2H+=H2↑,请在右边框图内画出实
|
|
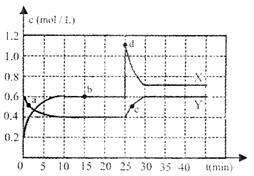
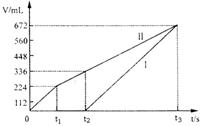
(1)图中共有两条曲线X和Y,其中曲
线 表示N2O4浓度随时间
的变化;a、b、c、d四个点中,表示化
学反应处于平衡状态的是
,并计算该点时反应的平衡常
数为 。
(2)反应进行到25min时,曲线发生变化的
原因是 。
若要达到最后相同的化学平衡关态,在25min时还可以采取的措施是 。
A.升高温度 B.缩小容器体积
C.加入催化剂 D.加入一定量的N2O4
17.(9分)饱和氯水与石灰石的反应是制取较浓的HclO溶液方法之一,某同学运用这一方法,尝试制取HClO溶液并进行了如下定性实验:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液的黄绿色褪去。
②过滤,将滤液滴在有色布条上,发现其漂白性更强。
③为了确定反应产物,将滤液分为三份,分别进行以下实验。
第一份与石灰水混合,立即产生大量白色沉淀。
第二份与稀盐酸混合,立即产生大量气泡。
第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述这验中产生的无色气体均为CO2气体。
(1)试解释可以在饱和氯水中加入石灰石制备HClO的原因
。
(2)写出步骤③中第二份滤液发生反应的离子方程式:
第二份: 。
(3)试根据所学知识推测,在②的滤液中含有的溶质,除了溶解的极少量氯气外,还含有其它溶质为(写化学式) 。
|
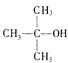
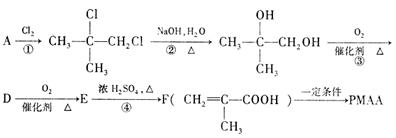
PMAA的路线。已知 结构相似的醇不能被氧化为醛或酸。
|
根据上述过程回答下列问题:
(1)写出结构简式:A PMAA
(2)写出上述过程中的反应类型:① ④
(3)写出③的化学方程式
19.(10分)能源是人类社会发展进步的物质基础,在当代,能源、信息、材料一起构成了现代文明的三大支柱。
(1)为了降低汽车尾气对大气的污染,有关部门拟用甲醇替代液化石油气作为公交车的燃料。已知:在25℃10kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。请写出表示甲醇燃烧的热化学方程式:
。
(2)测定工业甲醇中CH3OH的质量分数可按下法:取0.100g工业甲醇样品,以适量H2SO4酸化后,加入20.00mL 0.200mol·L-1的K2Cr2O7溶液,再用0.3000mol·L-1(NH4)2
Fe(SO4)2标准溶液滴定,耗去此标准液20.200mL时,刚好到达滴定终点。
已知:CH3OH+Cr2O72-+8H+ CO2↑+2Cr3++6H2O
①写出H2SO4酸化的K2Cr2O7溶液与(NH4)2Fe(SO4)2溶液反应的离子方程式。
。
②盛装(NH4)2Fe(SO4)2标准溶液的应为 (“酸式”或“碱式”)滴定管。如果达滴定终点时,仰视读数,则读数偏 。(“大”或“小”)
③此工业甲醇中CH3OH的质量分数 。
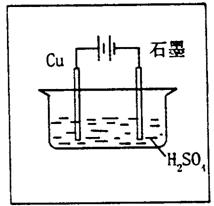
|
(1)原混合溶液NaCl和CuSO4的物质的量浓度。
(2)t2时所得溶液时pH。
参 考 答 案
一、选择题(本题共14小题,每小题3分,共计42分)
1.B 2.B 3.D 4.C 5.B 6.D 7.A 8.C 9.B 10.B 11.B 12.C
13.D 14.C
|
15.(10分,每空2分)
(1)ABCD
(2)①构成原电池,负极铝加快腐蚀
![]() ②能 Cu
Cu2++2e-
②能 Cu
Cu2++2e-
![]() 2Fe2++2e- 2Fe2+
2Fe2++2e- 2Fe2+
③见右图(其他合理答案均得分)
16.(10分,每空2分)
(1)Y b ![]()
(2)增大NO2的浓度 BD
|
(1)饱和氯水中存在如下平衡:Cl2+H2O HCl+HClO;加入石灰石与盐酸反应,使平衡右移C(HClO)增大
(2)HCO3-+H+ H2O+CO32-
(3)HClO Ca(HCO3)2 CaCl2
18.(10分,每空2分)
|
(1)
|
(3)
19.(10分,每空2分)
(1)2CH3OH(1)+3O2(g) 2CO2(g)+4H2O(1)△H=-1451.52kJ/mol
(2)①6Fe2++Cr2O72-+14H+ 6Fe3++7H2O+2Cr3+
②酸式 大 ③96%
20.(7分)
(1)①阳极首先逸出的是氯气
n(NaCl)=2n(Cl2)=0.02mol 则C(NaCl)=0.1mol/L
阳极得到336mL气体中,含0.01mol Cl2和0.005molO2
转移电子的物质的量为:0.01mol×2+0.005mol×4=0.04mol
此过程中阴极刚好全部析出铜
n(CuSO4)=n(Cu)=![]()
则C(CuSO4)=![]()
②t2时溶液中C(Na+)=0.1mol/L,c(SO42-)=0.1mol/L
根据电荷守恒有:C(H+)=2×0.1mol/L-0.1mol/L=0.1mol/L
即溶液的pH=1