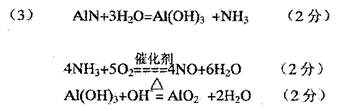高三理科综合能力测试化学部分卷
一、选择题(本题包括 13 小题,每小题只有一个选项符合题意)
6.2006年“9.16 国际臭氧日”纪念大会在吉林省长春市召开,主题是“保护臭氧层,拯救地球生命”、国家环保总局要求自 2007 年 1 月 1 日起,任何企业不得生产以氟氯烃为制冷剂、发泡剂的家用电器产品,不得在家用电器的生产过程中使用氟氯烃作为清洗剂。下列有关叙述正确的是
A.臭氧层可吸收太阳光,可有效解决温室效应
B.氟氯烃能产生活性氯原子,可使臭氧分解,从而破坏臭氧层
C.氟氯烃属于有机化合物,也属于烃
D.臭氧与氧气互为同分异构体,都具有氧化性
7.下列说法不正确的是( N A表示阿佛加德罗常数)
A.常温常压下, 3g 甲醛气体含有的原子数是 0.4NA
B.8g CuO被 CO 完全还原,转移的电子数为0.2 NA
C.100mL lmol · L 一1的 Na3PO4溶液中含有的离子数多于0.4NA
D.60gSiO2中含有 4NA个Si-O仓键, 12g 金刚石中也含有 4NA个 C 一C 键
8.中学阶级介绍的应用电解法制备的物质主要有三种:一是铝的工业制备、二是氯碱工业、三是金属钠的制备。下列关于这三个工业生产的描述中正确的是
A.电解法制铝时一般是用熔融态的氧化铝进行电解但也可用其相应的盐,如熔融态的AlCl3 B.电解法生产铝时,需对铝土矿进行提纯,在提纯过程中应用了氧化铝或氢氧化铝的两性
C.在氯碱工业中,电解池中的阴极产生的是 H2 , NaOH 在阳极附近产生
D.氯碱工业和金属钠的冶炼都用到了NaCl ,在电解时它们的阴极都是 C1一失电子
9.在常温下某化合物的水溶液中,已知由水电离出来的以 c (H+)和 c(OH-)分别为a mol·L-1 和b mol · L-1 ,且 a·b =10-28 ,下列离子组在该溶液中一定能大量共存的是
A.Al3+、 NH4+、 SO42-、 Cl- B.N+、 K 十、SO42- 一、SO32
C.K 十、 Fe2+、 Cl-l 、 MnO4- D.Ba2+、 Na+、 Cl- 、 NO3-
10.从下列事实所得出的相应结论正确的是

11.下列离子方程式中正确的是
A.等物质的量的 NaHSO4与 Ba ( OH ) 2 溶夜反应
Ba2+ +2OH-+2H++ SO42- = BaSO4↓ +2H2O
B.NH4CO3 溶液与过量 NaOH 溶液反应
NH4++OH-=NH3↑+ H2O
C.苯酚钠溶液中通入少量二氧化碳
![]()
D.FeBr2溶液中通入过量 Cl2
2Fe2=+ 2Br一+ 2Cl-, = 2 Fe3++ Br2 + 4Cl-
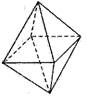 12.
12.![]() 离子具有正八面体的空间结构(如图所示)。 Pt原子位于正八面体的中心, Cl 一离子位于正八面体的 6 个顶点。若用 2 个 NH3分子替换 2 个 C1-离子,则 [Pt ( NH3)2Cl4] 分子的同分异构体数目为:
离子具有正八面体的空间结构(如图所示)。 Pt原子位于正八面体的中心, Cl 一离子位于正八面体的 6 个顶点。若用 2 个 NH3分子替换 2 个 C1-离子,则 [Pt ( NH3)2Cl4] 分子的同分异构体数目为:
A.1 B.2
C.3 D.4
13.已知在某温度下,将 l md SO3充人一定容积的密闭容器中,反应达平衡时混合气体的压强比起始时增大了 20 %。若起始时充人 1 mol SO2和 lmol O2,在相同温度下建立平衡时,SO2的转化率为
A .20 % B.20 %~60 % C.60 % D.> 60 %
二、非选择题:
26 . ( 14 分)下表是元素周期表的一部分,表中用字母列出 11 种元素,请回答:
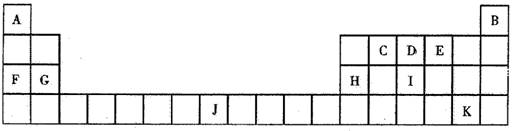
( 1 )上面所列元素的原子中,最外电子层只有两个电子的有(填元素符号)__________;
( 2 )所列元素形成的单质中,有一种通常情况下为液态该单质的化学式是_________, D 的氢化物的沸点比 I 的氢化物的沸点(填“高”或“低, , )_________,主要原因是__________________________________________________________________________________
( 3 )水解反应是一类重要的化学反应,中学已经学习过许多的水解反应。请用所列 11 种元素组成能发生水解反应的物质来回答问题:
① 写出一种由三种元素组成的无机物(用化学式,下同)__________________________
② 写出两种由三种元素组成且所属类别不同的有机物:_______________和___________
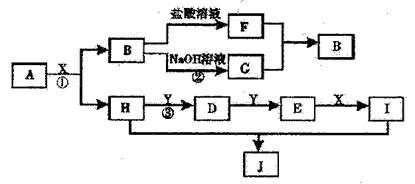
27.(14分)现有物质 A~J ,其转化关系如图所示,己知: A 为两种元素组成的化合物, B 不溶于水,X 常温下为无色液体, E 常温下为红棕色气体。(反应中生成的其他物质己略去)
根据上述转化关系回答问题:
( l )写出下列物质的化学式: X_______________ , J_____________;
( 2 )物质 H 的电子式:________________,物质 J 的晶体类型:__________;
( 3 )按要求写出下列方程式:
写出反应 ① 的化学方程式______________________________________________
写出反应③ 的化学方程式:_____________________________________________
写出反应 ② 的离子方程式__________________________________________________
28.( 14 分) ( I )氢氧化铜是一种常用试剂,例如利用新制氢氧化铜悬浊液验证葡萄糖的还原性。
新制氢氧化铜悬浊液的配制与应用:
( l )实验室制取氢氧化铜悬浊液的操作方法:在试管里加人10%的___________溶液 2mL (填“硫酸铜”或“氢氧化钠, ' ) ,再滴人 2 %的另一种溶液 4 ~5 滴振荡即成。
( 2 )下列各组物质的溶液仅用新制的氢氧化铜悬浊液(可以加热),不能鉴别开来的是
_______________________。
A.HCOOH、C6H5COOH、C6H5CH2OH B.NaHSO4、BaCl2、Na2CO3、酚酞
C.HCOOH、HCOONa、 HCOOCH3 D.葡萄糖、C6H14O6
( II)我国化工专家侯德榜为世界制碱工业作出了突出贡献.他利用 NaHCO3、 NaCl、N H4Cl 等物质溶解度的差异(见下表),以 NaCl、CO2、NH3为原料制得 NaHCO3进而生产出纯碱。
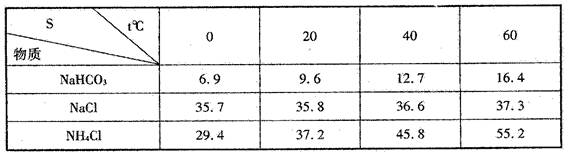
下图是实验室模拟侯氏制碱:
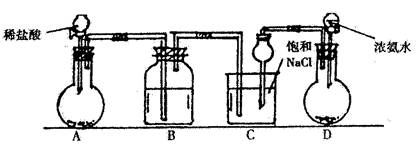
步骤如下:
① 连接装置,检查气密性后装人药品。
② 从 D 的分液漏斗向 D 烧瓶加人浓氨水,直到生成的气体不能再在C中溶解再通人A 产生的气体至 C 中, C 中出现固体,继续通两种气体至不再有固体生成。
③ 过滤C中的悬蚀液,得 NaHCO3固体。
④ 滤液降温后加人适量 NaC1 粉末,并充分搅拌,析出 NH4C1晶体。
请回答下列问题:
( l )烧杯中发生反应的化学方程式为:________________________________________
( 2 ) A 中选用的固体为___________, D 中选用的固体是_____________ B 中选用的液体为_____________________
( 3 )步骤( 2 )先通人 D 产生的气体后通人 A 产生的气体原因是:_______________
________________________________________________________________________。
29. ( l8 分) ( I )有机物 A 在空气中完全燃烧只生成跳H2O 和 CO2,。取 6 . 80g 某液态有机物 A ,置于 10.0 LO2中完全燃烧,产物经浓H2SO4吸收后,浓H2SO4 质量增加 5.4g ,剩余气体经过 CaO吸收,气体体积又减少 5.6L 。(所有体积均为标况下测定)
(l) 6.80g A中C、 H 物质的量之比为_____________, O的物质的量为___________mol
(2)由以上比例能否确定 A 的分子式______________________________;
(3)如果不能确定 A 的分子式,理由是_________________________________________如果能确定 A 的分子式, A 为多元醇,且任意一个羟基被卤素原子取代后得到的一卤代物只有一种,则它的结构简式为______________________________________________________
(III)1976 年压Inouep 报道用 Pd 的一磷化物催化二氧化碳和丁二烯反应,可得的产物之一是甲。若有机物甲与乙互为同分异构体,且乙能与 FeCl3溶液作用显紫色,乙的分子结构中不存在甲基,乙与适量的新制 Cu ( OH )2的悬浊液在加热条件下反应,可以产生砖红色的沉淀。则:
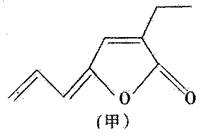
( l )有机物甲的分子式为__________________________________
( 2 )有机物乙含有的官能团是_______________________(写名称)。
( 3 )在一定条件下,能与 1 mol 乙起加成反应的 H2的最大用量为________mol
( 4 )符合上述条件的有机物乙有___________种。
( 5 )若常温下与1 mol 乙起取代反应需耗 Br2的最大用量为 3mol,写出乙与适量的新制 Cu(OH )2的悬浊液在加热条件下反应的化学方程式:
_______________________________________________________________________。
自贡市普通高中 2007 级二诊考试
理科综合能力测试化学部分答案
6.B 7.D 8.B 9.D 10.D 11.C 12.B 13.D
26.(14 分)
( 1 ) He Mg Fe(2 分)
( 2 ) Br2 高 D的氢化物( NH3 ) 分子间存在氢键(每空各 2 分)
( 3 ) 开放性答案合理均可(每空各 2 分)
① 如 Na2CO3 或 Al ( NO3)3 或NaCN或Na3PO4等
② C2H5Br 等溴代烃 CH3COOCH2CH3等酯类
C12H22O11麦芽糖等二糖(C6H10O5) n 淀粉等多糖
27.( 14 分)
(1)H2O NH4NO3 (每空各 2 分)